Защитное действие астрагалозида IV на повреждение клеток PC12, вызванное высокой дозой S-кетамина
Миллионы младенцев и детей младшего возраста во всем мире ежегодно подвергаются общей анестезии. Многочисленные исследования показали, что однократная и кратковременная анестезия не оказывает негативного влияния на развитие нервной системы, однако высокие дозы или многократное воздействие анестезирующих препаратов могут вызвать когнитивную дисфункцию и неврологические нарушения развития. Влияние анестезирующих препаратов на развивающийся мозг привлекает широкое внимание многих родителей.
S-кетамин (SK) - это S-энантиомер кетамина, который был официально одобрен FDA в качестве вспомогательного препарата для лечения тяжелой депрессии в 2019 году. Он также является широко используемым анестетиком в педиатрических и акушерских операциях. Вызывает беспокойство тот факт, что люди, похоже, заинтересованы только в изучении его антидепрессивного действия, не обращая особого внимания на потенциальные риски, которые он может вызвать. В недавнем исследовании было проанализировано 962 нежелательных явления, связанных с SK, и выяснилось, что вероятность возникновения побочных реакций выше у женщин, пациентов, получавших высокие дозы SK, и пациентов, получавших несколько препаратов. Поэтому очень важно изучить механизм SK-индуцированного повреждения нервов и найти соответствующие меры по преодолению последствий анестезии как для младенцев, так и для взрослых.
Астрагалозид IV (ASIV) - один из основных активных ингредиентов, выделенных из традиционного китайского препарата Astragalus membranaceus. Исследования показали, что он обладает широким спектром фармакологических эффектов, включая противоопухолевое, противовоспалительное, антиоксидантное, антифибротическое и антиапоптотическое действие. Кроме того, доказано, что он является естественным нейропротекторным средством. Однако существует мало сообщений о том, может ли ASIV облегчить повреждение нервов, вызванное анестезирующими препаратами. Поэтому в данном исследовании была выбрана широко используемая нейрональная клеточная линия клеток феохромоцитомы надпочечников крысы, а именно клетки PC12, для создания модели повреждения СК in vitro, изучения нейропротекторного эффекта ASIV и создания рекомендаций для рационального использования СК и разработки новых лекарственных средств для ASIV.




Нейротоксичность анестезирующих средств всегда вызывала озабоченность международного сообщества. Управление по контролю качества пищевых продуктов и лекарственных средств США и Международная ассоциация по изучению анестезиологии провели совместное заседание, на котором обсудили важность стандартизации доклинических исследований и установления стандартов отчетности по перинатальной нейротоксичности, вызванной анестезией, и предложили использовать новые методы для решения некоторых из основных проблем в этой области. Что касается кетамина, то, в отличие от большинства анестетиков, он является антагонистом NMDA-рецепторов. Лекарственная блокада NMDA-рецепторов может изменить баланс возбуждения и торможения, необходимый для развития мозга, что приводит к нейротоксичности. Исследования показали, что кетамин может вызывать нейротоксичность у людей через митохондриальный путь апоптоза в зависимости от времени и дозы, в то время как его энантиомер S-кетамин не вызывал подобных побочных эффектов. Поэтому можно предположить, что при достижении определенного порога концентрации SK также может активировать митохондриальный путь апоптоза и вызывать апоптоз клеток.
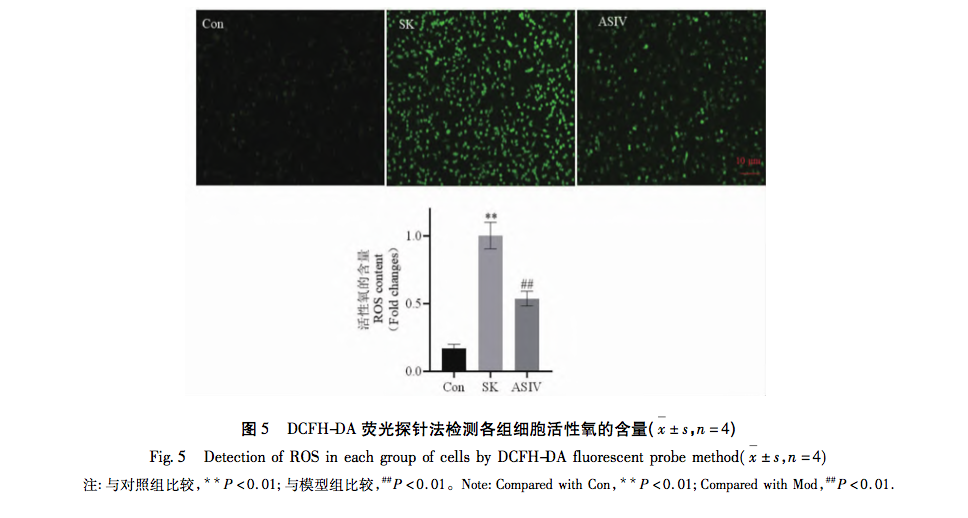
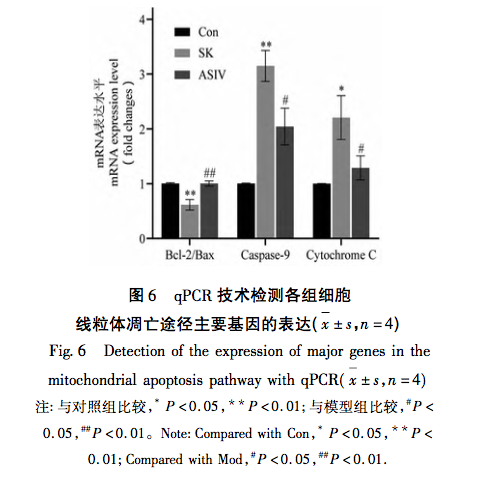
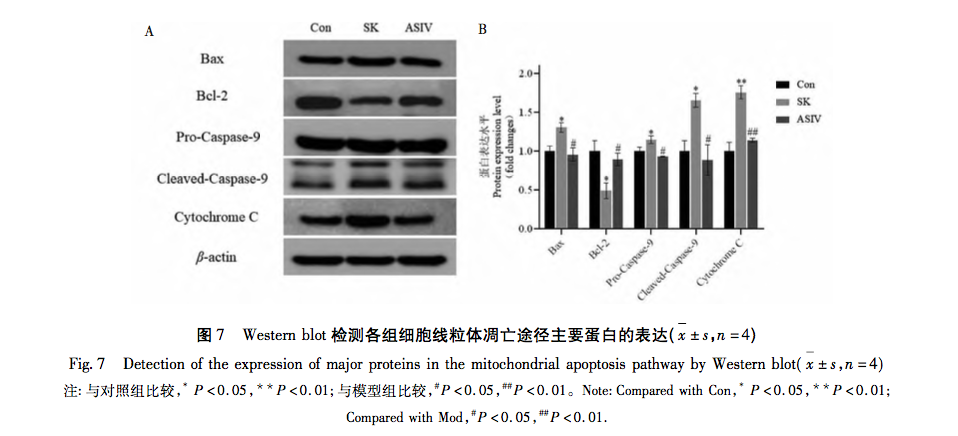
Митохондрии, являясь центром клеточного метаболизма и главным регулятором окислительно-восстановительного баланса, играют важнейшую роль в возникновении и развитии заболеваний. Среди множества физиологических реакций, опосредованных митохондриями, окислительный стресс является одним из ключевых факторов активации митохондриального пути апоптоза, а избыток РОС - материальной основой возникновения окислительного стресса. Доказано, что широко используемые в клинической практике анестетики способствуют развитию или снижению степени окислительного стресса. Например, ингаляционный анестетик севофлуран может вызывать апоптоз нейронов за счет увеличения внутриклеточной концентрации Ca2+, повышения уровня ROS и экспрессии белков, связанных с митохондриальным путем апоптоза: Cleaved-Caspase-9, Cytochrome C и Bax/Bcl-2. Местный анестетик бупивакаин активирует ROS-опосредованную аутофагию, что приводит к нарушению потока аутофагии и снижению жизнеспособности клеток. Однако применение препаратов, уничтожающих реактивные виды кислорода, может значительно обратить вспять это аутофагическое повреждение. В митохондриальном пути увеличение содержания ROS приводит к изменению относительных уровней экспрессии Bax и Bcl-2. Bax активируется и олигомеризуется на внешней мембране митохондрий, а затем связывается со специфическими молекулами, изменяя проницаемость митохондриальной мембраны. В результате цитохром С высвобождается из митохондрий в цитоплазму, связывается с такими факторами, как Apaf-1, образуя апоптотические тельца, и активирует Pro-каспазу-9 для расщепления. Расщепленная каспаза-9 активирует нижележащие апоптотические факторы, способствуя апоптозу клеток.
Астрагалозид IV - натуральное активное вещество с сильными антиоксидантными свойствами, и исследования показали, что некоторые его эффекты тесно связаны с митохондриями. Например, ASIV может способствовать митохондриальной аутофагии, уменьшать накопление поврежденных митохондрий и генерацию митохондриальных реактивных форм кислорода. Лю и др. также обнаружили, что ASIV могут оказывать нейропротекторное действие, воздействуя на альфа-синуклеин, белок, расположенный во внутренней мембране митохондрий и высоко экспрессирующийся в мозге человека. Как видно, ASIV обладает потенциалом для лечения повреждений нервов, вызванных анестезирующими препаратами.
Основываясь на результатах и анализе вышеприведенных исследований, в данной работе был проведен эксперимент in vitro с использованием митохондриального пути апоптоза в качестве ключа к лечению повреждений нервов, вызванных высокой дозой SK, с помощью ASIV. Конечные экспериментальные концентрации SK и ASIV были определены как 450 мк г/мл и 25 мк моль/л, соответственно, с помощью анализа CCK-8. Кроме того, в ходе эксперимента было установлено, что клетки PC12, подвергшиеся воздействию высоких доз SK, не только демонстрировали значительное увеличение скорости апоптоза и содержания ROS, но и активировали основные молекулы Bax, Bcl-2, каспазу-9 и цитохром C в митохондриальном пути апоптоза. Это указывает на то, что высокая доза SK индуцирует апоптоз в клетках PC12 путем активации ROS-опосредованного митохондриального пути апоптоза. После лечения ASIV эти изменения, индуцированные SK, были значительно подавлены, что свидетельствует о том, что ASIV оказывает определенное защитное действие на клетки PC12 во время этого процесса.
Таким образом, астрагалозид IV способен смягчать индуцированные высокой дозой S-кетамина повреждения в клетках PC12, а механизм его действия может быть связан с ингибированием митохондриального пути апоптоза.
