Efecto protector del astragalósido IV en la lesión de células PC12 inducida por altas dosis de S-ketamina
Millones de lactantes y niños pequeños de todo el mundo reciben anestesia general cada año. Numerosos estudios han demostrado que la anestesia única y de corta duración no tiene efectos adversos en el desarrollo del sistema nervioso, pero las dosis altas o la exposición repetida a fármacos anestésicos pueden causar disfunción cognitiva y trastornos neurológicos del desarrollo. El impacto de los fármacos anestésicos en el cerebro en desarrollo ha atraído la atención de muchos padres.
La S-ketamina (SK) es el enantiómero S de la ketamina y fue aprobada oficialmente por la FDA como fármaco adyuvante para el tratamiento de la depresión grave en 2019. También es un anestésico de uso común en cirugías pediátricas y obstétricas. Es preocupante que la gente parezca solo interesada en estudiar sus efectos antidepresivos, sin prestar demasiada atención a los riesgos potenciales que puede causar. Un estudio reciente analizó 962 acontecimientos adversos relacionados con el SK y descubrió que los pacientes de sexo femenino, los que recibían dosis elevadas de SK y los que recibían tratamientos farmacológicos múltiples tenían una mayor probabilidad de experimentar reacciones adversas. Por lo tanto, es de gran importancia explorar el mecanismo del daño nervioso inducido por la SK y encontrar las medidas de afrontamiento correspondientes tanto para la anestesia infantil como para la de adultos.
El astragalósido IV (ASIV) es uno de los principales principios activos aislados de la medicina tradicional china Astragalus membranaceus. Los estudios han demostrado que tiene una amplia gama de efectos farmacológicos, incluidos los efectos antitumorales, antiinflamatorios, antioxidantes, antifibróticos y antiapoptóticos. Además, se ha demostrado que es un agente neuroprotector natural. Sin embargo, existen pocos informes sobre si la ASIV puede aliviar el daño nervioso causado por fármacos anestésicos. Por lo tanto, en este estudio se seleccionaron células de feocromocitoma suprarrenal de rata de la línea celular neural de uso común, concretamente células PC12, para construir un modelo de lesión in vitro de SK, explorar el efecto neuroprotector de ASIV y proporcionar una referencia para el uso racional de SK y el desarrollo de nuevos fármacos para ASIV.




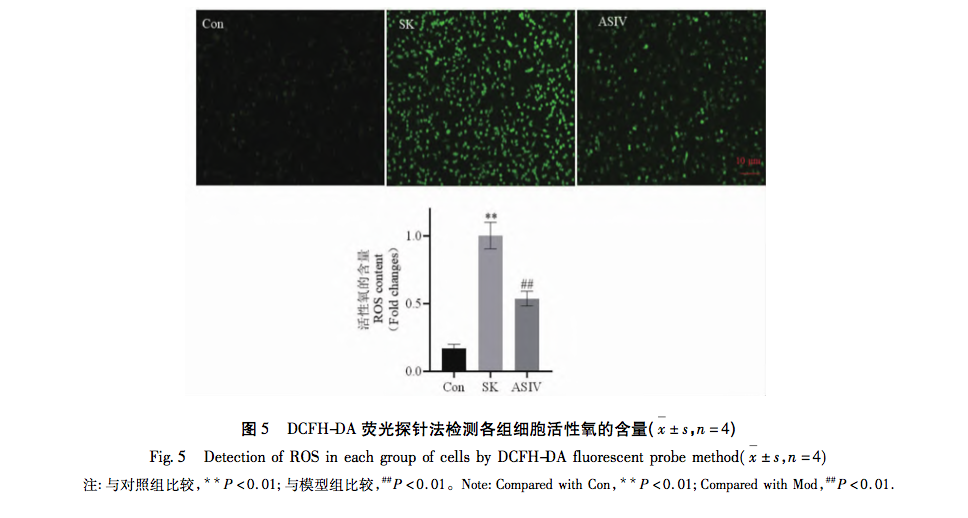
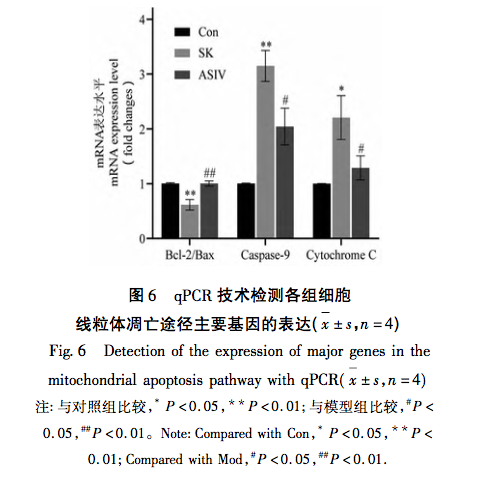
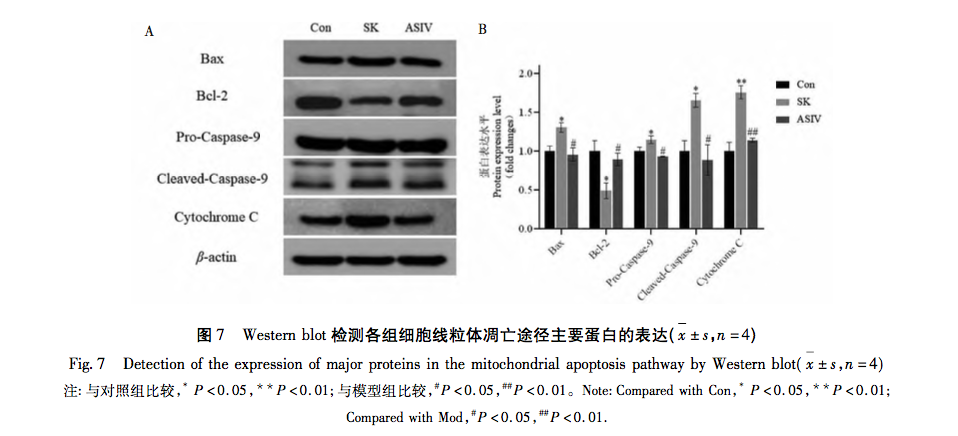
La neurotoxicidad de los fármacos anestésicos siempre ha preocupado a la comunidad internacional. La Administración de Alimentos y Medicamentos de EE.UU. y la Asociación Internacional para el Estudio de la Anestesiología celebraron una reunión conjunta para debatir la importancia de normalizar la investigación preclínica y establecer normas de notificación de la neurotoxicidad perinatal inducida por la anestesia, y sugirieron el uso de métodos novedosos para abordar algunos de los principales problemas en este campo. En cuanto a la ketamina, a diferencia de la mayoría de los anestésicos, es un antagonista de los receptores NMDA. El bloqueo farmacológico de los receptores NMDA puede alterar el equilibrio excitatorio inhibitorio necesario para el desarrollo del cerebro, provocando neurotoxicidad. Los estudios han demostrado que la ketamina puede inducir neurotoxicidad en humanos a través de la vía de la apoptosis mitocondrial de forma dependiente del tiempo y de la dosis, mientras que no se ha informado de que su enantiómero S-ketamina produzca efectos secundarios similares. Por lo tanto, se especula que cuando se alcanza un determinado umbral de concentración, la SK también puede activar la vía de la apoptosis mitocondrial y provocar la apoptosis celular.
Las mitocondrias, como centro del metabolismo celular y principal regulador del equilibrio redox, desempeñan un papel crucial en la aparición y el desarrollo de enfermedades. Entre las muchas reacciones fisiológicas mediadas por las mitocondrias, el estrés oxidativo es uno de los factores clave en la activación de la vía de la apoptosis mitocondrial, y el exceso de ROS es la base material de la aparición del estrés oxidativo. Se ha demostrado que los anestésicos de uso común en la práctica clínica favorecen o reducen el grado de estrés oxidativo. Por ejemplo, la anestesia inhalatoria sevoflurano puede inducir la apoptosis neuronal al aumentar la concentración intracelular de Ca2+, elevar los niveles de ROS y aumentar la expresión de las proteínas relacionadas con la vía de la apoptosis mitocondrial Cleaved-Caspase-9, Citocromo C y Bax/Bcl-2. El anestésico local bupivacaína activa la autofagia mediada por ROS, lo que provoca un deterioro del flujo de autofagia y una disminución de la viabilidad celular. Sin embargo, el uso de eliminadores de especies reactivas del oxígeno puede revertir significativamente este daño autofágico. En la vía mitocondrial, el aumento del contenido de ROS provoca cambios en los niveles relativos de expresión de Bax y Bcl-2. Bax se activa y se oligomera con Bax. Bax se activa y oligomeriza en la membrana externa de las mitocondrias, y posteriormente se une a moléculas específicas para alterar la permeabilidad de la membrana mitocondrial. Por consiguiente, el citocromo C se libera de las mitocondrias al citoplasma, uniéndose a factores como Apaf-1 para formar cuerpos apoptóticos y activando la Pro-Caspasa-9 para su escisión. La Caspasa-9 escindida activa a su vez factores apoptóticos relacionados, promoviendo la apoptosis celular.
El astragalósido IV es una sustancia activa natural con fuertes propiedades antioxidantes, y las investigaciones han demostrado que algunos de sus efectos están estrechamente relacionados con las mitocondrias. Por ejemplo, el ASIV puede promover la autofagia mitocondrial, reducir la acumulación de mitocondrias dañadas y la generación de especies reactivas de oxígeno mitocondriales. Liu et al. también descubrieron que los ASIV pueden ejercer efectos neuroprotectores al dirigirse a la alfa sinucleína, una proteína localizada en la membrana interna de las mitocondrias y altamente expresada en el cerebro humano. Se puede observar que los ASIV tienen potencial para tratar los daños nerviosos causados por los fármacos anestésicos.
Sobre la base de los resultados de la investigación y el análisis anterior, este estudio llevó a cabo un experimento in vitro utilizando la vía de la apoptosis mitocondrial como una pista para el tratamiento de altas dosis de SK inducida por daño nervioso con ASIV. Las concentraciones experimentales finales de SK y ASIV se determinaron en 450 μ g/mL y 25 μ mol/L, respectivamente, utilizando el ensayo CCK-8. Además, el experimento encontró que las células PC12 expuestas a altas dosis de SK no sólo mostraron un aumento significativo en la tasa de apoptosis y el contenido de ROS, sino que también activaron las principales moléculas aguas arriba Bax, Bcl-2, Caspasa-9, y citocromo C en la vía de la apoptosis mitocondrial. Esto indica que las dosis altas de SK inducen la apoptosis en las células PC12 mediante la activación de la vía de la apoptosis mitocondrial mediada por ROS. Tras el tratamiento con ASIV, estos cambios inducidos por SK se inhibieron significativamente, lo que demuestra que ASIV tiene un cierto efecto protector sobre las células PC12 durante este proceso.
En resumen, el astragalósido IV puede aliviar el daño inducido por altas dosis de S-ketamina en las células PC12, y su mecanismo puede estar relacionado con la inhibición de la vía de la apoptosis mitocondrial.
