A dihidromiricetin mechanizmusának feltárása a vesefibrózis javításában db/db egerekben a hálózati farmakológia és a kísérleti ellenőrzés alapján
A diabetes nephropathia (DKD) a 2-es típusú diabetes mellitus (T2DM) egyik legfontosabb mikrovaszkuláris szövődménye és a végstádiumú vesebetegség fő oka. Fő jellemzői a glomeruláris bazális membrán megvastagodása, a mesenterium és a tubulointerstitialis mátrix kitágulása, valamint a podociták elvesztése, ami mikroalbuminuria és csökkent vesefunkció kialakulásához vezet. A diabéteszes vesebetegség (DKD) folyamatos fejlődésével a veseszövet mikrostruktúrája tartós gyulladáson és károsodáson megy keresztül, ami diffúz intersticiális fibrózishoz vezet, amely elpusztítja a normális vese mikrostruktúráját, és végül vesefibrózissá (RF) fejlődik. Jelenleg a DKD RF-hez való progressziójának enyhítésére szolgáló eszközök elsősorban a DKD javítására összpontosítanak. A cukorbetegség legtöbb szövődményének, köztük a DKD-nek a mechanizmusa azonban még nem tisztázott, így a DKD RF-vé alakulásának komplex mechanizmusa nem világos, ami a DKD és az RF nem kielégítő terápiás hatásaihoz vezet. Ezért sürgős a DKD patogenezisének feltárása és új terápiás célpontok felfedezése a kialakulásának gátlása érdekében.
A dihidromiricetin (DHM) egy természetes flavonoid vegyület, amely különböző farmakológiai hatásokkal rendelkezik, beleértve a gyulladáscsökkentő, antioxidáns, szabadgyök-fogó, a mitokondriális diszfunkció javítását és az autofágia szabályozását. Jelenleg több tanulmány is kimutatta, hogy a DHM nagy potenciállal rendelkezik az anyagcsere-betegségek kezelésében. Nemcsak az autofágia indukálásával, az oxidatív stressz javításával, a gyulladás gátlásával és a mitokondriális aktivitás növelésével javíthatja az inzulinrezisztenciát és csökkentheti a vércukorszintet, hanem; Ugyanakkor javíthatja a cukorbetegség számos szövődményét, például a cukorbetegség encephalopathiáját, a cukorbetegség kardiomiopátiáját stb. A cukorbetegség szövődményeit javító DHM-re vonatkozó kutatás azonban nem elegendő, és a kapcsolódó farmakológiai mechanizmust még tovább kell vizsgálni. Ezenkívül korlátozott a kutatás arra vonatkozóan, hogy a DHM tovább javíthatja-e a DHM által okozott RF-t, és a terápiás hatás még mindig nem világos.
A hálózati farmakológia a hagyományos kínai gyógyászat összetevőinek szerkezete, biológiai hatásai és a betegséggel kapcsolatos célpontok alapján a biológiai folyamatok hatalmas hálózatának összefüggésében egy "gyógyszerösszetevő célbetegség" kölcsönhatási hálózatot építhet fel. Ez hatékony eszköz a hagyományos kínai orvoslás hatékony összetevőinek, molekuláris mechanizmusainak és potenciális célpontjainak feltárására. A molekuláris dokkolás képes szimulálni a molekulák és fehérjék közötti kölcsönhatást, megjósolni a ligandumok és receptorok konformációját, kiszámítani és megjósolni az affinitást és a kötődési módokat, hogy ellenőrizni lehessen a gyógyszerkomponensek fő célpontokra gyakorolt specifikus hatásmódját. Ezért ez a tanulmány hálózati farmakológiát használt a DHM potenciális célpontjainak szűrésére és előrejelzésére a DKD és RF esetében, felépített egy "komponens-célbetegség" kölcsönhatási hálózatot, és validálta a megjósolt fő célpontokat molekuláris dokkolással és in vivo kísérletekkel. Feltártuk a dihidromiricetin vesefibrózist javító molekuláris mechanizmusát a db/db egerekben, elméleti alapot szolgáltatva a DHM klinikai alkalmazásához.



Jelenleg a cukorbetegség általános kezelése elsősorban a vércukorszint szabályozásán múlik, míg a cukorbetegség egyik legsúlyosabb szövődményének, a DKD-nek nincs hatékony kezelési stratégiája. Ezért nagyon fontos a DKD patogenezisének mélyreható megértése és hatékony kezelési stratégiák megtalálása a DKD vesefibrózissá alakulásának elfojtására. A természetes gyógyszerek bizonyítottan egyedülálló előnyei közé tartozik a kevesebb mellékhatás és a több célpontot érintő hatékonyság, ami az utóbbi években a krónikus betegségek új gyógyszereinek kifejlesztésében fontos forrássá tette őket. A DHM további kutatása jelentős terápiás potenciált tárt fel az anyagcsere-betegségek javításában. Ezért a DHM által a vesefibrózis javulása a db/db egerekben, ez a tanulmány a hálózati farmakológiát és a molekuláris dokkolási technológiát kombinálja a DHM potenciális terápiás célpontjainak és molekuláris mechanizmusainak feltárására a vesefibrózis javításában a db/db egerekben, és állatkísérleteken keresztül ellenőrzi őket.
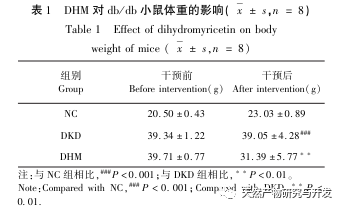
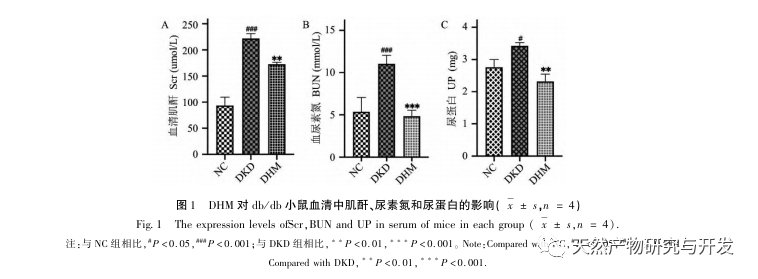
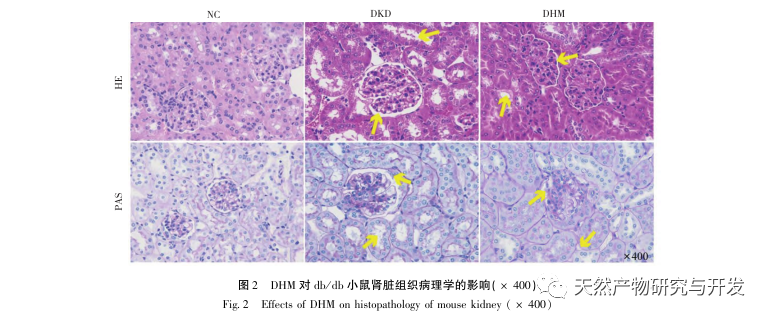
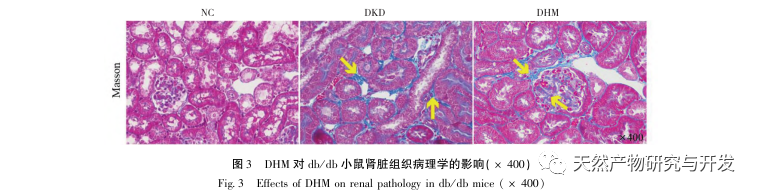
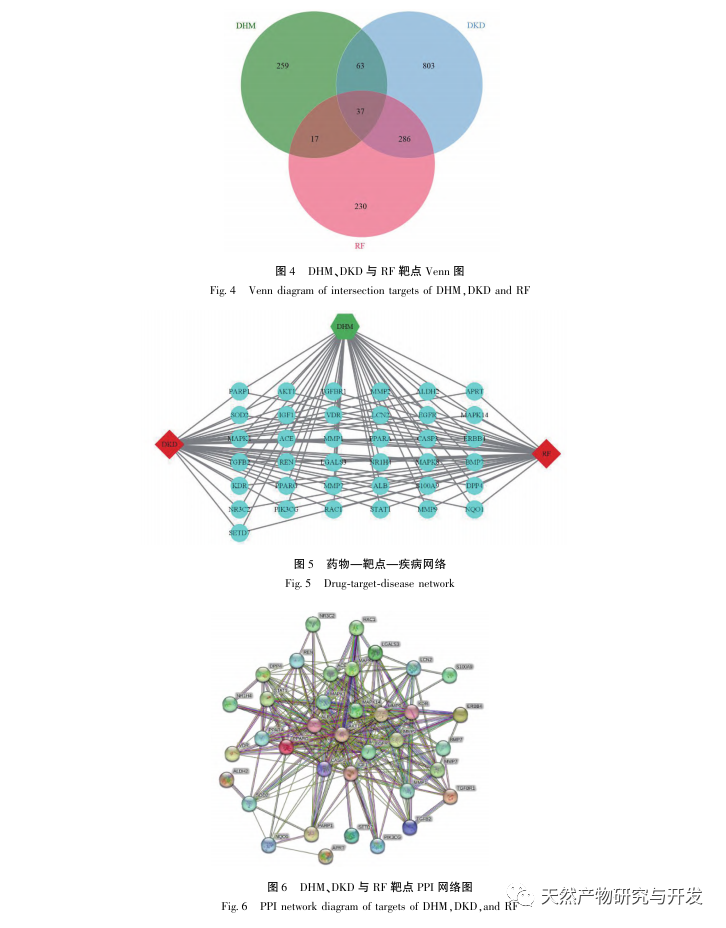
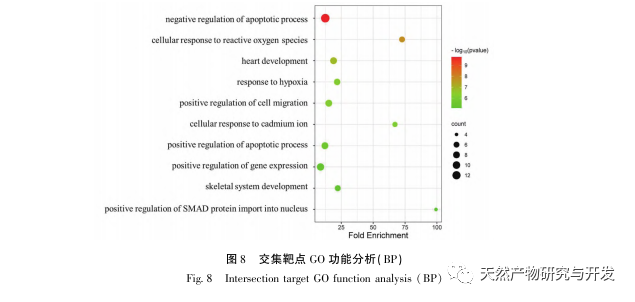
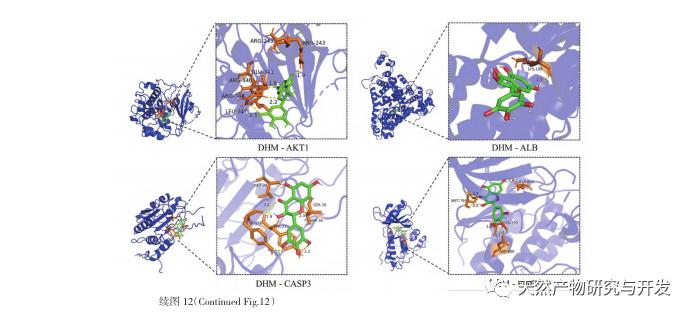
Először is, megfigyeltük, hogy a 10 hetes DHM beavatkozás hatékonyan enyhíti a vércukorszintet, a testtömeget, a kreatinint, a karbamid nitrogént, a vizeletfehérjét és a vese patológiai megnyilvánulásait a db/db egerekben, ami azt jelzi, hogy a DHM enyhítheti a vesefunkció károsodását és lassíthatja a DKD kialakulását a db/db egerekben. A DHM, a DKD és az RF 37 egymást keresztező célpontjának elemzése és szűrése után megállapították, hogy 10 célpont, köztük az AKT1, ALB, CASP3, EGFR, MMP9, IGF1, PPARG, KDR, MMP2, ACE, kulcsfontosságú célpontjai lehetnek a DHM-nek a DKD javítására. Az AKT1, CASP3, EGFR, MMP9, IGF1, MMP2, ACE bizonyítottan aktiválódnak a cukorbetegség környezetében, és a specifikus gátlás javíthatja a DKD károsodott állapotát és lassíthatja a fibrózis fejlődési tendenciáját. A PPARG és a KDR gátolt a cukorbetegség fiziológiás környezetében, és szerepet játszik a vese védelmében az aktiválást követően. Az ALB fontos biokémiai indikátor a vesekárosodás mértékének megfigyelésére a cukorbetegség kialakulása során. A DKD kialakulásával általában növekszik, és a DKD javulása után csökken. Ez azt jelenti, hogy az általunk átvizsgált 10 kulcsfontosságú gén nemcsak a DKD potenciális biomarkereként, hanem a DKD patogenezisének és kezelésének további feltárásához kulcsfontosságú célpontként is szolgálhat.
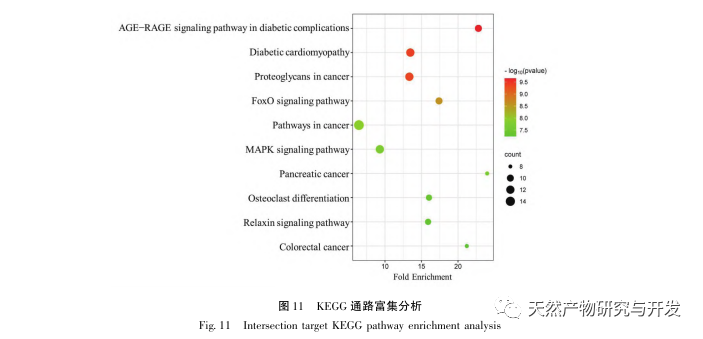
A KEGG útvonalak gazdagodási elemzése azt mutatta, hogy a DHM javulása a DKD-nél magában foglalhatja az AGE-RAGE jelátviteli útvonalat, a diabéteszes kardiomiopátiát és a FoxO jelátviteli útvonalat. Az AGE-RAGE jelátviteli útvonal és a FoxO jelátviteli útvonal kulcsfontosságú szabályozó szerepet játszik a DKD kialakulásában. A kutatások azt találták, hogy az AGE-k specifikusan aktiválódnak a DKD betegek endotélsejtjeiben, vesetubulusaiban, mezangiális sejtjeiben és podocitáiban, és kölcsönhatásuk a RAGE-vel fokozódik, tovább súlyosbítva az oxidatív stresszt és a gyulladást a vesében, ami a DKD romlásához vezet. Ezenkívül az aktivált FoxO3a gátolhatja az oxidatív stressz szintjét a cukorbeteg patkányok veséjében, javíthatja a gyulladást, majd gátolhatja a DKD előfordulását. Ez azt jelzi, hogy az AGE-RAGE jelátviteli útvonal vagy a FoxO jelátviteli útvonal specifikus szabályozása nagy jelentőséggel bírhat a DKD megelőzésében és kezelésében.
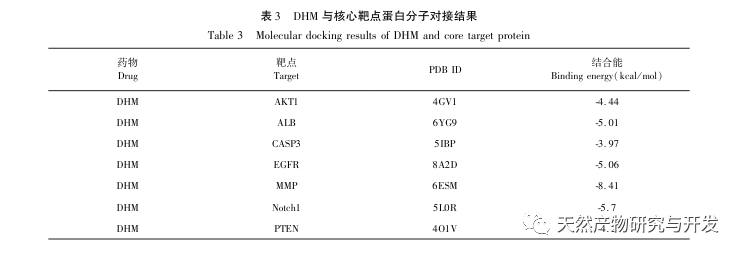
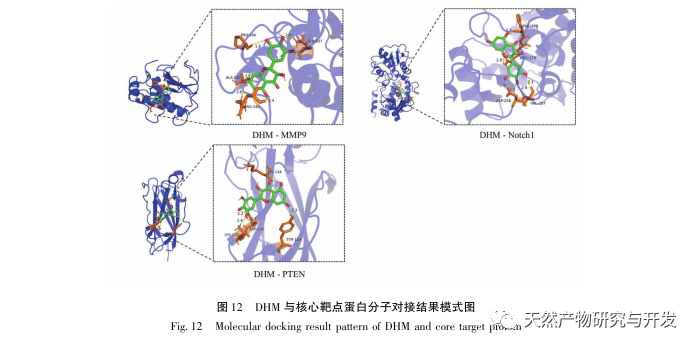
A molekuláris dokkolási eredmények azt mutatták, hogy a DHM jó kötődési affinitást mutatott a top 5 kiválasztott célponthoz, ami azt jelzi, hogy a DHM hatékonyságát a DKD kezelésében molekuláris szinten validálták. Ezenkívül észrevettük, hogy a kulcsfontosságú célgén AKT1, amely a szűrés során az első helyre került, a KEGG-útvonal gazdagodási elemzésén keresztül szorosan kapcsolódik az AGE-RAGE jelátviteli útvonalhoz és a FoxO jelátviteli útvonalhoz a DKD kialakulásában. Az AGE-RAGE jelátviteli útvonal a PI3K/Akt jelátviteli útvonallal szinergiába lépve oxidatív stresszt és krónikus gyulladást idézhet elő a vesében, ami vesebetegséghez vezet. A PI3K/Akt/FoxO3a útvonal aktiválása javíthatja a vese fiziológiai funkcióját cukorbetegségben. Ezért további kísérletet tettünk az AKT1 és a DHM előtti Notch-útvonal közötti kölcsönhatás vizsgálatára, és molekuláris dokkoló validálást végeztünk. A molekuláris dokkolási eredmények azt mutatták, hogy a DHM jó kötési affinitást mutatott a Notch1 és a PTEN között.
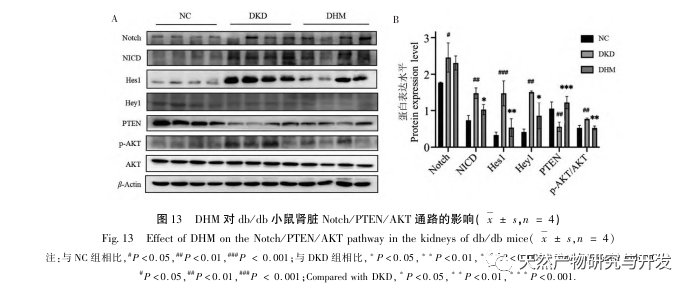
Korábbi tanulmányok kimutatták, hogy a Notch-útvonal túlműködik a DKD kialakulása során, ami a Notch1, NICD, Hes1 és Hey1 fokozott expressziójában nyilvánul meg. A Notch1 gátlói a Hes1 aktiválódásának csökkentésével aktiválhatják a PTEN-t, ezáltal javítva az autofágia rendellenességeit és lassítva az RF kialakulását. Ezenkívül más vizsgálatok azt találták, hogy a PTEN aktiválása a PI3K/Akt útvonal gátlásával a DKD progresszióját is enyhítheti. A fenti eredmények alapján feltételezzük, hogy a DHM javíthatja a DKD-t a Notch/PTEN/AKT útvonal szabályozásával. A Western blot eredmények a Notch útvonal aktiválódásának kóros növekedését, a PTEN expressziójának csökkenését és az AKT foszforiláció növekedését mutatták ki a db/db egerek veséiben. A DHM bevitele pedig gátolhatja a Notch-útvonal aktiválódását, aktiválhatja a PTEN-t és gátolhatja az AKT foszforilációját. Bár a Notch / PTEN / AKTT jeltengelyt mint teljes útvonalat ritkán vizsgálták a vesevédelemmel kapcsolatban a cukorbetegségben, kutatásunk bizonyos mértékig javította a vonatkozó kutatást, és több célponton keresztül gazdagította a DHM biológiai védelmének molekuláris mechanizmusát.
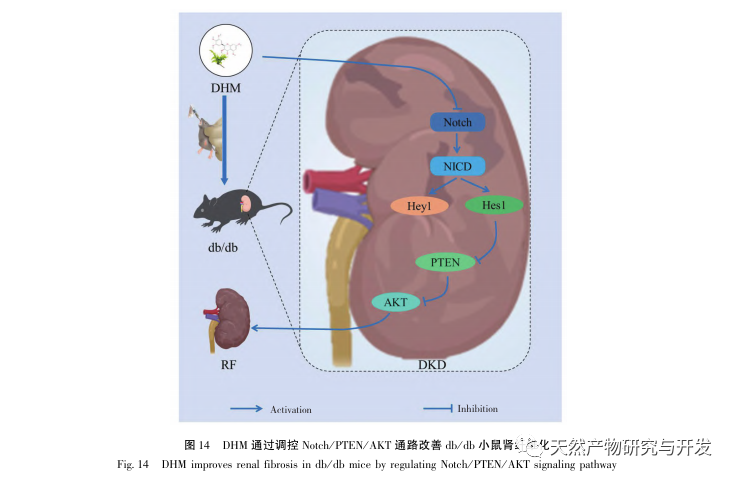
Összefoglalva, a DKD patológiai megnyilvánulásait javító DHM megfigyelése alapján ez a tanulmány kombinálta a hálózati farmakológiát és a molekuláris dokkolási technológiát, hogy előzetesen kimutassa, hogy a DHM szerepe a DKD progressziójának javításában olyan kulcsfontosságú célpontokon keresztül érhető el, mint az AKT1, ALB, CASP3, EGFR, MMP9, IGF1, PPARG, KDR, MMP2, ACE, és elemezte a vonatkozó útvonalakat; Végül a DHM potenciális AKT célpontjainak előzetes validálását és elemzését végeztük el állatkísérleteken keresztül, és megállapítottuk, hogy a DHM szerepet játszhat a DKD megelőzésében és kezelésében a Notch/PTEN/AKT útvonal szabályozásával (lásd a 14. ábrát). Jelenleg azonban viszonylag kevés kutatás foglalkozik a DHM szövődményeivel T2DM-ben, és terápiás potenciálja még további vizsgálatokat igényel.
