Udforskning af dihydromyricetins mekanisme til forbedring af nyrefibrose hos db/db-mus baseret på netværksfarmakologi og eksperimentel verifikation
Diabetesnefropati (DKD) er en af de største mikrovaskulære komplikationer ved type 2-diabetes mellitus (T2DM) og den vigtigste årsag til nyresygdom i slutstadiet. Dens vigtigste egenskaber er fortykkelse af den glomerulære kældermembran, udvidelse af mesenteriet og tubulointerstitiel matrix og tab af podocytter, hvilket fører til udvikling af mikroalbuminuri og nedsat nyrefunktion. Med den fortsatte udvikling af diabetisk nyresygdom (DKD) gennemgår nyrevævets mikrostruktur vedvarende inflammation og skade, hvilket fører til diffus interstitiel fibrose, der ødelægger den normale renale mikrostruktur og i sidste ende udvikler sig til renal fibrose (RF). I øjeblikket fokuserer midlerne til at afhjælpe udviklingen af DKD til RF primært på at forbedre DKD. Mekanismen bag de fleste diabeteskomplikationer, herunder DKD, er dog endnu ikke afklaret, så den komplekse mekanisme i processen, hvor DKD udvikler sig til RF, er ikke klar, hvilket fører til utilfredsstillende terapeutiske effekter af DKD og RF. Derfor haster det med at udforske DKD's patogenese og opdage nye terapeutiske mål for at hæmme dens udvikling.
Dihydromyricetin (DHM) er en naturlig flavonoidforbindelse med forskellige farmakologiske virkninger, herunder antiinflammatorisk, antioxidant, fjernelse af frie radikaler, forbedring af mitokondriel dysfunktion og regulering af autofagi. På nuværende tidspunkt har flere undersøgelser vist, at DHM har et stort potentiale i behandlingen af metaboliske sygdomme. Det kan ikke kun forbedre insulinresistensen og sænke blodsukkerniveauet ved at inducere autofagi, forbedre oxidativ stress, hæmme inflammation og øge mitokondrieaktiviteten, men også; Samtidig kan det forbedre mange komplikationer af diabetes, såsom diabetesencefalopati, diabeteskardiomyopati osv. Forskningen i DHM, der forbedrer komplikationerne af diabetes, er imidlertid ikke tilstrækkelig, og den relaterede farmakologiske mekanisme skal stadig udforskes yderligere. Derudover er der begrænset forskning i, om DHM yderligere kan forbedre RF forårsaget af DHM, og den terapeutiske effekt er stadig uklar.
Netværksfarmakologi kan konstruere et interaktionsnetværk for "lægemiddelkomponent-målsygdom" baseret på strukturen af komponenter i traditionel kinesisk medicin, deres biologiske virkninger og sygdomsrelaterede mål i forbindelse med et stort netværk af biologiske processer. Det er et effektivt middel til at udforske de effektive komponenter, molekylære mekanismer og potentielle mål for traditionel kinesisk medicin. Molekylær docking kan simulere interaktionen mellem molekyler og proteiner, forudsige konformationen af ligander og receptorer, beregne og forudsige affinitet og bindingstilstande for at verificere den specifikke virkemåde af lægemiddelkomponenter på vigtige mål. Derfor brugte denne undersøgelse netværksfarmakologi til at screene og forudsige potentielle mål for DHM på DKD og RF, konstruerede et interaktionsnetværk for "komponent-målsygdom" og validerede de forudsagte hovedmål gennem molekylær docking og in vivo-eksperimenter. Den molekylære mekanisme for dihydromyricetin, der forbedrer nyrefibrose hos db/db-mus, blev udforsket, hvilket gav et teoretisk grundlag for den kliniske anvendelse af DHM.



På nuværende tidspunkt afhænger den almindelige behandling af diabetes hovedsageligt af kontrollen med blodsukkeret, mens DKD, en af de alvorligste komplikationer ved diabetes, ikke har nogen effektiv behandlingsstrategi. Derfor er det meget vigtigt at have en dyb forståelse af patogenesen af DKD og at finde effektive behandlingsstrategier for at undertrykke tendensen til, at DKD udvikler sig til nyrefibrose. Naturmedicin har vist sig at have unikke fordele i form af færre bivirkninger og multi-target-effektivitet, hvilket har gjort dem til en vigtig kilde til udvikling af nye lægemidler til kroniske sygdomme i de senere år. Yderligere forskning i DHM har afsløret et betydeligt terapeutisk potentiale i forbedringen af metaboliske sygdomme. Baseret på forbedringen af nyrefibrose hos db/db-mus med DHM kombinerer denne undersøgelse derfor netværksfarmakologi og molekylær docking-teknologi for at udforske de potentielle terapeutiske mål og molekylære mekanismer for DHM til forbedring af nyrefibrose hos db/db-mus og verificerer dem gennem dyreforsøg.
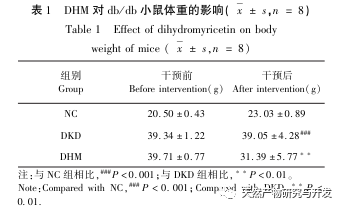
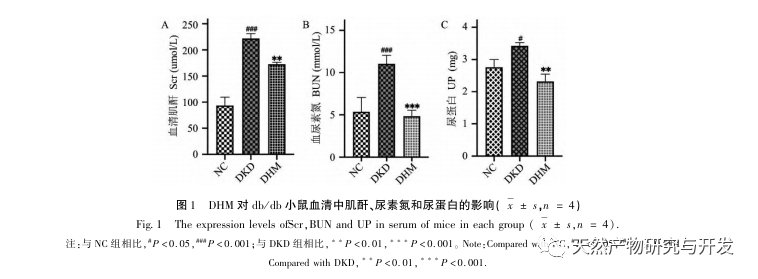
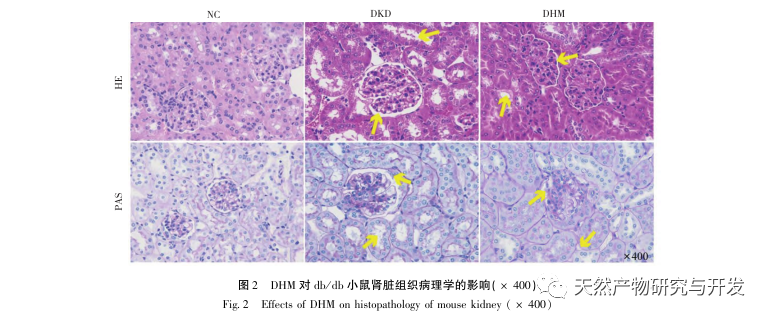
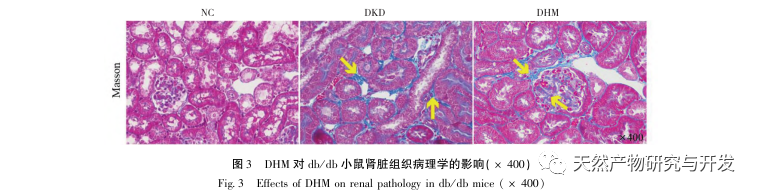
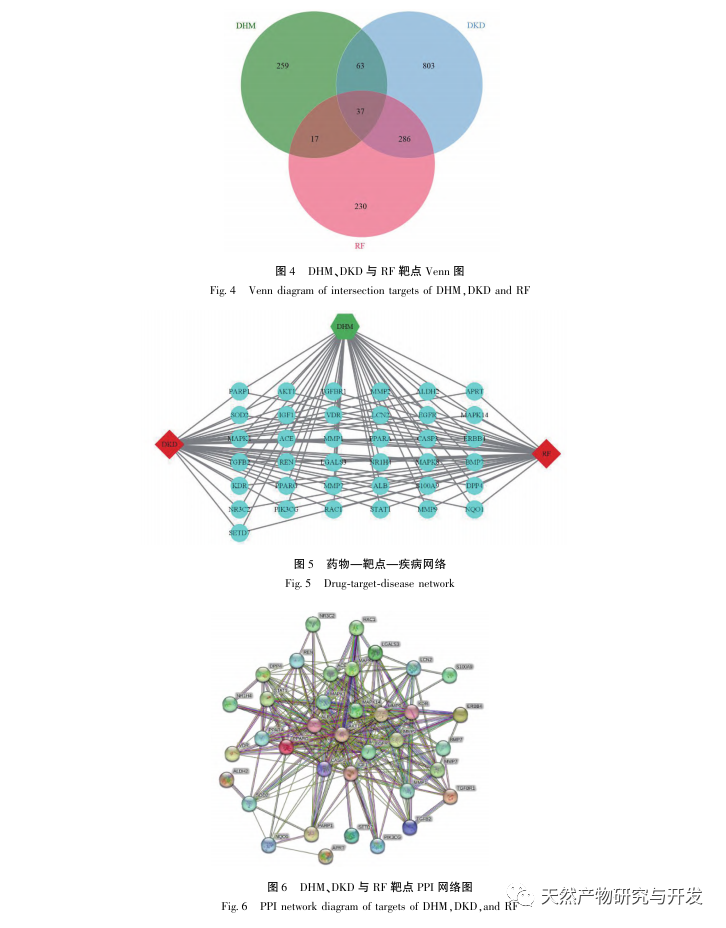
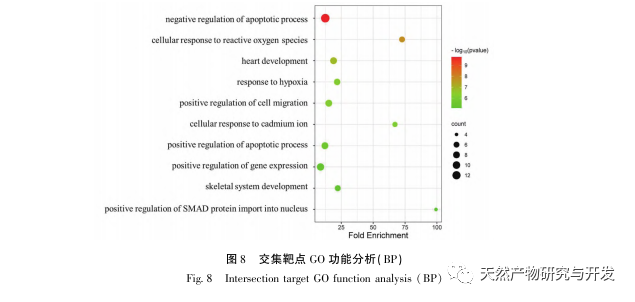
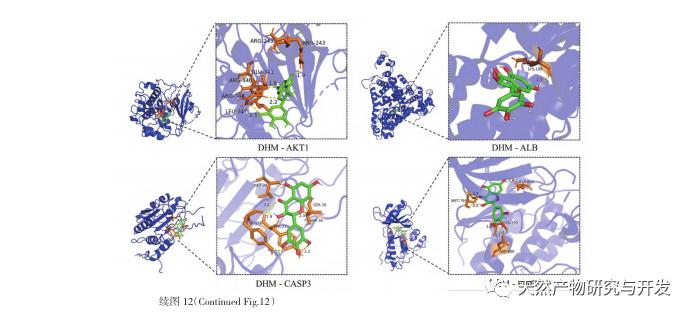
For det første observerede vi, at 10 ugers DHM-intervention effektivt kan lindre blodsukker, kropsvægt, kreatinin, urinstofnitrogen, urinprotein og nyrepatologiske manifestationer i db/db-mus, hvilket indikerer, at DHM kan lindre nyrefunktionsskader og bremse udviklingen af DKD i db/db-mus. Efter at have analyseret og screenet 37 krydsende mål for DHM, DKD og RF blev det konstateret, at 10 mål, herunder AKT1, ALB, CASP3, EGFR, MMP9, IGF1, PPARG, KDR, MMP2, ACE, kan være vigtige mål for DHM til at forbedre DKD. Det er blevet bekræftet, at AKT1, CASP3, EGFR, MMP9, IGF1, MMP2 og ACE aktiveres i miljøet omkring diabetes, og specifik hæmning kan forbedre den beskadigede tilstand af DKD og bremse udviklingstendensen af fibrose. PPARG og KDR hæmmes i det fysiologiske miljø ved diabetes og spiller en rolle i nyrebeskyttelsen efter aktivering. ALB er en vigtig biokemisk indikator for at observere graden af nyreskade under udviklingen af diabetes. Det stiger normalt med forekomsten af DKD og falder efter forbedring af DKD. Det betyder, at de 10 nøglegener, vi har screenet, ikke kun kan tjene som potentielle biomarkører for DKD, men også som vigtige mål for yderligere udforskning af patogenesen og behandlingen af DKD.
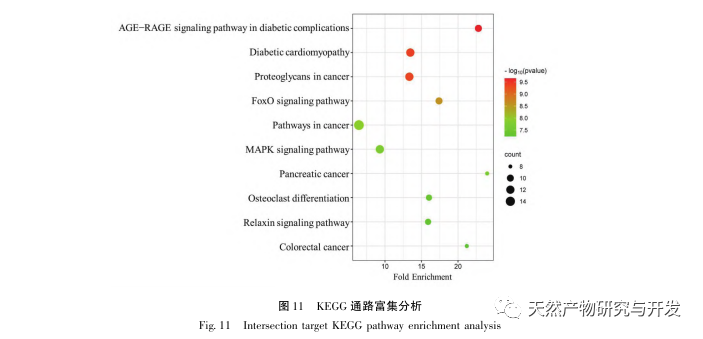
KEGG pathway enrichment analysis viste, at forbedringen af DHM på DKD kan involvere AGE-RAGE-signalvej, diabetes kardiomyopati og FoxO-signalvej. AGE-RAGE-signalvejen og FoxO-signalvejen spiller vigtige regulerende roller i udviklingen af DKD. Forskning har vist, at AGE'er specifikt aktiveres i endotelceller, nyretubuli, mesangiale celler og podocytter hos DKD-patienter, og deres interaktion med RAGE forbedres, hvilket yderligere forværrer oxidativ stress og inflammation i nyrerne, hvilket fører til forringelse af DKD. Desuden kan aktiveret FoxO3a hæmme niveauet af oxidativ stress i nyrerne hos diabetesrotter, forbedre inflammation og derefter hæmme forekomsten af DKD. Det indikerer, at specifik regulering af AGE-RAGE-signalvejen eller FoxO-signalvejen kan være af stor betydning for forebyggelse og behandling af DKD.
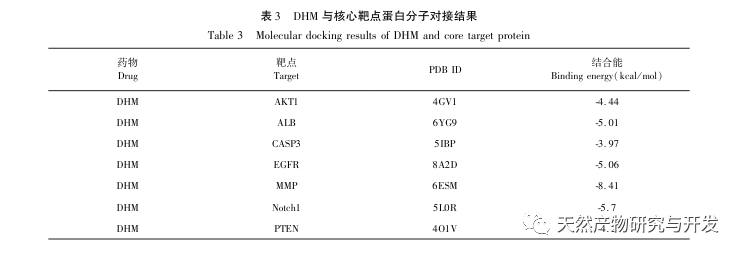
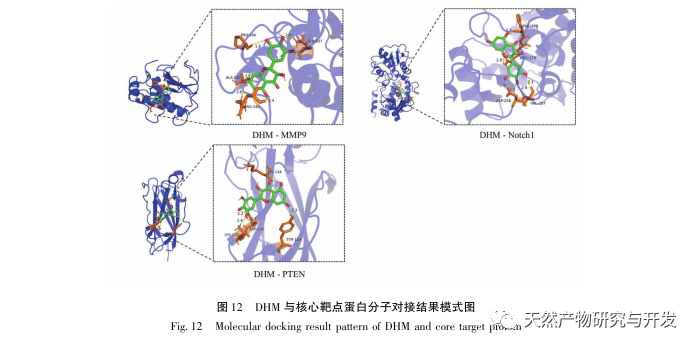
De molekylære dockingresultater viste, at DHM udviste god bindingsaffinitet med de top 5 udvalgte mål, hvilket indikerer, at DHM's effektivitet i behandlingen af DKD er blevet valideret på molekylært niveau. Derudover bemærkede vi, at det vigtigste målgen AKT1, som rangerede først i screeningen, var tæt forbundet med AGE-RAGE-signalvejen og FoxO-signalvejen i udviklingen af DKD gennem berigelsesanalyse af KEGG-vejen. AGE-RAGE-signalvejen kan i synergi med PI3K/Akt-signalvejen fremkalde oxidativ stress og kronisk inflammation i nyrerne, hvilket fører til nyresygdom. Aktivering af PI3K/Akt/FoxO3a-signalvejen kan forbedre nyrernes fysiologiske funktion ved diabetes. Derfor forsøgte vi yderligere at undersøge interaktionen mellem Notch-vejen opstrøms for AKT1 og DHM og gennemførte molekylær docking-validering. De molekylære dockingresultater viste, at DHM udviste god bindingsaffinitet med Notch1 og PTEN.
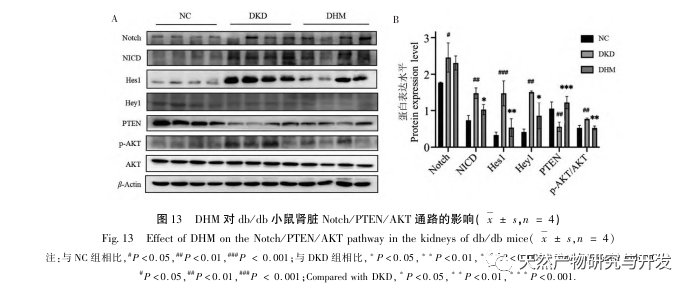
Tidligere undersøgelser har vist, at Notch-vejen er overaktiveret under udviklingen af DKD, hvilket viser sig ved øget udtryk af Notch1, NICD, Hes1 og Hey1. Hæmmere af Notch1 kan aktivere PTEN ved at reducere aktiveringen af Hes1 og derved forbedre autofagi-forstyrrelser og bremse forekomsten af RF. Derudover har andre undersøgelser vist, at PTEN-aktivering også kan lindre udviklingen af DKD ved at hæmme PI3K/Akt-vejen. Baseret på ovenstående resultater spekulerer vi i, at DHM kan forbedre DKD ved at regulere Notch/PTEN/AKT-vejen. Western blot-resultater viste en unormal stigning i aktiveringen af Notch-stien, et fald i PTEN-ekspression og en stigning i AKT-phosphorylering i nyrerne hos db/db-mus. Og DHM-indtag kan hæmme aktiveringen af Notch-vejen, aktivere PTEN og hæmme fosforyleringen af AKT. Selvom Notch/PTEN/AKT-signalaksen som en hel vej sjældent er blevet undersøgt i forbindelse med nyrebeskyttelse ved diabetes, har vores forskning til en vis grad forbedret relevant forskning og beriget den molekylære mekanisme for DHM's biologiske beskyttelse gennem flere mål.
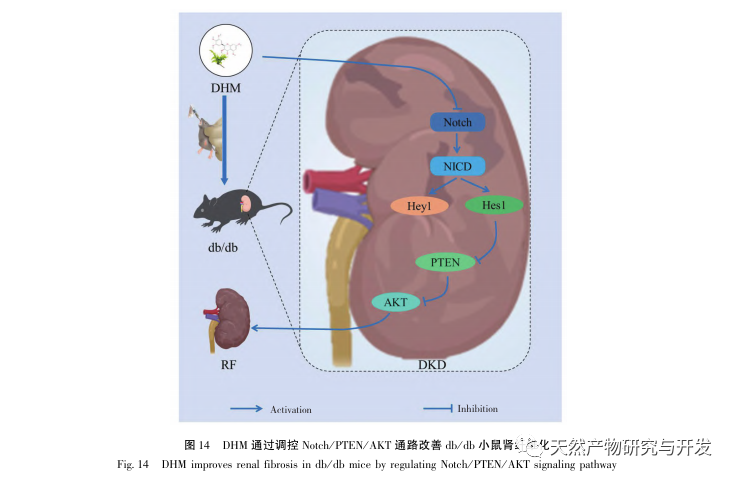
Sammenfattende, baseret på observationen af DHM, der forbedrer de patologiske manifestationer af DKD, kombinerede denne undersøgelse netværksfarmakologi og molekylær dockingteknologi for foreløbigt at demonstrere, at DHM's rolle i forbedring af udviklingen af DKD kan opnås gennem nøglemål som AKT1, ALB, CASP3, EGFR, MMP9, IGF1, PPARG, KDR, MMP2, ACE og analyserede de relevante veje; Endelig blev der foretaget en foreløbig validering og analyse af de potentielle AKT-mål for DHM gennem dyreforsøg, og det blev konstateret, at DHM kan spille en rolle i forebyggelse og behandling af DKD ved at regulere Notch/PTEN/AKT-vejen (se figur 14). Der er dog i øjeblikket relativt lidt forskning i komplikationerne ved DHM i T2DM, og dets terapeutiske potentiale skal stadig undersøges nærmere.
