Исследование животной модели диабетической болезни почек с синдромом дефицита ци-инь на основе кишечной микрофлоры
В настоящее время большинство ученых считают, что дефицит ци и инь при диабете с болезнью почек (ДБП) является основной этиологией и патогенезом ДБП, а его патологические изменения развиваются из дефицита инь, сухости и жара жажды, из которых дефицит ци и инь является наиболее фундаментальным состоянием, проходящим через все течение ДБП. В данной статье синдром дефицита ци и инь рассматривается как основной патогенез ДКД. На основе создания модельной группы крыс с диабетической болезнью почек с высокожировой диетой и низкодозовым введением стрептозотоцина (STZ) мы используем метод внутрижелудочного введения Цинпи, Чжиши и Фузи (Цинпи и Чжиши обладают функцией успокоения печени и разрушения ци, а также могут рассеивать положительную ци при использовании; Fuzi входит в канал почек и может расходовать почечную инь при использовании с высокой температурой) для изучения создания животной модели сочетания ци и инь синдрома DN и исследования показателей.
Клинические исследования показали, что дефицит Ци Инь может привести к снижению иммунитета у пациентов с ДН. Изменения в концентрации иммуноглобулина G (IgG) и иммуноглобулина M (IgM) человека могут отражать иммунный статус крыс. CAMP и cGMP связаны с функцией нейроэндокринной системы организма. Некоторые ученые исследовали, что когда пациенты испытывают дисбаланс инь-ян и потерю иньской жидкости в состоянии дефицита инь и внутреннего жара, циклический аденозинмонофосфат (цАМФ), циклический гуанозинмонофосфат (цГМФ) и соотношение цАМФ/цГМФ будут ненормальными. Дефицит ци также связан с энергетическим метаболизмом пациентов. Фермент натрий-калиевого насоса (Na+/K+- АТФ) и фермент кальций-магниевого насоса (Ca2+/Mg2+- АТФ) - это ферменты, связанные с энергетическим обменом, которые могут расщеплять аденозинтрифосфат (АТФ) на аденозиндифосфат (АДФ) и высвобождать энергию. Белок мочи является важным тестовым показателем, позволяющим судить о состоянии здоровья пациентов при обследовании диабетической нефропатии. С помощью белка мочи можно выявить различия между диабетической нефропатией и дать научные рекомендации по ее диагностике и лечению.
Исследования показали, что нарушение микробиоты кишечника связано с возникновением ДКД, а микробиота кишечника может регулировать функцию почек в мышиных моделях ДКД. У пациентов с ДКД снижается скорость гломерулярной фильтрации, а в толстой кишке накапливается большое количество отходов метаболизма, таких как мочевая кислота и оксалат. Изменения в кишечной среде приводят к дисбиозу микробиоты кишечника. Исследования показали, что количество полезных бактерий в кишечнике пациентов с ДКД уменьшается, а количество патогенных бактерий увеличивается, что приводит к значительному увеличению количества факторов воспаления в циркуляции организма и усугубляет воспалительное поражение почек. В настоящее время модель ДКД западной медицины в основном используется в исследованиях ДКД традиционной китайской медицины, и исследования диабета и заболеваний почек в этой области в определенной степени ограничены. Поэтому вопрос о том, как создать животные модели, сочетающие болезнь и синдром, стал актуальным в исследованиях животных моделей в традиционной китайской медицине.




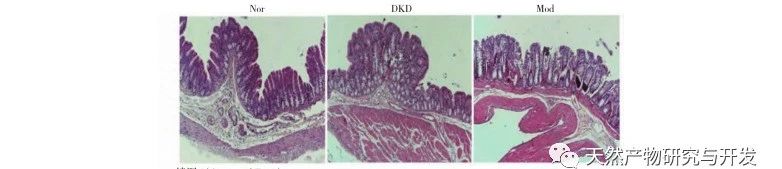
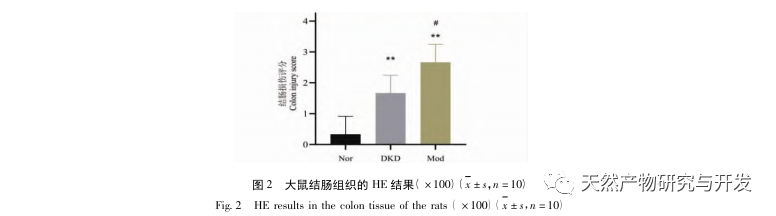
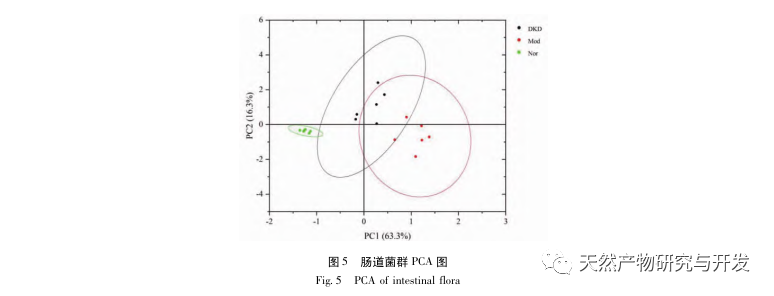
В процессе непрерывного развития диабета возникают различные осложнения, наиболее распространенным из которых является развитие ДКД. Результаты эксперимента показали, что уровень белка в моче у крыс DKD был значительно выше, чем у крыс Nor, а патологическое повреждение почек и толстой кишки у крыс DKD значительно отличалось от такового у крыс Nor. Таким образом, модель DKD была в основном успешно создана.
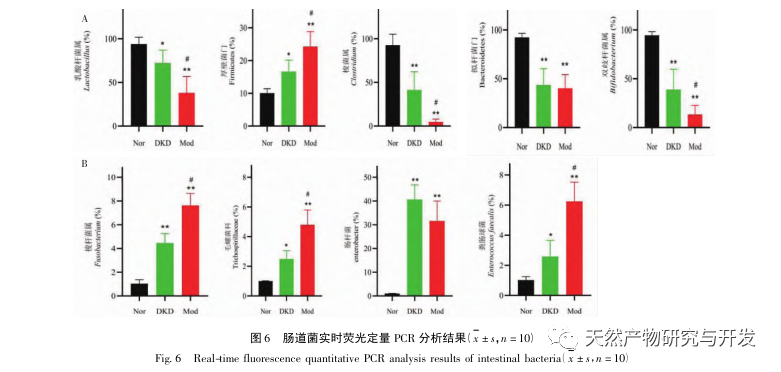
Взаимосвязь между микробиотой кишечника и дефицитом ци-инь при ДКД стала одной из актуальных тем в последние годы. Считается, что кишечник и почки играют решающую роль в иммунных и воспалительных реакциях, а также в состоянии слизистого барьера кишечника. Если состав и функции микробиоты кишечника изменяются, это может привести к повреждению слизистой оболочки кишечника, переносу токсинов из организма в кровоток, вызвать или усугубить иммунные воспалительные реакции и ускорить прогрессирование СД. Было изучено 160 случаев диабетической нефропатии с дефицитом ци и инь. Клиническое исследование показало, что содержание Bacteroides, Bifidobacterium и Lactobacillus у пациентов с ДКД было значительно ниже, чем в контрольной группе, а Enterobacteriaceae, Enterococcus, Yeast и Fusobacterium - выше, чем в контрольной группе. Результаты эксперимента показали, что содержание полезных бактерий, таких как Bacteroidetes, Lactobacillus, Bifidobacterium и Clostridium, у пациентов с ДКД и Mod снизилось, а содержание патогенных бактерий, таких как Clostridium, Molluscaceae, Escherichia coli и Enterococcus, увеличилось. Полученные результаты согласуются с результатами предыдущих исследований. В то же время было обнаружено, что в отличие от ДКД при Мод значительно увеличилось содержание Firmicutes, Clostridium, Molluscum и Enterococcus, в то время как содержание Lactobacillus, Clostridium и Bifidobacterium значительно снизилось, что позволяет предположить, что эти бактериальные роды могут быть тесно связаны с синдромом дефицита Ци Инь.
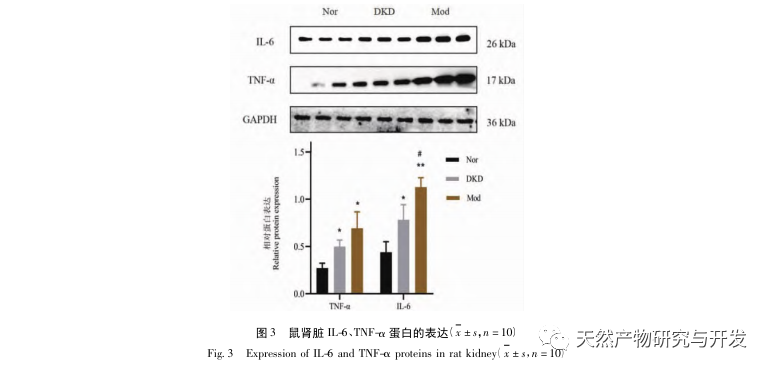
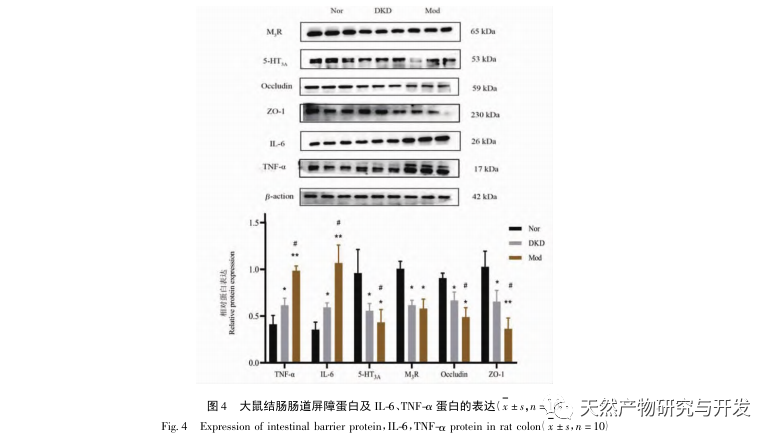
Нарушение микробиоты кишечника может приводить к увеличению синтеза эндотоксинов в кишечнике, обострению воспалительных реакций, нарушению кишечного барьера и переносу вредных веществ, тем самым усугубляя воспаление почек и ускоряя прогрессирование диабетической болезни почек (ДБП). Результаты эксперимента показали, что экспрессия белков IL-6 и TNF - α в почках и толстой кишке была значительно повышена, что также подтверждает этот вывод. Белки Occludin и ZO-1 связаны с состоянием плотного соединения кишечной ткани. M3R также может защищать гомеостаз слизистой оболочки кишечника, индуцируя кишечные цитокины, а 5-HT3A может защищать иммунную систему кишечника через экспрессию клеток иммунной системы. По сравнению с нормой, экспрессия белков M3R, 5-HT3A, Occludin и ZO-1 в тканях толстой кишки Mod была значительно снижена, что указывает на нарушение гомеостаза кишечного барьера. Это может быть вызвано изменениями в содержании полезных и патогенных бактерий, что в конечном итоге приводит к развитию синдрома дефицита ци-инь при ДКД.
Дефицит ци вызван недостатком жизненной энергии организма. Ци выполняет функции продвижения, консолидации, транспортировки и согревания. Дефицит ци может привести к снижению функции внутренних органов. Клинические исследования показывают, что содержание микроальбумина и иммуноглобулина G в моче у пациентов с диабетической нефропатией значительно ниже, чем у здоровых людей. Результаты эксперимента показали, что концентрация белков IgG и IgM у крыс Mod значительно снижена, что свидетельствует о снижении иммунитета организма крыс Mod; При исследовании 172 пациентов с ДН было установлено, что уровень цАМФ положительно коррелировал со степенью поражения почек у пациентов с диабетической нефропатией. В эксперименте, по сравнению с Nor, у Mod наблюдалось значительное увеличение содержания цАМФ и соотношения цАМФ/цГМФ. Соотношение cAMP/cGMP было аномально высоким или низким. Когда содержание цАМФ увеличивалось, активировалось большое количество тирозингидроксилазы, которая вырабатывала большое количество дофамина, воздействующего на нервную систему, влияющего на эмоции человека и приводящего к повышению возбуждения. Поэтому синдром виртуальной жары часто приводит к возбуждению; Исследование также показало, что активность Na+/K+- АТФазы и Ca2+- Mg2+- АТФазы у больных диабетической нефропатией была значительно нарушена, что привело к повреждению структуры и функции клеток, блоку микроциркуляции, усугублению гипоксии-ишемии почек, повышению проницаемости сосудов и увеличению утечки белка с мочой, что привело к дальнейшему развитию заболевания почек. Результаты эксперимента также показали, что активность Na+/K+- АТФазы и Ca2+- Mg2+- АТФазы в почках Mod была значительно ниже, чем в почках Nor и DKD. Хроническое заболевание почек, в связи с длительным течением болезни, привело к истощению жизненной энергии, а повреждение иньской жидкости сформировало синдром дефицита как ци, так и инь, поэтому диабетическое заболевание почек с дефицитом как ци, так и инь приведет к нарушению энергетического обмена организма. Возникают расстройства.
Подводя итог, можно сказать, что при кормлении крыс высоким содержанием глюкозы и жира в течение 4 недель и внутрибрюшинном введении стрептозотоцина, аконита, зеленой кожуры и fructus aurantii в течение 8 недель, можно частично сформировать основные синдромальные характеристики диабетической болезни почек с дефицитом ци и инь. Разница между символической кишечной флорой крыс и измеренными показателями может в определенной степени отражать основные характеристики модели сочетания синдромов заболевания и использоваться для оценки характеристик модели диабетической болезни почек с дефицитом ци и инь.
