A glikolízis részvételének vizsgálata a krónikus myeloid leukémiás sejtek proliferációjának ceramid általi gátlásának szabályozásában
A krónikus myelogén leukémia (CML) a csontvelősejtek klonális proliferatív leukémiája, amely a felnőttkori leukémiás esetek körülbelül 15%-jét teszi ki. Éves előfordulási aránya 2/100000, magas az 50~55 évesek körében. A krónikus myeloid leukémia a BCR-ABL1 fúziós fehérje Philadelphia kromoszóma transzlokáción keresztül történő kialakulásával járó daganat. Jelenleg főként tirozinkináz-gátló (TKI) célzott gyógyszereket használnak a kezelésre, amelyek jelentősen javíthatják a CML betegek prognózisát. Továbbra is fennáll azonban a TKI-rezisztencia visszatérő problémája, amelyet a BCR-ABL1 onkogén tirozinkináz génjének instabilitása okoz. A hagyományos kínai gyógyászat terápiás hatással van a CML-re, például fokozza a kemoterápia hatékonyságát és javítja a szervezet immunfunkcióját. A hagyományos kínai orvoslásban található CML-ellenes vezető vegyületek felfedezése és hatásmechanizmusuk elemzése új ötleteket és kísérleti alapokat nyújthat a CML kezeléséhez.
A rokaglamid (RocA), amely a Spartina alterniflora hagyományos kínai gyógynövény ágaiból és leveleiből származik, egy ciklopentán benzofurán vázat tartalmazó természetes termék. Olyan funkciókkal rendelkezik, mint a légzőszervi betegségek, például a köhögés és az asztma megelőzése és kezelése, gyulladásos bőrbetegségek, gyulladáscsökkentő hatások, a gyógyszerkárosodás csökkentése, neuroprotektív és daganatellenes hatások. Korábbi tanulmányok megállapították, hogy a ceramid nanomoláris koncentrációban gátolja a tumorsejtek növekedését és szaporodását. A tumorellenes mechanizmusa elsősorban a tumorsejtek eIF4E és eIF4A transzlációs iniciációs faktorainak gátlásában, a sejtciklus blokkolásában az ATM/ATR-Chk1/CHK2 ellenőrzőpont útvonal aktiválásával, valamint a tumorsejtek aktiválásában áll, anélkül, hogy befolyásolná a normál sejtek MAPK p38 és JNK útvonalát. A legújabb vizsgálatok szerint a szulfonamid javíthatja a kemoterápia hatékonyságát és fokozhatja a leukémiás sejtek érzékenységét. Több tanulmány is kimutatta, hogy a szulfonamid nagy potenciállal rendelkezik, mint kis molekulájú vegyületjelölt a daganatellenes gyógyszerek fejlesztéséhez.
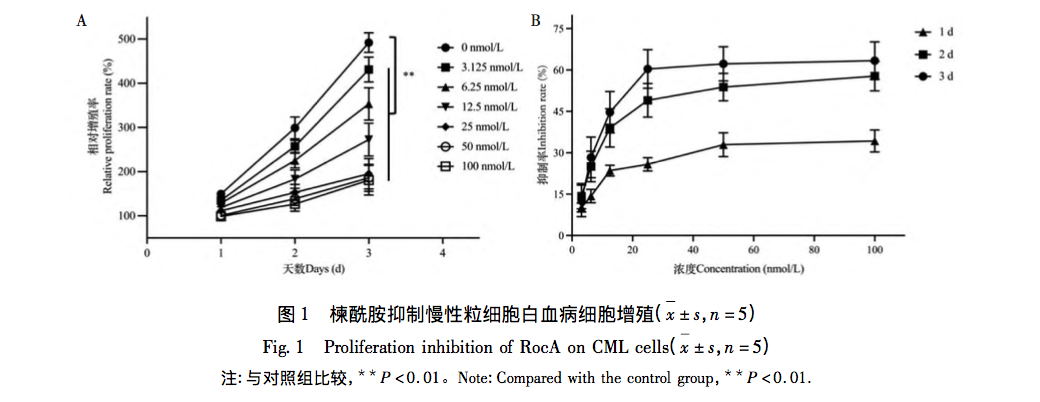




 Egyes tumorsejtek metabolikus változásokon mennek keresztül, hogy kielégítsék a túléléshez és a gyors proliferációhoz szükséges energia- és bioszintetikus szükségleteiket, és az aerob glikolízis megnövekedett szintje (azaz a Wolberg-effektus) a tumorsejtek egyik metabolikus markere. Az aerob glikolízis a leukémia szelektív beavatkozásának fontos célpontjává vált. Nem világos, hogy a szulfonamid gátolja-e a CML proliferációját a CML glikolízisének szabályozásával. Ez a tanulmány a K562-es CML-sejtvonalat használja sejtmodellként a ceramid CML-sejtek proliferációjára és glikolízisére gyakorolt hatásának vizsgálatára, és feltárja az aerob glikolízis szabályozó szerepét a CML-sejtek proliferációjának ceramid általi gátlásában.
Egyes tumorsejtek metabolikus változásokon mennek keresztül, hogy kielégítsék a túléléshez és a gyors proliferációhoz szükséges energia- és bioszintetikus szükségleteiket, és az aerob glikolízis megnövekedett szintje (azaz a Wolberg-effektus) a tumorsejtek egyik metabolikus markere. Az aerob glikolízis a leukémia szelektív beavatkozásának fontos célpontjává vált. Nem világos, hogy a szulfonamid gátolja-e a CML proliferációját a CML glikolízisének szabályozásával. Ez a tanulmány a K562-es CML-sejtvonalat használja sejtmodellként a ceramid CML-sejtek proliferációjára és glikolízisére gyakorolt hatásának vizsgálatára, és feltárja az aerob glikolízis szabályozó szerepét a CML-sejtek proliferációjának ceramid általi gátlásában.
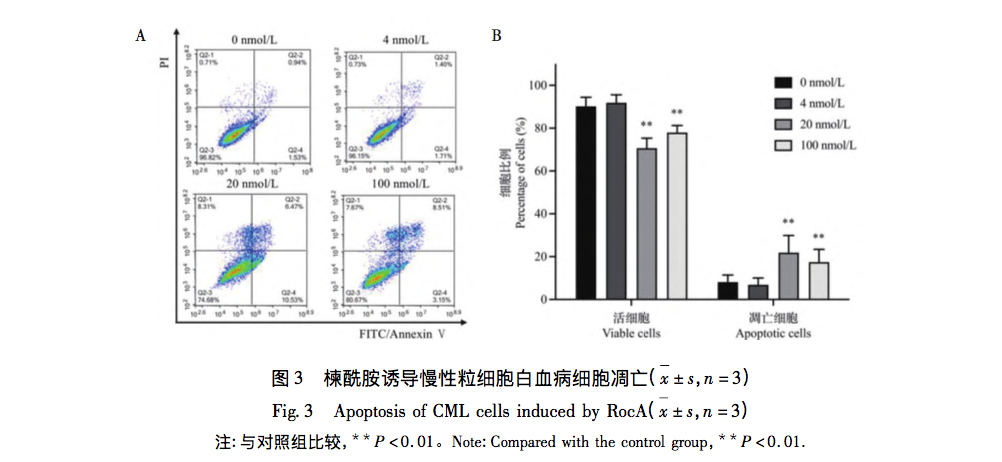
A melitamid a rizs orchideából kivont hatóanyag, amely daganatellenes hatással rendelkezik. Ez a cikk azt vizsgálja, hogy a szulfonamid gátolja-e a K562 sejtek proliferációját az aerob glikolízisen keresztül. Az MTT-vizsgálat eredményei azt mutatták, hogy a K562 sejtek növekedését és proliferációját a Melitamid idő- és koncentrációfüggő módon jelentősen gátolta, és a K562 sejtek proliferációjának gátlására szolgáló IC50 értéke elérte a nanomoláris szintet. Az áramlási citometriás technológia alkalmazása kimutatta, hogy az azepam gátolja a K562 sejtek proliferációját és apoptózist indukál, blokkolva a sejtciklus G2/M fázisát.
A tumorsejtek aerob körülmények között is magas glükózfelvételt, glikolízist és laktátszintet mutatnak, ami a Warburg-effektus néven ismert. A c-Myc transzkripciós faktor széles körben részt vesz az olyan sejtfunkciók szabályozásában, mint a sejtproliferáció, a sejtek túlélése, a szöveti remodelling és az angiogenezis, valamint a tumorsejtek metabolikus átprogramozását is elindítja. A c-Myc felszabályozza a glükóz transzportereket és szinte az összes glikolitikus enzimet, ezáltal elősegíti a tumorsejtek glükóz-anyagcseréjét. A 13C-jelölt glükóz kimutatta, hogy a c-Myc elősegíti a glükózfogyasztást Burkitt-limfómában és c-Myc által vezérelt májrákban. A kutatások megállapították, hogy a c-Myc elősegíti a laktát kiválasztását, amely nemcsak a glikolízisben részt vevő anyagcsere-anyag, hanem részt vesz az angiogenezis, az immunmenekülés, a sejtmigráció, a metabolikus igénybevétel és más rákkeltő hatások elősegítésében is. A K562 sejtek glükóz-éheztetéses kezelésével megállapítottuk, hogy a glükóz eltávolítása csökkentette a laktáttermelés szintjét és a c-Myc fehérje expressziós szintjét, és nem volt kedvező a K562 sejtek proliferációjára. Ez megerősíti, hogy a K562 sejtek növekedése és proliferációja a glükózellátástól függ, ami tükrözi a K562 sejtek c-Myc szintje és glükózszintje közötti összefüggést. Éhezési körülmények között azt találtuk, hogy a formamid relatív gátlási aránya a K562 sejteken a glükóz eltávolítása után alacsonyabb volt, mint a glükóz hozzáadásával kezelt csoportban. Ezért feltételezhető, hogy a formamid K562-sejtek növekedésének gátlása részben glükózfüggő, ami azt jelenti, hogy a formamid glükózellátás nélkül nem képes további növekedési gátlást előidézni a K562-sejtekben. A melitamid a K562 sejtek felülúszójában a glükózfogyasztás és a laktáttermelés szintjét is jelentősen csökkentette, ami arra utal, hogy a melitamid gátolta az aerob glikolízist a K562 sejtekben.
A hexokináz 2 (HK2) a tumorsejtek glikolízisének specifikus kulcsenzime, amely a külső mitokondriális membránhoz kötődve képes fenntartani a tumorsejtek nagy sebességű aerob glikolízisét, és energiát szolgáltat a tumorsejtek gyors proliferációjához. A kutatók egérmodellek segítségével igazolták, hogy a HK2 fontos szerepet játszik az emlőrák, a tüdőrák és más daganatok kialakulásában és fejlődésében; A hexokináz 1 (HK1) széles körben kifejeződik a felnőtt szövetekben, és a hexokináz háztartási altípusának tekinthető; A foszfofruktokináz P (PFKP) döntő szerepet játszik a rák kialakulásában és áttétképződésében. Egyes tanulmányok kimutatták, hogy a PFKP potenciálisan diagnosztikai marker vagy gyógyszercélpont lehet az emlőrák és a tüdőrák esetében; a piruvát-kináz 2 (PKM2) minden olyan sejtben expresszálódik, ahol magas a nukleinsavszintézis sebessége, például a normál proliferáló sejtekben, az embrionális sejtekben és különösen a tumorsejtekben; a laktát-dehidrogenáz A (LDHA) katalizálja a piruvát és az L-tejsav kölcsönös átalakulását. Számos humán tumorsejt LDHA-szintje magasabb, mint a normál sejteké. Az LDHA gátlása csökkentheti a daganatos sejtek, például a fej- és nyaki rák, a hasnyálmirigyrák, a méhnyakrák és a prosztatarák proliferációját. Elemeztük a ceramid hatását a HK2, HK1, PFKP, PKM2, LDHA és az onkogén transzkripciós faktor c-Myc fehérje expressziós szintjére K562 sejtekben, és azt találtuk, hogy a ceramid alig szabályozta a HK1, PFKP, PKM2 és LDHA fehérje expressziós szintjét, de jelentősen lefelé szabályozta a c-Myc és HK2 fehérje expressziós szintjét. Feltételezzük, hogy a melinamid a c-Myc és a HK2 downregulálásával és az aerob glikolízis útvonalainak gátlásával fejti ki K562 sejtek elleni hatását. A c-Myc és a HK2 közötti szabályozási kapcsolat további feltárást igényel.
