Studie über die Beteiligung der Glykolyse an der Regulierung der Hemmung der Proliferation chronischer myeloischer Leukämiezellen durch Ceramid
Die chronische myeloische Leukämie (CML) ist eine klonale proliferative Leukämie der Knochenmarkzellen, die etwa 15% der Leukämiefälle bei Erwachsenen ausmacht. Die jährliche Inzidenzrate liegt bei 2/100000 und ist bei Menschen im Alter von 50 bis 55 Jahren besonders hoch. Die chronische myeloische Leukämie ist ein Tumor, der mit der Bildung des Fusionsproteins BCR-ABL1 durch die Philadelphia-Chromosom-Translokation einhergeht. Gegenwärtig werden zur Behandlung hauptsächlich zielgerichtete Tyrosinkinase-Inhibitoren (TKI) eingesetzt, die die Prognose von CML-Patienten erheblich verbessern können. Allerdings gibt es immer noch das Problem der TKI-Resistenz, die durch die Instabilität des Tyrosinkinase-Gens des BCR-ABL1-Onkogens verursacht wird. Die traditionelle chinesische Medizin hat eine therapeutische Wirkung auf CML, indem sie beispielsweise die Wirksamkeit der Chemotherapie erhöht und die Immunfunktion des Körpers verbessert. Die Entdeckung von Leitstrukturen gegen CML in der traditionellen chinesischen Medizin und die Analyse ihrer Wirkmechanismen können neue Ideen und experimentelle Grundlagen für die Behandlung von CML liefern.
Rocaglamid (RocA), das aus den Zweigen und Blättern der traditionellen chinesischen Heilpflanze Spartina alterniflora gewonnen wird, ist ein Naturprodukt, das ein Cyclopentan-Benzofuran-Gerüst enthält. Es hat Funktionen wie die Vorbeugung und Behandlung von Atemwegserkrankungen wie Husten und Asthma, entzündliche Hauterkrankungen, entzündungshemmende Wirkungen, Verringerung von Arzneimittelschäden, Neuroprotektion und Antitumorwirkung. Frühere Studien haben ergeben, dass Ceramid das Wachstum und die Vermehrung von Tumorzellen in nanomolaren Konzentrationen hemmt. Sein Anti-Tumor-Mechanismus umfasst hauptsächlich die Hemmung der Translationsinitiationsfaktoren eIF4E und eIF4A von Tumorzellen, die Blockierung des Zellzyklus durch Aktivierung des ATM/ATR-Chk1/CHK2-Kontrollpunkts und die Aktivierung von Tumorzellen, ohne die MAPK p38- und JNK-Signalwege normaler Zellen zu beeinflussen. Jüngste Studien haben ergeben, dass Sulfonamid die Wirksamkeit der Chemotherapie verbessern und die Empfindlichkeit von Leukämiezellen erhöhen kann. Mehrere Studien haben gezeigt, dass Sulfonamid ein großes Potenzial als potenzieller niedermolekularer Wirkstoff für die Entwicklung von Anti-Tumor-Medikamenten hat.




 Einige Tumorzellen machen metabolische Veränderungen durch, um ihren Energie- und Biosynthesebedarf für das Überleben und die schnelle Vermehrung zu decken, und die erhöhten Werte der aeroben Glykolyse (d.h. der Wolberg-Effekt) sind einer der metabolischen Marker für Tumorzellen. Die aerobe Glykolyse ist zu einem wichtigen Ziel für selektive Interventionen bei Leukämie geworden. Es ist nicht klar, ob Sulfonamid die CML-Proliferation durch Regulierung der CML-Glykolyse hemmt. In dieser Arbeit wird die CML-Zelllinie K562 als Zellmodell verwendet, um die Auswirkungen von Ceramid auf die CML-Zellproliferation und die Glykolyse zu untersuchen und die regulierende Rolle der aeroben Glykolyse bei der Hemmung der CML-Zellproliferation durch Ceramid zu erkunden.
Einige Tumorzellen machen metabolische Veränderungen durch, um ihren Energie- und Biosynthesebedarf für das Überleben und die schnelle Vermehrung zu decken, und die erhöhten Werte der aeroben Glykolyse (d.h. der Wolberg-Effekt) sind einer der metabolischen Marker für Tumorzellen. Die aerobe Glykolyse ist zu einem wichtigen Ziel für selektive Interventionen bei Leukämie geworden. Es ist nicht klar, ob Sulfonamid die CML-Proliferation durch Regulierung der CML-Glykolyse hemmt. In dieser Arbeit wird die CML-Zelllinie K562 als Zellmodell verwendet, um die Auswirkungen von Ceramid auf die CML-Zellproliferation und die Glykolyse zu untersuchen und die regulierende Rolle der aeroben Glykolyse bei der Hemmung der CML-Zellproliferation durch Ceramid zu erkunden.
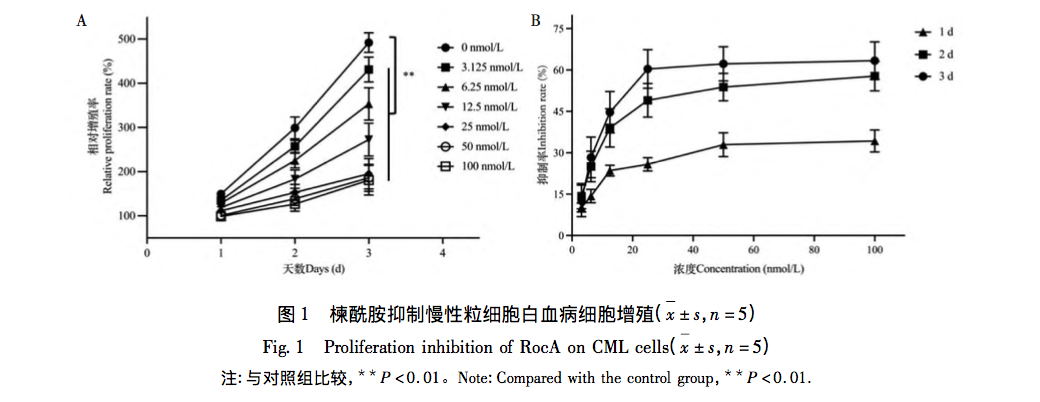
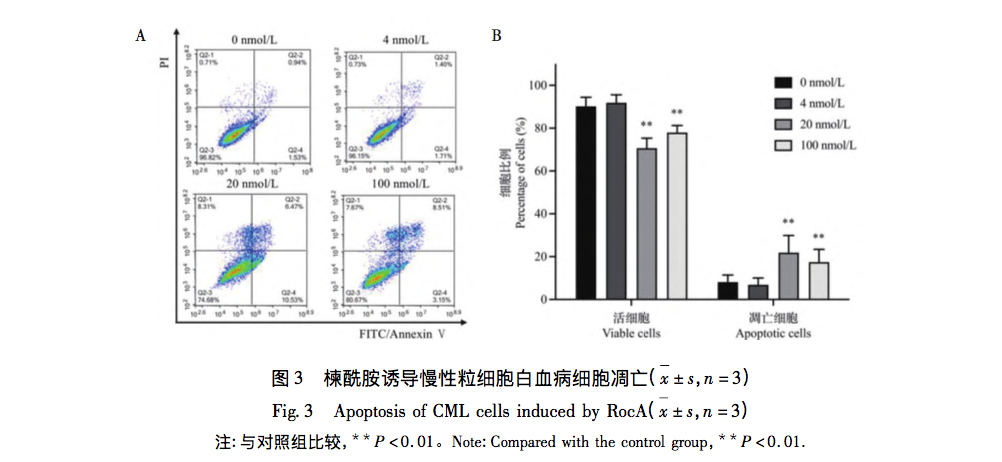
Melitamid ist ein Wirkstoff, der aus der Reiskrautpflanze gewonnen wird und eine tumorhemmende Wirkung hat. In diesem Artikel wird untersucht, ob das Sulfonamid die Proliferation von K562-Zellen durch aerobe Glykolyse hemmt. Die Ergebnisse des MTT-Tests zeigten, dass das Wachstum und die Proliferation von K562-Zellen durch Melitamid zeit- und konzentrationsabhängig signifikant gehemmt wurden, und die IC50 für die Hemmung der Proliferation von K562-Zellen erreichte den nanomolaren Bereich. Mit Hilfe der Durchflusszytometrie wurde nachgewiesen, dass Azepam die Proliferation von K562-Zellen hemmt und deren Apoptose auslöst, indem es die G2/M-Phase des Zellzyklus blockiert.
Tumorzellen weisen auch unter aeroben Bedingungen ein hohes Maß an Glukoseaufnahme, Glykolyse und Laktatspiegeln auf, was als Warburg-Effekt bekannt ist. Der Transkriptionsfaktor c-Myc ist maßgeblich an der Regulierung zellulärer Funktionen wie Zellproliferation, Zellüberleben, Gewebeumbau und Angiogenese beteiligt und initiiert auch die metabolische Umprogrammierung von Tumorzellen. c-Myc reguliert Glukosetransporter und fast alle glykolytischen Enzyme hoch und fördert so den Glukosestoffwechsel von Tumorzellen. 13C-markierte Glukose zeigte, dass c-Myc den Glukoseverbrauch in Burkitt-Lymphomen und c-Myc-gesteuertem Leberkrebs fördert. Die Forschung hat herausgefunden, dass c-Myc die Sekretion von Laktat fördert, das nicht nur eine Stoffwechselsubstanz ist, die an der Glykolyse beteiligt ist, sondern auch an der Förderung der Angiogenese, der Flucht vor dem Immunsystem, der Zellmigration, dem Stoffwechselbedarf und anderen krebserregenden Auswirkungen. Bei der Behandlung von K562-Zellen mit Glukose-Starvation stellten wir fest, dass der Entzug von Glukose die Laktatproduktion und die Proteinexpression von c-Myc verringerte und die Proliferation von K562-Zellen nicht förderte. Dies bestätigt, dass das Wachstum und die Proliferation von K562-Zellen von der Glukosezufuhr abhängen, was die Korrelation zwischen dem c-Myc-Gehalt und dem Glukosespiegel in K562-Zellen widerspiegelt. Unter Hungerbedingungen wurde festgestellt, dass die relative Hemmungsrate von Formamid auf K562-Zellen nach dem Entzug von Glukose geringer war als die der Gruppe, der Glukose zugesetzt wurde. Daher wird vermutet, dass die Hemmung des Wachstums von K562-Zellen durch Formamid teilweise von Glukose abhängig ist, was bedeutet, dass Formamid ohne Glukosezufuhr keine weitere Wachstumshemmung in K562-Zellen bewirken kann. Melitamid verringerte auch signifikant den Glukoseverbrauch und die Laktatproduktion im Überstand von K562-Zellen, was darauf hindeutet, dass Melitamid die aerobe Glykolyse in K562-Zellen hemmt.
Hexokinase 2 (HK2) ist ein spezifisches Schlüsselenzym in der Glykolyse von Tumorzellen, das an die äußere Mitochondrienmembran binden kann, um die aerobe Hochgeschwindigkeitsglykolyse von Tumorzellen aufrechtzuerhalten und Energie für die schnelle Vermehrung von Tumorzellen bereitzustellen. Die Forscher bestätigten anhand von Mausmodellen, dass HK2 eine wichtige Rolle bei der Entstehung und Entwicklung von Brustkrebs, Lungenkrebs und anderen Tumoren spielt. Hexokinase 1 (HK1) wird in erwachsenen Geweben häufig exprimiert und gilt als Housekeeping-Subtyp der Hexokinase; Phosphofructokinase P (PFKP) spielt eine entscheidende Rolle bei der Auslösung und Metastasierung von Krebs. Einige Studien haben gezeigt, dass PFKP das Potenzial hat, ein diagnostischer Marker oder ein Angriffspunkt für Medikamente bei Brust- und Lungenkrebs zu sein; Pyruvatkinase 2 (PKM2) wird in allen Zellen mit hohen Nukleinsäuresyntheseraten exprimiert, wie z. B. in normalen proliferierenden Zellen, embryonalen Zellen und insbesondere in Tumorzellen; Laktatdehydrogenase A (LDHA) katalysiert die gegenseitige Umwandlung von Pyruvat und L-Milchsäure. Der LDHA-Spiegel vieler menschlicher Tumorzellen ist höher als der von normalen Zellen. Eine Hemmung der LDHA kann die Vermehrung von Tumorzellen wie Kopf- und Halskrebs, Bauchspeicheldrüsenkrebs, Gebärmutterhalskrebs und Prostatakrebs verringern. Wir analysierten die Auswirkungen von Ceramid auf die Proteinexpression von HK2, HK1, PFKP, PKM2, LDHA und den onkogenen Transkriptionsfaktor c-Myc in K562-Zellen und stellten fest, dass Ceramid die Proteinexpression von HK1, PFKP, PKM2 und LDHA kaum regulierte, aber die Proteinexpression von c-Myc und HK2 signifikant herunterregulierte. Wir vermuten, dass Melinamid seine Wirkung gegen K562-Zellen durch die Herabregulierung von c-Myc und HK2 und die Hemmung der aeroben Glykolyse ausübt. Die regulatorische Beziehung zwischen c-Myc und HK2 muss weiter erforscht werden.
