A SIRT3/AMPK/mTOR jelátviteli útvonalat szabályozó magnolol hatása a Th17/Treg immunegyensúlyra fekélyes vastagbélgyulladásos egerekben
A fekélyes vastagbélgyulladás (UC) krónikus gyulladásos bélbetegség, amely a bél mikrobióta diszbiózisával jár. Jelenleg, bár a gyógyszeres kezelés (beleértve az 5-aminosalicilsavat, a kortikoszteroidokat, az immunszuppresszánsokat, a biológiai szereket és a probiotikumokat) enyhítheti a tüneteket, ezeket a kezeléseket korlátozza a magas kiújulási arány és az elkerülhetetlen mellékhatások (például hányinger, hányás, csontvelő-szuppresszió, fertőzés és rákkockázat). Ezért sürgős szükség van az UC új és hatékony terápiáinak kifejlesztésére. A genetikai tényezők, a bélkörnyezet, az immunválasz, a sejtek apoptózisa és a fertőzés mind kapcsolatban állnak az UC-vel. A jelentések szerint az UC-betegeknél károsodott a bél mikrobióta, ami a bélhámsejtek gátjának fokozott áteresztőképességéhez vezet, és bélgyulladásos válaszokat vált ki; az UC progressziója során pedig a gyulladást okozó T helper 17 sejtek (Th17) általában megnőnek, míg a gyulladást gátló szabályozó T-sejtek (Treg) csökkennek. A Th17/Treg egyensúly szabályozása a bél mikrobióta modulálásával kezelheti az UC-t. Ezért a Th17/Treg egyensúly szabályozása az UC kezelésének fontos célpontjává vált.
Az ozmanthus kivonat egy természetes termék, amely széles körben megtalálható különböző növényekben, például krizantémokban, paprikában és perillában. Gyulladáscsökkentő, antioxidáns, daganatellenes és vírusellenes hatással rendelkezik. Egyre több bizonyíték utal arra, hogy a magnolol csökkentheti a gyulladáskeltő citokinek, például a TNF - α és az IL-6 szekrécióját, ezáltal gátolja a gyulladásos válaszokat. Alkalmazzák a gyulladással összefüggő betegségek, köztük az UC kezelésében. A jelentések szerint a luteolin szabályozó hatással van a bélmikrobiótára, és a bélmikrobióta összetételének és szerkezetének beállításával hatékonyan befolyásolhatja az UC kezelését. Az azonban még mindig nem világos, hogy a magnolol képes-e szabályozni a Th17/Treg egyensúlyt az UC-ben.
A Treg és a Th17 közötti dinamikus egyensúlyt több jelátviteli útvonal szabályozza, amelyek közül az AMP aktivált protein kináz (AMPK)/mammalian target of rapamycin (mTOR) jelátviteli útvonal az egyik fontos szabályozó útvonal. Kutatások kimutatták, hogy az AMPK foszforilációs szintjének fokozásával és az mTOR foszforilációs szintjének csökkentésével szabályozható a humán Th17/Treg sejtek differenciálódása, és ez a hatás blokkolható az AMPK jelátviteli inhibitor C vegyülettel; A dextrán-szulfát-nátrium (DSS) - indukált UC patkány modellben a fokozott AMPK foszforiláció csökkentheti az mTOR expressziót és a különböző gyulladásos citokinek szintjét, ami a Th17 sejtek differenciálódásának csökkenéséhez vezet. A Silent information regulator 3 (SIRT3) egy gyulladáscsökkentő és tumorszupresszor gén, amely kölcsönhatásba lép a bél mikrobiótával a vastagbél tumorigenezis során. Arról számoltak be, hogy a SIRT3-hiányos egerek rendkívül érzékenyek a vastagbélgyulladásra és a tumor kialakulására. Tipp: A SIRT3 összefüggésbe hozható az UC progressziójával. Eközben a SIRT3 az AMPK/mTOR útvonal upstream szabályozója is, és túlterjedése felszabályozhatja az AMPK foszforilációt és leszabályozhatja az mTOR foszforilációt, gátolva a gyulladást. Egy nemrégiben végzett vizsgálat kimutatta, hogy a magnolol növelheti a SIRT3 expresszióját és megakadályozhatja az agyi iszkémiás-reperfúziós károsodást a SIRT3/AMPK/mTOR jelátviteli útvonal szabályozásával. Ezért e tanulmány célja annak feltárása, hogy a magnolol UC-re gyakorolt védő hatása összefügg-e a Th17 / Treg immunegyensúlyával, és elemezze annak mechanizmusát, annak érdekében, hogy tisztázza a magnolol UC-re gyakorolt védő hatását, és referenciát nyújtson az UC kezeléséhez és a magnolol alkalmazásához.
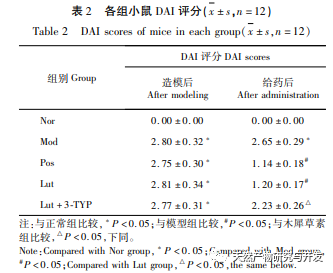
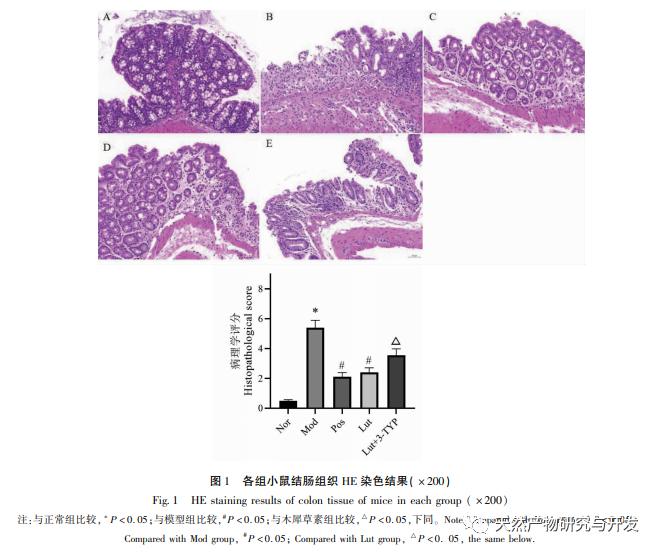

 Az utóbbi években a hagyományos kínai orvoslást széles körben alkalmazzák az UC kezelésére. Egyre több tanulmány utal arra, hogy a hagyományos kínai orvoslás fontos szerepet játszik a bél mikrobióta szabályozásában az UC kezelése során. Az Osmanthus fragrans az egyik legalaposabban vizsgált bioflavonoid. A flavonoidok alacsony toxicitású természetes vegyületek, és eddig nem regisztráltak komoly mellékhatásokat, így használatuk rendkívül biztonságos. Ebben a tanulmányban a magnolol DSS által kiváltott UC-re gyakorolt hatását vizsgálták in vivo. Eredményeink azt mutatják, hogy a magnolol jelentős hatással van az UC-re, ami a súlycsökkenéssel, a DAI pontszámmal, a nyálkahártya-nekrózis és a gyulladásos sejtek beszivárgásának csökkenésével mutatható ki. Ez összhangban van a korábbi kutatásokkal, ismét megerősítve a magnolol UC-re gyakorolt védő hatását.
Az utóbbi években a hagyományos kínai orvoslást széles körben alkalmazzák az UC kezelésére. Egyre több tanulmány utal arra, hogy a hagyományos kínai orvoslás fontos szerepet játszik a bél mikrobióta szabályozásában az UC kezelése során. Az Osmanthus fragrans az egyik legalaposabban vizsgált bioflavonoid. A flavonoidok alacsony toxicitású természetes vegyületek, és eddig nem regisztráltak komoly mellékhatásokat, így használatuk rendkívül biztonságos. Ebben a tanulmányban a magnolol DSS által kiváltott UC-re gyakorolt hatását vizsgálták in vivo. Eredményeink azt mutatják, hogy a magnolol jelentős hatással van az UC-re, ami a súlycsökkenéssel, a DAI pontszámmal, a nyálkahártya-nekrózis és a gyulladásos sejtek beszivárgásának csökkenésével mutatható ki. Ez összhangban van a korábbi kutatásokkal, ismét megerősítve a magnolol UC-re gyakorolt védő hatását.
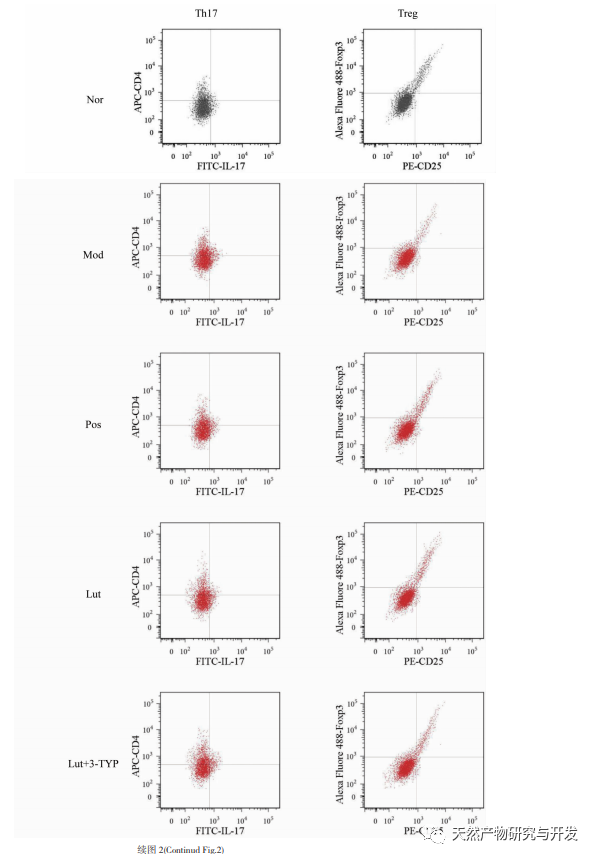
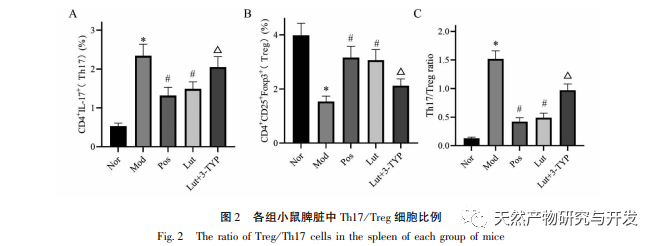
Korábbi tanulmányok kimutatták, hogy a luteolin gátolhatja a Th17 választ a T-sejt-mediált autoimmun betegségekben; és gyulladáscsökkentő hatást fejthet ki azáltal, hogy a CD4+CD25-öt Treg-sejtekké alakítja. Arról is beszámoltak, hogy a luteolin képes gátolni a pro-inflammatorikus citokinek, mint a TNF - α, IL-1 β, IL-6 és IL-17 termelését UC modell egerekben; Az Osmanthus származékok in vivo védőhatást fejthetnek ki DSS indukált UC modellekben a Th1, Th2 és Th17 sejtek szintjének csökkentésével. Megvizsgáltuk továbbá a magnolol hatását a Th17/Treg egyensúlyra, amely az UC progressziójának egyik fontos mechanizmusa. Ebben a vizsgálatban a Treg-sejtek százalékos arányának szignifikáns csökkenését és a Th17-sejtek százalékos arányának szignifikáns növekedését találtuk az UC egerek lépi limfocitáiban. A Th17/Treg arány az UC egerekben súlyosan kiegyensúlyozatlan. A lép fontos immunszerv, és a DSS immunrendszeri diszfunkciót indukálhat UC egerekben, ami kompenzációs lépmérgességhez vezet; A luteolin pedig csökkentheti a lépindexet és enyhítheti a DSS által kiváltott vastagbélgyulladást egerekben. Ez a vizsgálat tovább erősíti a jelentős Th17/Treg egyensúlyhiányt az UC egerek lépi limfocitáiban, ami összhangban van a humán UC-vel.
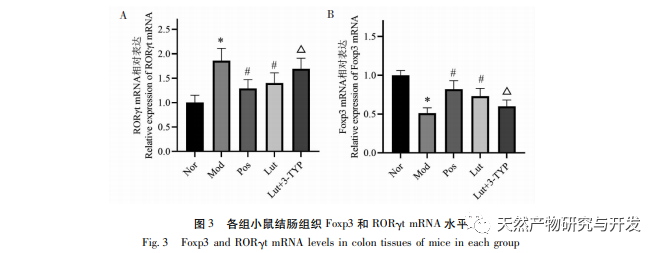
A Th17 sejtek differenciálódási folyamatát a ROR γ t transzkripciós szabályozása közvetíti. A Th17 sejtek pro-inflammatorikus citokineket termelnek, beleértve az IL-17, IL-21, IL-22, IL-23 és IL-25 sejteket, amelyek hozzájárulnak az UC progressziójához. A Tregek differenciálódását a Foxp3 szabályozza, és az érett Tregek magas Foxp3-szintet expresszálnak. Ezenkívül a Tregek gátló citokineket, köztük IL-10-et, IL-35-öt és TGF - β-t szekretálnak, amelyek elnyomhatják az adaptált és veleszületett immunválaszokat. Kutatások kimutatták, hogy a megnövekedett Th17 sejtek magas IL-17 és IL-23 szintet termelnek, ezáltal elősegítve a gyulladást. A Treg sejtek differenciálódása azonban gátolt, ami az immunszuppresszív citokinek, köztük az IL-10 csökkenéséhez vezet. A Th17/Treg egyensúlyhiány javítása segíthet a bélrendszeri immunhomeosztázis helyreállításában és az UC csökkentésében. Ez a vizsgálat kimutatta, hogy a luteolin csoportban az IL-10 gyulladáscsökkentő citokin megnövekedett, az IL-6, IL-17 és IL-23 pro-inflammatorikus citokinek pedig csökkentek; Tipp: A magnolol beavatkozása javította a Th17/Treg egyensúlyhiányt a DSS indukált UC modellben, összhangban a korábbi vizsgálatokkal; Ezen túlmenően, további elemzések kimutatták, hogy a magnolol jelentősen lefelé szabályozta a ROR γ t és felfelé szabályozta a Foxp3-t UC egerekben. A ROR γ t és a Th17 sejtek differenciálódása közötti pozitív korreláció, valamint a Foxp3 és a Treg sejtek differenciálódása közötti pozitív korreláció miatt kutatási eredményeink tovább bizonyítják, hogy a magnolol hozzájárul a Th17/Treg sejtek differenciálódásának egyensúlyához.
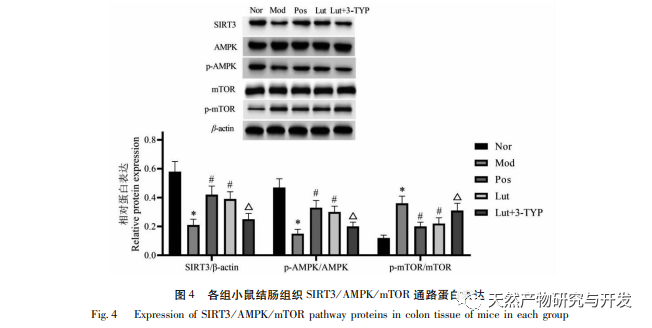
A Th17/Treg sejtek differenciálódását két fő tápanyagérzékelő útvonal, az AMPK és az mTOR szabályozza. A SIRT3 egy hatékony deacetiláz, amely bizonyítottan aktiválja az AMPK/mTOR útvonalat az autofágia elősegítése érdekében, míg a SIRT3 hiánya gátolhatja az AMPK/mTOR útvonalat. Ebben a vizsgálatban megfigyeltük, hogy a SIRT3 fehérje szintje és a p-AMPK/AMPK arány az UC egerek vastagbélszövetében szignifikánsan alacsonyabb volt, mint a normál egereké, míg a p-mTOR/mTOR arány szignifikánsan magasabb volt, mint a normál egereké, ami a SIRT3 hiányára utal az UC egerekben és az AMPK aktiváció gátlására. Az Osmanthus fragrans szabályozhatja az AMPK aktivitást a csendesítő szabályozó fehérjék expressziójának modulálásával. Liu és munkatársai tanulmánya kimutatta, hogy a magnolol növelheti a SIRT3 transzdukcióját, aktiválhatja a SIRT3/AMPK/mTOR útvonalat, és enyhítheti az agyi iszkémiás sérülést. Ezért feltételezzük, hogy a magnolol hatása a Th17/Treg egyensúlyra UC egerekben a SIRT3/AMPK/mTOR útvonalhoz kapcsolódhat. A Western blot eredmények azt mutatták, hogy a magnolol képes növelni a SIRT3 fehérje szintjét az UC egerek vastagbélszövetében, fokozza az AMPK foszforilációs szintjét, és lefelé szabályozza az mTOR foszforilációs szintjét, ami megerősíti hipotézisünket. A 3-TYP a SIRT3 szelektív inhibitora, és a jelentések szerint gátolja a SIRT3 expresszióját. Ebben a vizsgálatban a magnolol UC egereken kifejtett védőmechanizmusának további tisztázása érdekében a magnolol beavatkozását 3-TYP-pel kombináltuk. Az eredmények azt mutatták, hogy a 3-TYP jelentősen gátolni tudta az AMPK aktiválódását és jelentősen gyengítette a magnolol hatását a Th17/Treg sejtek differenciálódási egyensúlyára UC egerekben. Tipp: Az osmanthus kivonat elősegítheti a Th17/Treg egyensúlyt UC egerekben a SIRT3/AMPK/mTOR útvonal aktiválásával.
Összefoglalva, a magnolol javíthatja a Th17/Treg egyensúlyhiányt a DSS által indukált UC egérmodellekben, és hatásmechanizmusa a SIRT3/AMPK/mTOR útvonal aktiválásához kapcsolódhat. Ez a tanulmány előzetesen feltárta a magnolol védő mechanizmusát UC egereken a Th17/Treg egyensúly szempontjából, jelezve, hogy a magnolol hatékony jelölt összetevő lehet a bélgyulladás kezelésére, ígéretes kezelési módszert biztosítva az UC számára, és irányt adva az UC-t javító magnolol mechanizmusának további kutatásához. Például a SIRT3/AMPK/mTOR útvonal szabályozza az autofágiát, és hogy a magnolol UC-ben betöltött szerepe összefügg-e az autofágiával, azt a jövőbeni kutatások során tovább vizsgáljuk. Ezenkívül az állatkísérletek a preklinikai kutatás kulcsfontosságú láncszemei, és a jövőbeli tanulmányokban a magnolol toxicitásának és biztonságosságának mélyreható elemzését fogják elvégezni, megalapozva ezzel a preklinikai kutatás előmozdítását és a gyógyszerek klinikai fordításának elérését.
