L'approbation de nouveaux ingrédients alimentaires a toujours été une information brûlante qui préoccupe beaucoup les entreprises. L'annonce de nouveaux ingrédients alimentaires signifie qu'un certain ou certains nouveaux ingrédients alimentaires ont passé l'examen de sécurité, l'application de la légalisation de la Chine, peut rapidement sortir de la liste d'un certain boom alimentaire. Cependant, dans l'application réelle des nouveaux ingrédients alimentaires, nous pouvons avoir quelques questions sur l'approbation des nouveaux ingrédients alimentaires, l'utilisation et l'étiquetage, le réseau de partenaires alimentaires suivant sur certains problèmes communs pour explorer les instructions.
Définition, gestion et interrogation des nouveaux ingrédients alimentaires
Tout d'abord, qu'est-ce que les nouveaux ingrédients alimentaires ?
Avec le changement du système de gestion des nouveaux ingrédients alimentaires en Chine, le nom des nouveaux ingrédients alimentaires est passé de "nouvelles ressources alimentaires" à "nouveaux ingrédients alimentaires", et la connotation du concept de nouveaux ingrédients alimentaires a également changé.
Les "Mesures administratives pour l'examen de la sécurité des nouveaux ingrédients alimentaires" actuelles stipulent clairement : "Les nouveaux ingrédients alimentaires sont les produits suivants qui ne sont pas traditionnellement consommés en Chine :
(a) Animaux, plantes et micro-organismes ;
(ii) Composants isolés à partir d'animaux, de plantes et de micro-organismes ;
(iii) les ingrédients alimentaires dont la structure d'origine a été modifiée ;
(d) d'autres ingrédients alimentaires nouvellement développés". Par "habitudes alimentaires traditionnelles", on entend une denrée alimentaire qui, dans la juridiction provinciale, est produite et gérée de manière stéréotypée ou non depuis plus de 30 ans, et qui ne figure pas dans la "Pharmacopée de la République populaire de Chine".
Deuxièmement, l'approbation de la gestion des nouveaux ingrédients alimentaires
Les caractéristiques des ingrédients alimentaires, conformes aux exigences nutritionnelles, doivent être non toxiques, inoffensives et ne pas entraîner de risques aigus, subaigus ou chroniques ou d'autres risques potentiels pour la santé humaine. Conformément à la définition susmentionnée des nouveaux ingrédients alimentaires, tels que la nécessité de développer la production et l'exploitation d'aliments ordinaires, la déclaration d'approbation doit être conforme aux dispositions relatives à la "sécurité des nouveaux ingrédients alimentaires et à l'examen de l'approche de la gestion".
Toutefois, ceux qui ont été inclus dans la "norme nationale pour la sécurité alimentaire, norme pour l'utilisation des additifs alimentaires" (GB 2760) et la "norme nationale pour la sécurité alimentaire, norme pour l'utilisation de l'enrichissement nutritionnel" (GB 14880) ne sont pas inclus dans le champ d'application de la déclaration.
Conformément aux dispositions de la loi sur la sécurité alimentaire, l'utilisation de nouvelles matières premières alimentaires pour la production de denrées alimentaires doit être soumise au département administratif de la santé du Conseil d'État (la Commission nationale de la santé et du bien-être) afin d'évaluer la sécurité des produits concernés, et le département administratif de la santé du Conseil d'État organisera l'examen.
Conformément au "Règlement relatif à la déclaration et à l'acceptation de nouveaux ingrédients alimentaires" et à d'autres exigences réglementaires, les demandeurs doivent soumettre les documents de déclaration requis à la Commission nationale de la santé et de l'hygiène, qui les examinera à la réception des documents de demande ; en fonction de l'examen, elle procédera à l'acceptation, à l'irrecevabilité ou à la correction des documents de la lettre ou de l'avis de décision. Si le public souhaite connaître la dynamique d'approbation des nouveaux ingrédients alimentaires, il peut s'adresser à la plate-forme de services gouvernementaux de la Commission nationale de la santé : https://zwfw.nhc.gov.cn/kzx/sdxx/sdxxqb/.
Le comité d'examen des experts tire des conclusions techniques sur les nouveaux ingrédients alimentaires par le biais d'une évaluation. Les résultats de l'approbation finale sont divisés en trois catégories : annonce de l'approbation, pas d'autorisation, fin de l'examen.
III. Explication de la fin de l'examen
Dans le processus d'approbation des nouveaux ingrédients alimentaires, le comité d'experts peut mettre fin à l'examen des conclusions de l'évaluation technique dans trois cas : après l'examen d'un aliment commun ou d'un aliment commun présentant une équivalence substantielle ; après l'annonce d'un nouvel ingrédient alimentaire présentant une équivalence substantielle ; et dans d'autres cas, pour mettre fin à l'examen. L'équivalence substantielle signifie que si un ingrédient alimentaire nouvellement déclaré est identique à un aliment ou à un nouvel ingrédient alimentaire annoncé en termes d'espèce, de source, de caractéristiques biologiques, d'ingrédients principaux, de parties de l'aliment, de quantité utilisée, de champ d'application et de population d'application, etc., et si le processus et les exigences de qualité adoptés sont fondamentalement les mêmes, on peut considérer qu'ils sont également sûrs et qu'ils ont une équivalence substantielle. Les exemples suivants illustrent la fin de l'examen susmentionné.
(1) Examiné en tant que denrée alimentaire courante ou équivalent en substance à une denrée alimentaire courante : oligosaccharide de soja, la fin de l'avis d'examen est "il existe des normes nationales pour l'oligosaccharide de soja, lorsqu'il est utilisé comme matière première alimentaire, il doit être mis en œuvre conformément au contenu pertinent de la norme pour l'oligosaccharide de soja (GB/T22491-2008)".
(2) Équivalence substantielle avec le nouvel ingrédient alimentaire annoncé : Hyaluronate de sodium, avec l'avis de clôture suivant : "Ce produit est obtenu par fermentation de la sous-espèce Streptococcus equi avec du glucose, de la poudre de levure, de la peptone, etc. comme milieu de culture. Il est substantiellement équivalent à l'hyaluronate de sodium (ancienne annonce du ministère de la santé n° 9 de 2020), qui a été approuvé. Il est recommandé de mettre fin au réexamen et de le mettre en œuvre conformément au contenu pertinent de l'hyaluronate de sodium publié." Le hyaluronate de sodium conforme à l'avis de réexamen est géré comme un nouvel ingrédient alimentaire.
(3) Autres cas de clôture du réexamen : Lotus corniculatus, l'avis de clôture de l'examen est le suivant : "Compte tenu du fait que Lotus corniculatus a été inclus dans la pharmacopée de la République populaire de Chine dans une variété de préparations simples et sur ordonnance, avec une activité pharmacologique évidente, il est recommandé de clôturer l'examen". Il est clair que l'hydraste n'est pas un ingrédient alimentaire.
Quatrièmement, la recherche de nouveaux ingrédients alimentaires
Si vous souhaitez savoir si un certain ingrédient est un nouvel ingrédient alimentaire approuvé, ou si vous voulez vérifier quels nouveaux ingrédients alimentaires sont actuellement approuvés, en fin d'examen ou ouverts aux commentaires, vous pouvez effectuer votre recherche de la manière suivante.
(1) Base de données d'informations sur les ingrédients alimentaires des partenaires alimentaires
La base de données d'informations sur les ingrédients alimentaires de FoodPartner.com résume les informations sur les nouveaux ingrédients alimentaires approuvés et dont l'examen a pris fin au fil des ans, et associe l'annonce originale des nouveaux ingrédients alimentaires et les lettres de réponse correspondantes, ce qui constitue un outil de recherche très pratique. Lien d'interrogation : http://db.foodmate.net/xinshipin/.
(2) Système d'interrogation publique pour la licence administrative de santé de la Commission nationale de la santé et du bien-être
Ce système de recherche est divisé en deux parties : le répertoire des nouvelles ressources alimentaires approuvées avant 2007, le répertoire des annonces de nouveaux ingrédients alimentaires approuvés après 2007 et le répertoire de l'examen final des nouveaux ingrédients alimentaires. Lien d'interrogation : https://slps.jdzx.net.cn/xwfb/gzcx/PassFileQuery.jsp.
(3) Site officiel de la Commission nationale de la santé et du bien-être
Si vous souhaitez vérifier le statut d'approbation et les détails de l'annonce d'un nouvel ingrédient alimentaire donné, vous pouvez également rechercher le nom du nouvel ingrédient alimentaire directement sur le site officiel du NHRC.
(4) Demande de commentaires pour la licence administrative du centre national d'évaluation des risques
Si vous souhaitez obtenir des informations sur la demande de commentaires concernant le nouvel ingrédient alimentaire, vous pouvez utiliser la section "Demande de commentaires concernant la licence administrative" du Centre d'évaluation des risques pour en savoir plus sur les développements pertinents. Inquiry link: https://www.cfsa.net.cn/Article/LawNew_List.aspx?channelcode=FD7DFE7A58DAB7788ED6929809972C8AE0FC102162B069D1&code= 9535ed5882d69ad7f633fea0205be83a.
Comprendre pleinement le contenu de l'annonce de nouveaux ingrédients alimentaires
et l'utilisation conforme de nouveaux ingrédients alimentaires
I. Prêter attention à la teneur en annonce des nouveaux ingrédients alimentaires
Selon les "Mesures administratives pour l'examen de la sécurité des nouveaux ingrédients alimentaires", l'annonce des nouveaux ingrédients alimentaires contient généralement le nom de la matière première, la source, le processus de production, les principaux ingrédients, les spécifications de qualité, les exigences en matière d'étiquetage et d'autres informations à annoncer. Parmi ces éléments, les "autres informations à annoncer" sont très changeantes, les personnes inadaptées et les exigences spéciales en matière d'étiquetage sont généralement incluses dans cet élément.
Lorsque nous décidons si une certaine matière première est un nouvel ingrédient alimentaire, nous devons rechercher l'annonce de nouveaux ingrédients alimentaires, examiner attentivement l'annonce originale et comprendre pleinement le contenu de l'annonce, y compris les parties alimentaires, la consommation alimentaire, la consommation alimentaire, le processus de production, les spécifications de qualité, le champ d'application, les groupes inadéquats, etc.
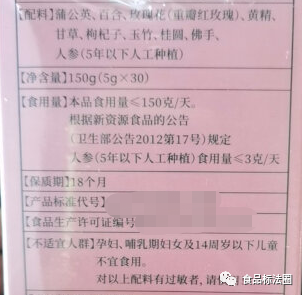
Par exemple, "Ginseng (plantation artificielle)", dans la colonne des informations de base de l'annonce du nouvel ingrédient alimentaire, il est clair : "Source : ginseng planté artificiellement depuis 5 ans et moins de 5 ans", ce qui signifie que le ginseng planté artificiellement depuis plus de 5 ans n'entre pas dans le champ d'application des nouveaux ingrédients alimentaires approuvés. Un autre exemple est celui du "Mujing Ye Ke", dont l'annonce précise clairement que la partie comestible est constituée de jeunes feuilles (bourgeons) et que le mode de consommation est l'infusion, de sorte que les autres parties qui n'entrent pas dans le champ d'application de l'annonce, ou dont le mode de consommation diffère de l'annonce, n'entrent pas non plus dans le champ d'application de l'annonce du nouvel ingrédient alimentaire.
Dans la plupart des cas, l'annonce de nouveaux ingrédients alimentaires indique le nom latin de la matière première. Il est impossible de savoir si la matière première utilisée dans l'annonce de la matière première, vous pouvez vérifier que le nom latin des deux est cohérent pour vous aider à juger.
Deuxièmement, la conversion de la concentration des nouveaux ingrédients alimentaires
Certains nouveaux ingrédients alimentaires feront l'objet d'un processus de microencapsulation et de dilution afin de produire une concentration plus faible de nouveaux ingrédients alimentaires annoncés ; dans ce cas, la consommation de nouveaux ingrédients alimentaires doit être calculée en fonction de la concentration du produit équivalent.
Dans ce cas, il est fait référence à l'annonce de l'ancien ministère de la santé sur l'approbation des esters de lutéine et à la lettre de réponse sur la question de l'utilisation des esters de lutéine à faible concentration : "L'annonce du ministère de la santé sur l'approbation de 7 nouveaux aliments, dont le Lactobacillus Acidophilus (n° 12, 2008), qui exige que la teneur en dipalmitate de lutéine des esters de lutéine soit >55,8% et que la quantité consommée soit inférieure à ≤12mg/j ; la lettre de réponse du bureau général du ministère de la santé sur les questions relatives à l'utilisation des esters de lutéine clarifie ce qui suit : "La quantité de consommation du nouvel ingrédient alimentaire doit être calculée en fonction de la concentration du produit. La lettre de réponse du bureau général du ministère de la santé sur l'utilisation des esters de lutéine précise que "la faible concentration d'esters de lutéine produite par microencapsulation et dilution peut être utilisée comme matière première alimentaire, et sa consommation doit être calculée en fonction de la concentration du produit".
Sur la base de ce qui précède, en supposant que la teneur en dipalmitate de lutéine dans l'ester de lutéine dilué est de 20%, sa consommation devrait être <(55,8%×12/20%)(mg/jour).
III. Conformité de l'introduction de nouveaux ingrédients alimentaires
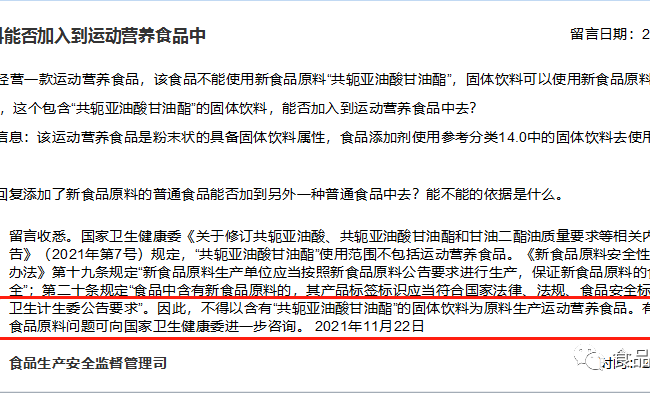
En novembre 2021, l'Administration d'État pour la surveillance et la réglementation du marché (SAMSAR) a répondu à un message public sur la question de savoir si des boissons solides peuvent être ajoutées à des aliments nutritionnels pour sportifs, qui a attiré l'attention. Le message et la réponse montrent que l'attitude de la surveillance du marché n'est pas favorable à l'utilisation intentionnelle de matières premières spécifiques pour introduire dans le produit final un nouvel ingrédient alimentaire qui ne peut pas être utilisé dans le produit final.
Comment étiqueter les nouveaux ingrédients alimentaires dans la liste des ingrédients ?
I. Exigences en matière d'étiquetage pour les nouveaux ingrédients alimentaires figurant dans la liste des ingrédients
Mesures administratives pour l'examen de la sécurité des nouveaux ingrédients alimentaires" : "Les aliments contenant de nouveaux ingrédients alimentaires doivent être étiquetés conformément aux lois et règlements nationaux, aux normes de sécurité alimentaire et aux exigences de l'annonce de la Commission nationale de la santé et de la planification familiale. Selon cette disposition, les noms des nouveaux ingrédients alimentaires figurant dans la liste des ingrédients alimentaires doivent également être conformes aux exigences de l'annonce.
Le fait de ne pas étiqueter les noms des nouveaux ingrédients alimentaires en stricte conformité avec les exigences de l'annonce peut induire en erreur. Prenons l'exemple du "ginseng" : il figure sur la "liste des articles pouvant être utilisés dans les aliments diététiques", et les articles énumérés dans cette liste ne peuvent être utilisés que dans les aliments diététiques ; l'ancienne annonce du ministère de la santé n° 17 de 2012 précise que le "ginseng (cultivé artificiellement)" est inclus dans la liste des nouveaux ingrédients alimentaires. Le "ginseng (artificiel)" est inclus dans la gestion des nouvelles matières premières alimentaires. Par conséquent, il est inexact d'étiqueter le "ginseng" directement dans la liste des ingrédients, et lorsqu'il est appliqué aux denrées alimentaires en tant que nouvel ingrédient alimentaire, il doit être étiqueté avec le nom "ginseng (culture artificielle)" dans l'annonce.
Étiquetage de la taille des portions des nouveaux ingrédients alimentaires
Selon la "Division de l'alimentation de la Commission nationale de la santé et de la planification familiale sur les aliments préemballés contenant de nouveaux ingrédients alimentaires, l'étiquetage et les questions liées à l'oligofructose de la réponse" (Lettre sur l'étiquetage des aliments de santé nationale [2015] n ° 279) : "Selon les "Normes nationales de sécurité alimentaire Règles générales pour l'étiquetage des aliments préemballés" (GB 7718-2011) dispositions pertinentes, la méthode de consommation appartient au contenu d'étiquetage recommandé. méthode de consommation appartient au contenu d'étiquetage recommandé.
Si l'aliment préemballé contient de nouveaux ingrédients alimentaires qui ont été annoncés, si l'annonce exige explicitement l'étiquetage de la taille de la portion et de la population non appropriée dans l'étiquetage et les instructions, l'étiquetage doit être effectué conformément aux exigences de l'annonce pertinente ; si l'annonce contient les exigences relatives à la taille de la portion et à la population non appropriée mais n'exige pas leur étiquetage dans l'étiquetage et les instructions, ils peuvent être étiquetés ou non à la discrétion des entreprises de production alimentaire".
L'ancienne annonce du ministère de la santé n° 12 de 2008 précise que la portion de gel d'aloe vera doit être de ≤30g/jour ; toutefois, l'annonce n'exige pas que la "portion" soit indiquée sur l'étiquette du produit.
L'annonce du ministère de la santé et d'autres ministères et bureaux sur les exigences en matière d'étiquetage des aliments contenant du gel d'aloe vera (annonce n° 1 de 2009) contient une explication correspondante sur l'étiquetage de la taille des portions de gel d'aloe vera : "Les entreprises doivent stipuler la taille de la portion journalière des produits alimentaires contenant du gel d'aloès dans les normes de l'entreprise. S'il n'est pas possible de garantir que la consommation quotidienne d'aloe vera par les consommateurs se situe dans la fourchette de sécurité, un avertissement relatif à la taille de la portion journalière doit être indiqué sur l'emballage.
En combinant la lettre de réponse ci-dessus et les exigences de l'annonce, on constate que si l'annonce d'un nouvel ingrédient alimentaire n'exige pas explicitement l'indication de la "taille de la portion", elle peut être combinée aux exigences de consommation de l'annonce et à la consommation finale de l'aliment pour déterminer s'il faut ou non indiquer la "taille de la portion" sur l'étiquette. "L'étiquette peut être déterminée en tenant compte des exigences en matière de taille des portions de l'annonce et de la consommation finale de la denrée alimentaire. Si l'on peut s'assurer que la consommation journalière des consommateurs se situe dans la fourchette de sécurité, on peut choisir d'indiquer ou non la "taille de la portion" ; si l'on ne peut pas s'assurer que la consommation journalière de nouveaux ingrédients alimentaires se situe dans la fourchette de sécurité, il est recommandé d'indiquer la taille de la portion journalière sur l'emballage.
Troisièmement, l'étiquetage des personnes inadaptées
Certains nouveaux ingrédients alimentaires dans la déclaration des nourrissons et des jeunes enfants, des femmes enceintes et d'autres populations spéciales n'ont pas fourni d'évaluation de la sécurité des matériaux alimentaires, ou les matériaux fournis ne sont pas suffisants pour garantir la sécurité de la consommation dans des groupes spéciaux, par conséquent, l'annonce de ses nouveaux ingrédients alimentaires expressément requis pour indiquer la population inappropriée, tels que "BaoLeGuo poudre", "alcools gras de son de riz", "ginseng (cultivé)", etc. Si ces nouveaux ingrédients alimentaires sont ajoutés au produit final, l'étiquetage doit indiquer la population non appropriée conformément aux exigences.
Des exemples de l'étiquetage de la dénomination, de la taille de la portion et de la population inadaptée dans la liste des ingrédients sont présentés ci-dessous.