Étude de l'effet d'amélioration de la saponine VI de Chuanxuduan sur la neurogenèse et la fonction cognitive chez les souris privées de sommeil
La privation de sommeil fait référence à un état de perte partielle ou totale du sommeil normal, causé par diverses raisons, qui est largement répandu dans la société actuelle. Le manque de sommeil à long terme peut entraîner des troubles fonctionnels dans l'organisme, provoquant un dysfonctionnement neurocognitif. La recherche a confirmé que le manque de sommeil active la microglie dans le système nerveux central et l'incite à libérer des molécules neurotoxiques. La microglie activée affecte les fonctions cognitives par des mécanismes tels que la neurogenèse hippocampique et la plasticité synaptique. Le manque de sommeil a gravement affecté la santé physique et mentale des personnes et constitue un problème social de santé publique qui ne peut être ignoré. La mise au point de médicaments d'intervention efficaces présente un grand potentiel.
L'asprosaponine VI (ASA VI) est une saponine triterpénoïde isolée de la médecine traditionnelle chinoise Dipsaci Radix, qui a de bons effets anti-ostéoporose, anti-inflammatoires et neuroprotecteurs. Des études antérieures ont montré que l'ASAVI peut pénétrer efficacement la barrière hémato-encéphalique, réguler la fonction de la microglie, promouvoir la prolifération et la différenciation des cellules souches neurales et présenter une bonne activité pharmacologique dans les études sur la dépression et la démence. Cette étude a examiné l'effet d'amélioration de l'ASA VI sur la fonction cognitive chez les souris privées de sommeil et a exploré plus avant son mécanisme d'action, fournissant ainsi une base pour le développement de médicaments d'intervention connexes.
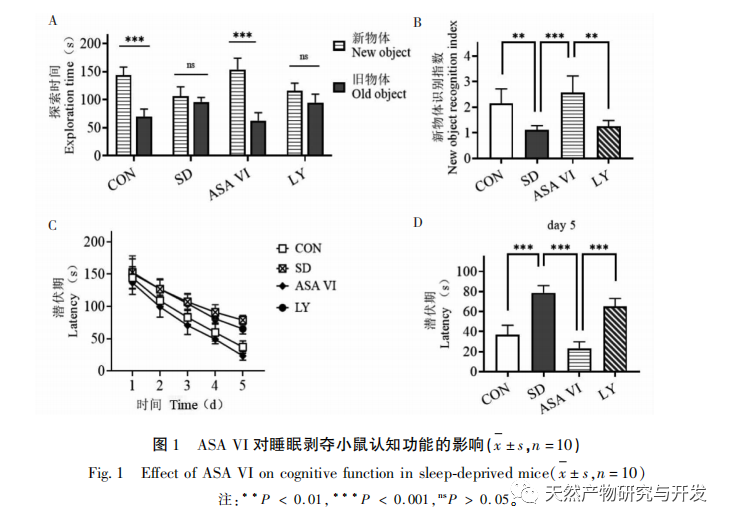
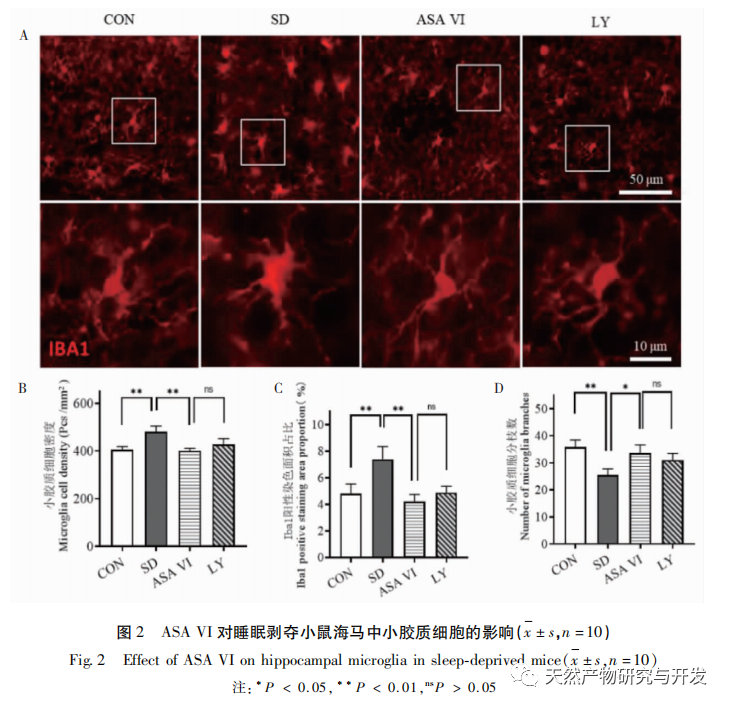
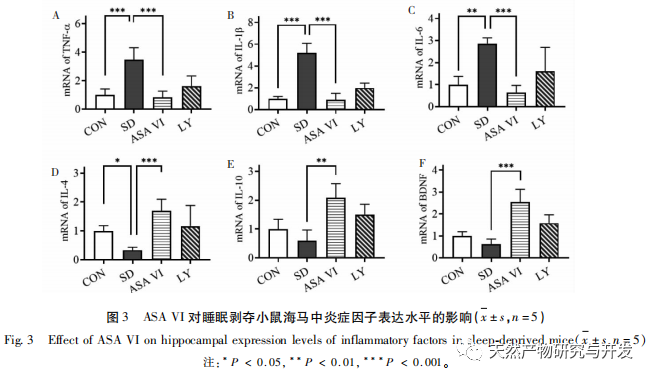
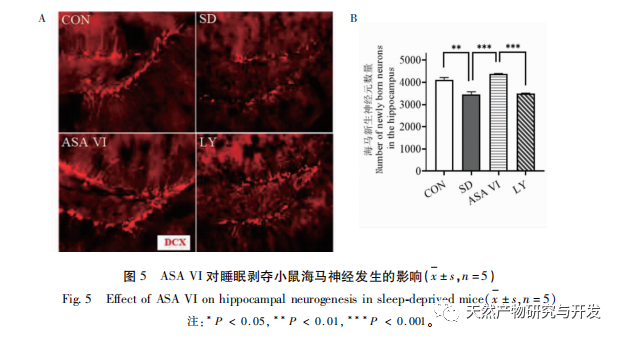
La privation de sommeil peut avoir des effets étendus et profonds sur le comportement cognitif et est étroitement associée à l'apparition de diverses maladies. Cette étude a montré que le manque de sommeil affecte de manière significative la mémoire à court terme et les capacités d'apprentissage et de mémoire spatiale des souris, augmente le nombre de microglies, accroît le niveau d'expression des facteurs inflammatoires et inhibe la neurogenèse de l'hippocampe adulte. L'intervention de l'ingrédient actif naturel ASA VI a amélioré de manière significative la fonction cognitive des souris privées de sommeil, tout en inhibant l'expression des cytokines pro-inflammatoires IL-1 β, TNF-α et IL-6 dans l'hippocampe, en augmentant les niveaux d'expression des cytokines anti-inflammatoires IL-4, IL-10 et du facteur neurotrophique BDNF, et en favorisant la neurogénèse dans l'hippocampe. Cela indique que l'AAS VI, en tant que médicament anti-inflammatoire et neuroprotecteur, a pour effet d'améliorer l'apprentissage et la mémoire chez les souris privées de sommeil.
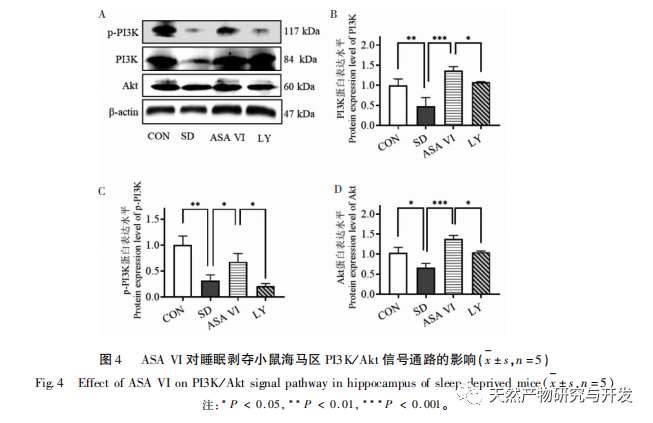
La microglie est un type de cellule immunitaire très hétérogène qui ne provient pas du système nerveux central. Elles jouent un rôle important dans la surveillance immunitaire et le maintien de l'homéostasie dans l'environnement interne. Lorsqu'elles sont stimulées, les microglies raccourcissent leurs branches, élargissent leur corps cellulaire et entrent dans un état de défense immunitaire, libérant une grande quantité de cytokines pro-inflammatoires. Cette étude a montré que le manque de sommeil peut induire une activation excessive de la microglie dans l'hippocampe, augmentant ainsi la surexpression des cytokines pro-inflammatoires IL-1 β, TNF-α et IL-6. Lorsque la privation de sommeil se poursuit, ces facteurs inflammatoires peuvent entraîner une neuroinflammation chronique et causer des dommages chroniques aux neurones, aux astrocytes, aux oligodendrocytes et à d'autres cellules cérébrales, entraînant finalement un dysfonctionnement cognitif chez les souris. L'intervention d'ASA VI peut améliorer l'augmentation du nombre et de la surface des microglies dans l'hippocampe des souris causée par la privation de sommeil, et augmenter le nombre de ramifications. Tout en réduisant la sécrétion de molécules pro-inflammatoires, elle augmente également l'expression de molécules anti-inflammatoires et de facteurs neurotrophiques. Ces résultats suggèrent que le mécanisme possible par lequel l'AAS VI améliore la fonction cognitive chez les souris privées de sommeil est la transformation du phénotype pro-inflammatoire de la microglie en un phénotype neuroprotecteur. Ces microglies au phénotype neuroprotecteur sécrètent non seulement des cytokines anti-inflammatoires pour supprimer la neuroinflammation, mais aussi des facteurs neurotrophiques pour réparer les tissus endommagés et exercer des fonctions neuroprotectrices. Les résultats de cette étude ont montré que, par rapport au groupe d'intervention ASA VI, le traitement par l'inhibiteur LY294002 n'a pas affecté de manière significative la morphologie et la quantité de microglies, l'expression des facteurs inflammatoires et des facteurs neurotrophiques, ce qui indique que dans l'hippocampe des souris privées de sommeil, l'ASA VI régule le phénotype microglial indépendamment de la voie de signalisation PI3K/Akt. Bien qu'il n'y ait pas de différence significative dans l'expression des facteurs inflammatoires de l'hippocampe entre le groupe LY294002 et le groupe ASA VI, le traitement au LY294002 a réduit les niveaux d'expression des cytokines anti-inflammatoires IL-4, IL-10 et du facteur neurotrophique BDNF dans une certaine mesure, tout en augmentant les niveaux d'expression des cytokines pro-inflammatoires IL-1 β, TNF - α, et IL-6 dans une certaine mesure. Lin Jianan et al. ont rapporté que le ginsénoside CK inhibe l'inflammation médiée par la microglie par le biais de la voie de signalisation PI3K/AKT. Ces résultats suggèrent que la voie de signalisation PI3K/Akt peut être impliquée dans la régulation de la neuroinflammation médiée par la microglie, et son rôle dans l'inflammation hippocampique médiée par l'AAS VI chez les souris privées de sommeil doit faire l'objet d'une étude plus approfondie.
La neurogenèse de l'hippocampe adulte joue un rôle important dans la plasticité cérébrale et le maintien du réseau neuronal, et ses troubles fonctionnels peuvent entraîner diverses maladies humaines, notamment la dépression, l'anxiété, les troubles cognitifs et les maladies neurodégénératives. Lorsqu'une inflammation se produit dans le cerveau, les principales cellules neuro-immunes du cerveau - la microglie - sont suractivées, libérant des médiateurs inflammatoires et des molécules neurotoxiques qui inhibent de manière significative les niveaux de neurogenèse dans l'hippocampe adulte, entraînant un risque accru de troubles émotionnels et de dysfonctionnement cognitif. Les neurones nouvellement formés dans l'hippocampe des rongeurs proviennent principalement de la zone subgranulaire (SGZ) du gyrus denté, qui joue un rôle important dans la formation et la consolidation de la mémoire. Des recherches ont montré que les molécules neuroinflammatoires libérées par la microglie peuvent affecter la neurogenèse dans l'hippocampe adulte en inhibant la voie de signalisation PI3K/Akt. Cette étude a montré que la voie de signalisation PI3K/Akt et le nombre de nouveaux neurones dans l'hippocampe de souris privées de sommeil étaient significativement inhibés. L'intervention de l'AAS VI a activé la voie de signalisation PI3K/Akt dans l'hippocampe des souris privées de sommeil et a favorisé la neurogenèse dans l'hippocampe adulte. Après blocage de la voie de signalisation PI3K/Akt par le LY294002, le nombre de neurones nouvellement générés dans l'hippocampe a diminué de manière significative, et l'effet d'amélioration de l'AAS VI sur la fonction cognitive des souris privées de sommeil a été aboli par le LY294002. Liu et al. ont rapporté que l'AAS VI peut promouvoir la prolifération et la survie des cellules souches neurales en activant la voie PI3K/AKT, et promouvoir leur différenciation en neurones, protégeant les cellules souches neurales des effets de la neuroinflammation, améliorant ainsi la neurogenèse hippocampique, le comportement de dépression, le comportement d'anxiété et le dysfonctionnement cognitif chez les souris modèles de neuroinflammation chronique. Ces résultats indiquent que l'effet d'amélioration de l'AAS VI sur la fonction cognitive chez les souris privées de sommeil dépend de la voie neurogénique médiée par la signalisation PI3K/Akt.
En résumé, cette étude a montré que l'AAS VI favorise la neurogenèse dans l'hippocampe adulte en régulant le phénotype de la microglie dans l'hippocampe, en augmentant l'expression du BDNF et en activant la voie de signalisation PI3K/Akt, améliorant ainsi la fonction cognitive chez les souris privées de sommeil. L'ASA VI a des perspectives de développement en tant que médicament anti-inflammatoire et neuroprotecteur.
