Quelle est la différence entre l'alpha-amylase, la bêta-amylase et l'amylase glycosylée ?
Selon le rôle de l'α-amylase, de la β-amylase et du diagramme de l'amylase de saccharification, il est facile de laisser une personne penser à tort que le rôle des trois substrats doit être l'amidon, la dextrine et le maltose, respectivement, et il y a des chaussures d'enfants qui m'ont demandé une fois que l'amylase de saccharification n'est pas l'enzyme du maltose. Par conséquent, je ressens le besoin de faire une petite analyse du rôle des trois.
Pour comprendre le rôle de plusieurs types d'amylases, il faut d'abord identifier deux groupes de concepts : l'amidon à chaîne droite et l'amidon à chaîne ramifiée, la liaison α-1,4-glycosidique et la liaison α-1,6-glycosidique.
Il existe deux types d'amidon : l'amidon à chaîne droite et l'amidon à chaîne ramifiée. L'amylopectine à chaîne droite est une structure hélicoïdale non ramifiée, composée de résidus de glucose liés uniquement par des liaisons α-1,4-glycosidiques ; l'amylopectine à chaîne ramifiée est formée de résidus de glucose liés par des liaisons α-1,4-glycosidiques dans chaque chaîne, mais des liaisons α-1,6-glycosidiques sont présentes aux points de ramification. L'α-Amylase et son action
L'α- Amylase, également connue sous le nom d'endo amylase, est une métallohydrolase qui nécessite des ions calcium, qui se lient à la protéine de l'enzyme pour présenter une activité, qui peut être perdue par traitement avec l'agent chélateur EDTA.L'α- Amylase est une amylase stœchiométrique qui est capable de randomiser son activité.
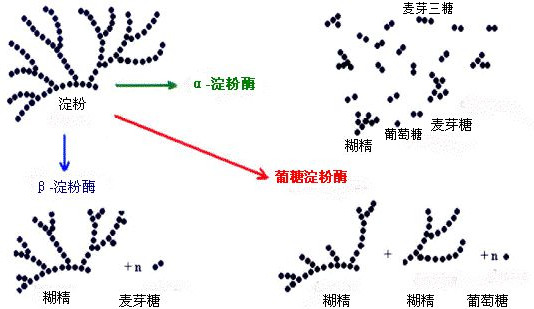
α- L'amylase peut hydrolyser au hasard la liaison α-1,4-glycosidique dans l'amidon, mais ne peut pas hydrolyser la liaison α-1,6-glycosidique.
Si le substrat est un amidon à chaîne droite, l'hydrolyse produit du glucose, du maltose et du maltotriose ; si le substrat agissant est un amidon à chaîne ramifiée, les produits de l'hydrolyse sont le glucose, le maltose, le maltotriose et l'α-dextrine contenant des liaisons α-1,6-glycosidiques contenant plus de trois résidus de glucose. Il convient également de noter que les α et β de l'α-amylase et de la β-amylase n'indiquent aucune relation de conformation, mais sont simplement numérotés.
Il existe de nombreuses façons de produire l'α-amylase dans la nature, la fermentation microbienne étant l'une des plus courantes. En outre, cette enzyme peut également être extraite de plantes ou d'animaux, et les propriétés de l'amylase obtenue de différentes manières sont différentes. Dans le processus de production industrielle, en raison de la forte demande d'α-amylase, celle-ci est généralement produite par la fermentation de champignons et de bactéries. Bacillus subtilis, Bacillus sphaericus, Streptomyces suis, etc. peuvent produire de l'α-amylase. La β-amylase et son rôle
La β-amylase, également connue sous le nom d'exo amylase, est une hydrolase contenant des groupes sulfhydryles. L'enzyme part de l'extrémité non réductrice de l'amidon et hydrolyse la liaison α-1,4-glycosidique séquentiellement avec deux résidus de glucose pour produire du maltose. Elle ne peut pas hydrolyser la liaison α-1,6-glycosidique, ni franchir le point de ramification et se retrouver avec une dextrine très longue, c'est-à-dire la β-dextrine.
Par conséquent, lorsque la β-amylase agit sur des amidons à chaîne droite, elle produit presque exclusivement du maltose ; lorsqu'elle est utilisée sur des amidons à chaîne ramifiée, les produits sont le maltose et la β-dextrine.
Enzyme R et son action
Les enzymes R, également appelées enzymes de débranchement, agissent sur la liaison α-1,6-glycosidique. En présence d'enzymes de débranchement, la liaison α-1,6-glycosidique des espèces α-dextrine et β-dextrine est hydrolysée et les chaînes ramifiées sont éliminées.
Les chaînes droites restantes sont ensuite hydrolysées par l'α-amylase et la β-amylase pour produire du maltose et du glucose. Cependant, les R-amylases ne peuvent pas hydrolyser directement les liaisons α-1,6-glycosidiques dans les amidons ramifiés.
L'amylase glycosylante et son action
L'amylase glycosylante, ou glucoamylase, est une enzyme qui hydrolyse l'amidon en glucose, le pourcentage d'hydrolyse pouvant atteindre 100%. Elle est souvent utilisée comme agent de saccharification de l'amidon.
La glucoamylase n'est pas très spécifique et s'applique à de nombreuses substances. Elle peut non seulement couper la liaison α-1,4- glycosidique de l'extrémité non réductrice de la molécule d'amidon, mais aussi la liaison α-1,6-glycosidique, mais l'hydrolyse de la liaison α-1,4-glycosidique est un peu plus rapide. Elle peut également hydrolyser la dextrine, le maltose et le glycogène. L'hydrolyse est initiée à partir de l'extrémité de la molécule de substrat et est une exonucléase.
Les résultats de l'action de l'α-amylase, de la β-amylase et de l'amylase glycolytique sur l'amidon ramifié peuvent être représentés dans le diagramme suivant :