Étude de l'effet thérapeutique et du mécanisme du glycoside phényléthanoïde de Cistanche deserticola sur des rats modèles de maladie chronique de haute altitude
La maladie de haute altitude est un terme général désignant diverses manifestations cliniques causées par l'incapacité de l'organisme à s'adapter à l'hypoxie à basse pression en haute altitude, ce qui entraîne une série de changements pathologiques et physiologiques dans l'organisme. Cette maladie est généralement divisée en deux catégories : aiguë et chronique. Le mal chronique des montagnes (MCM) désigne un état dans lequel les symptômes initiaux du mal aigu des montagnes persistent ou se manifestent plus de six mois après l'arrivée à haute altitude. Les chercheurs ont découvert que les gènes Egl9 homologué 1 (EGLN1) et PPAR-α (Peroxisome proliferator activated receptor alpha) de la population tibétaine sont différents de ceux des régions de basse altitude et peuvent inhiber l'hémoglobine dans le sang tibétain, en la maintenant à une faible concentration. C'est aussi en partie la raison pour laquelle les Tibétains peuvent survivre à haute altitude. Cette étude suggère que les deux gènes mentionnés ci-dessus sont des gènes candidats dans la voie de réponse à l'hypoxie, exerçant finalement leurs effets par la voie du facteur 1 alpha inductible à l'hypoxie (HIF-1 alpha). EGLN1 est le gène en amont de HIF-1 α, tandis que PPAR-α est la cible en aval de HIF-1 α.
Une faible teneur en oxygène peut bloquer l'hydroxylation et l'acétylation de HIF-1 α, augmenter sa stabilité et induire la transmission d'informations sur la transcription des gènes en régulant la transcription et l'expression des gènes en aval tels que le facteur de croissance de l'endothélium vasculaire (VEGF), l'endothéline-1 (ET-1), etc. Contrairement à l'action de l'ET-1, l'oxyde nitrique (NO) est une molécule de signalisation gazeuse qui catalyse la production de L-arginine par l'oxyde nitrique synthase (NOS) et a un large éventail d'effets.
Cette étude a utilisé une cabine expérimentale artificielle dans un environnement spécial au nord-ouest pour simuler l'environnement à faible teneur en oxygène du plateau. En tenant compte des principales différences entre le plateau et les plaines, un modèle animal de maladie de haute altitude a été établi pour étudier le rôle et la relation intrinsèque de la voie HIF-1 α dans la pathogenèse de la maladie de haute altitude. Sur cette base, les effets préventifs et thérapeutiques des glycosides phényléthanoïdes de Cistanche (PhGCs) sur la maladie de haute altitude et leurs mécanismes ont été observés, fournissant une base théorique pour l'étude de la pathogenèse de la maladie de haute altitude et le développement de nouveaux médicaments contre la maladie de haute altitude.

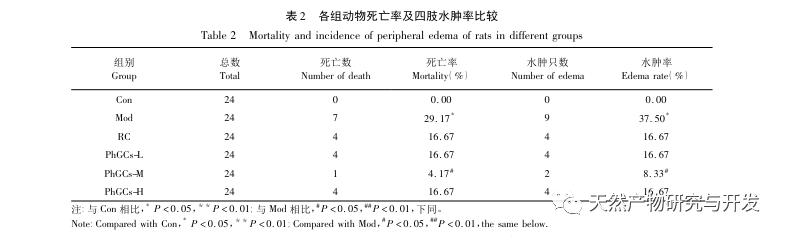
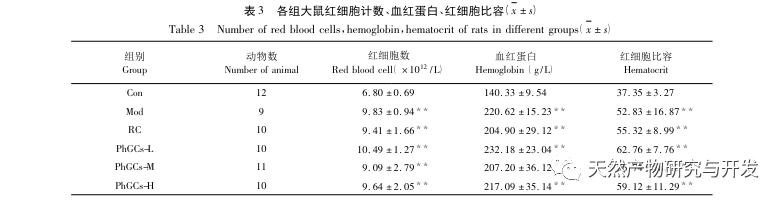


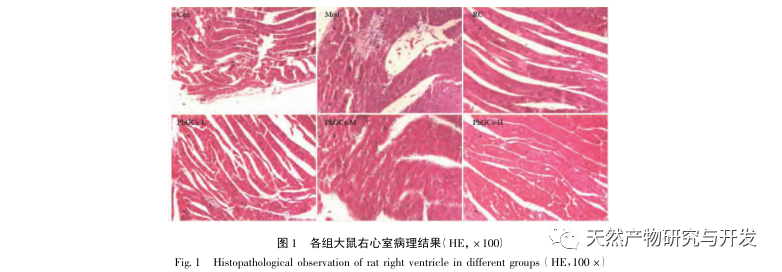


 Les PhGC ont été extraits de la Cistanche deserticola dans le sud du Xinjiang, et divers glycosides phényléthanoliques ont été isolés avec succès grâce à des recherches connexes, notamment l'échinacoside, le verbascoside, l'isoverbascoside, le 2'- acétyl verbascoside, le glycoside A de la Cistanche deserticola et le salidroside. Depuis de nombreuses années, des recherches approfondies ont été menées sur les effets pharmacologiques des PhGC, tels que les effets antioxydants, les effets de piégeage des radicaux libres et les effets antivieillissement. Dans cette expérience, le groupe PhGCs-M a pu réduire de manière significative l'indice d'hypertrophie du ventricule droit chez les rats, ce qui indique que l'acide phényléthanolique de Cistanche deserticola peut améliorer l'hémodynamique et le degré d'hypertrophie du ventricule droit chez les rats CMS, et qu'il a un certain effet thérapeutique sur la CMS. Cette étude suppose, à partir des indicateurs liés à la saturation en oxygène du sang, que les PhGCs augmentent la saturation en oxygène du sang, réduisent les dommages causés par l'hypoxie à l'organisme et augmentent la tolérance de l'organisme aux dommages causés par l'hypoxie, à nombre de globules rouges et teneur en hémoglobine égaux, atteignant ainsi l'objectif du traitement du mal d'altitude. Après traitement par les PhGC, le taux de mortalité et l'incidence de l'œdème des membres chez les rats CMS ont diminué de manière significative, démontrant ainsi son efficacité dans le traitement du CMS.
Les PhGC ont été extraits de la Cistanche deserticola dans le sud du Xinjiang, et divers glycosides phényléthanoliques ont été isolés avec succès grâce à des recherches connexes, notamment l'échinacoside, le verbascoside, l'isoverbascoside, le 2'- acétyl verbascoside, le glycoside A de la Cistanche deserticola et le salidroside. Depuis de nombreuses années, des recherches approfondies ont été menées sur les effets pharmacologiques des PhGC, tels que les effets antioxydants, les effets de piégeage des radicaux libres et les effets antivieillissement. Dans cette expérience, le groupe PhGCs-M a pu réduire de manière significative l'indice d'hypertrophie du ventricule droit chez les rats, ce qui indique que l'acide phényléthanolique de Cistanche deserticola peut améliorer l'hémodynamique et le degré d'hypertrophie du ventricule droit chez les rats CMS, et qu'il a un certain effet thérapeutique sur la CMS. Cette étude suppose, à partir des indicateurs liés à la saturation en oxygène du sang, que les PhGCs augmentent la saturation en oxygène du sang, réduisent les dommages causés par l'hypoxie à l'organisme et augmentent la tolérance de l'organisme aux dommages causés par l'hypoxie, à nombre de globules rouges et teneur en hémoglobine égaux, atteignant ainsi l'objectif du traitement du mal d'altitude. Après traitement par les PhGC, le taux de mortalité et l'incidence de l'œdème des membres chez les rats CMS ont diminué de manière significative, démontrant ainsi son efficacité dans le traitement du CMS.
Le NO, en tant que vasodilatateur dépendant de l'endothélium, joue un rôle important dans la vasodilatation endothéliale car il détend directement le muscle lisse vasculaire pulmonaire, ce qui entraîne une vasodilatation pulmonaire significative. Il a également la capacité d'inhiber la prolifération et la migration des cellules musculaires lisses vasculaires pulmonaires, de supprimer l'agrégation plaquettaire et joue un rôle important dans le maintien de la stabilité de la circulation pulmonaire. Cette étude a montré que la teneur en NO de l'homogénat de tissu pulmonaire de Mod diminuait, ainsi que les activités de la T-NOS, de la iNOS et de la eNOS. Les PhGCs peuvent augmenter la teneur en NO dans le tissu pulmonaire en renforçant les activités de la TNOS, de l'iNOS et de l'eNOS, jouant ainsi un rôle dans la lutte contre la prolifération et la myométrie du muscle lisse de l'artère pulmonaire et dans le traitement de la SMC.
L'ET-1 est le vasoconstricteur le plus puissant découvert à ce jour, et l'hypoxie peut augmenter de manière significative le niveau d'ET-1 dans le sang. Rajput et al. ont comparé les différences d'allèles de l'ET-1 entre les résidents de haute altitude et les résidents de plaine et ont constaté que certains allèles de l'ET-1 étaient surexprimés chez les résidents de haute altitude, et que l'expression de l'allèle ET-l était significativement corrélée avec les niveaux d'ET-1 dans le plasma. Dans cet article, la teneur en ET-1 dans le tissu pulmonaire des rats Mod a augmenté de manière significative, ce qui indique que l'hypoxie induit une sécrétion accrue d'ET-1 dans le tissu pulmonaire, ce qui est cohérent avec d'autres études. L'administration de PhGCs peut diminuer la teneur en ET-1 dans le tissu pulmonaire des rats CMS, ce qui indique que les PhGCs peuvent inhiber la constriction vasculaire induite par l'ET-1, réduire la pression artérielle pulmonaire et exercer des effets thérapeutiques sur le CMS.
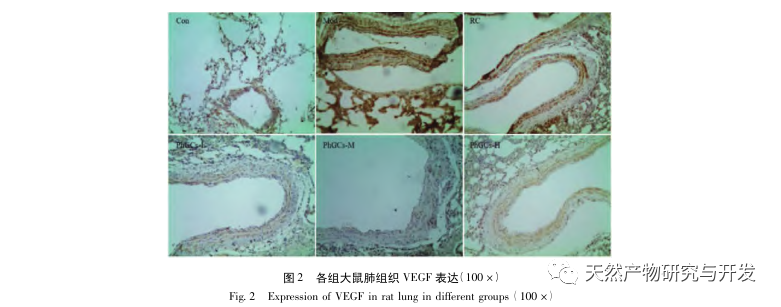
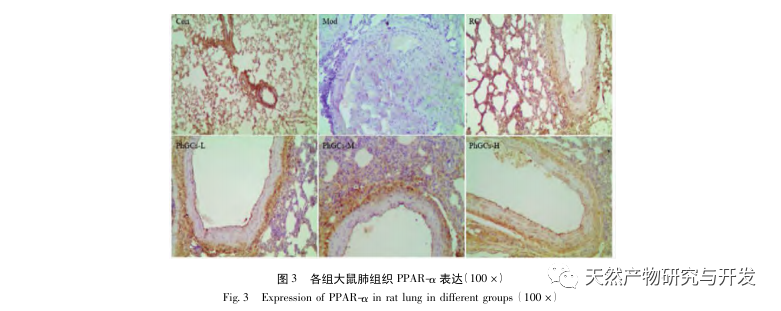
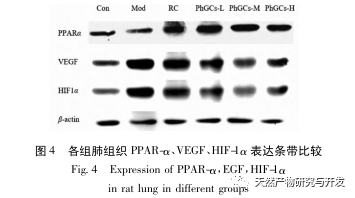
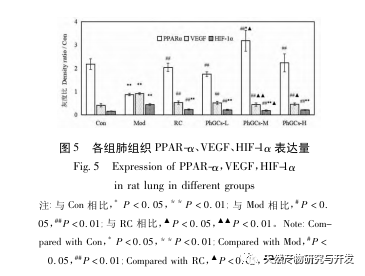
Par la suite, nous nous sommes concentrés sur l'observation des effets des PhGC sur HIF-1 α, VEGF et PPAR - α dans la voie induite par l'hypoxie. L'expression de l'ARNm et des protéines dans les tissus pulmonaires des rats de chaque groupe a été détectée par immunohistochimie, PCR quantitative en fluorescence et Western blot. Les résultats immunohistochimiques ont montré que le niveau d'expression du VEGF dans les artères pulmonaires des rats Mod était plus élevé que celui des rats Con, tandis que le niveau d'expression du PPAR-α était plus faible que celui des rats Con. Les niveaux d'expression du VEGF dans les artères pulmonaires des groupes PhGCs low, medium, PhGCs-H et RC étaient inférieurs à ceux de Mod, tandis que le niveau d'expression de PPAR - α augmentait. Cela indique que les PhGCs et la Rhodiola rosea peuvent inhiber l'expression du VEGF induite par l'hypoxie, promouvoir l'expression du PPAR-α et atténuer la prolifération vasculaire pulmonaire et la myogenèse, jouant ainsi un rôle thérapeutique dans la SMC. En mesurant expérimentalement l'expression de la protéine HIF-1 α et de l'ARNm dans le tissu pulmonaire, on a constaté que l'expression de la protéine HIF-1 α dans le tissu pulmonaire des rats modèles de la SMC augmentait de manière significative, tandis que l'expression de l'ARNm et de la Con ne montrait aucune différence. Ceci est cohérent avec les résultats des recherches pertinentes montrant que l'hypoxie régule principalement l'expression de la protéine HIF-1 α. Les PhGCs peuvent réduire de manière significative les niveaux d'expression de la protéine HIF-1 α et de l'ARNm, ce qui indique qu'ils peuvent avoir un impact sur la transcription et la traduction de HIF-1 α. Cependant, Rhodiola rosea n'a pas eu d'effet significatif sur l'expression de l'ARNm de HIF-1 α, ce qui indique qu'il affecte principalement l'expression de la protéine comme l'hypoxie.
Globalement, parmi les trois doses de PhGCs, le groupe PhGCs-M a montré le meilleur effet sur la CMS, tandis que le traitement PhGCs-H n'a pas montré d'amélioration significative, ce qui peut être lié à la diminution du taux d'absorption intestinale du PhGCs-H. Comparé à la Rhodiola rosea, le PhGCs-M a un meilleur effet thérapeutique sur les indicateurs HIF-1 α mRNA et VEGF mRNA. Associés aux avantages des ressources, les PhGCs ont des perspectives de développement certaines.
