Les extraits de plantes sont largement utilisés dans les produits pharmaceutiques, les aliments, les cosmétiques, les additifs, les produits de soins de santé et d'autres domaines, et les entreprises de transformation doivent donc gérer la qualification de licence correspondante en fonction de son utilisation, de la gestion de l'industrie ou des réglementations nationales, etc :
1, en tant que matières premières pour les médicaments ;
2. Les produits transformés en tant qu'aliments doivent faire l'objet d'une demande de licence de production alimentaire (SC), catégories d'aliments : boissons solides, aliments diététiques, additifs alimentaires ;
3, utilisés comme additifs pour l'alimentation animale, doivent demander une licence de production d'additifs pour l'alimentation animale ;
4, les ventes à l'exportation de produits, les entreprises de production à l'exportation doivent être classées.
Deuxièmement, il existe plus de 30 certifications volontaires dans l'industrie des extraits de plantes, y compris la certification de système (ISO), la certification de produit (Kosher, HALAL, etc.), la certification de spécification de production (GMP), la certification biologique (China Organic Certification) et la certification de laboratoire (CNAS, CMA).
Voici une description des licences requises pour les extraits de plantes utilisés dans les produits pharmaceutiques, les denrées alimentaires, les cosmétiques, les produits de santé et d'autres domaines.
En tant qu'extraits de la médecine chinoise
L'organe principal de l'enregistrement des extraits de médicaments chinois est le fabricant d'extraits, qui doit obtenir la licence de fabrication de médicaments contenant le champ de production des extraits de médicaments chinois, se conformer aux exigences des BPF et fournir les produits d'extraction au fabricant de pCm.
Les informations relatives au dépôt du fabricant d'extraits de médicaments chinois comprennent
1. Informations de base sur l'entreprise et informations techniques sur l'extrait ;
2, "Licence de production de médicaments", "Licence d'exploitation" et autres documents justificatifs ;
3. Production d'extraits de plantes médicinales chinoises, informations sur les comprimés de plantes médicinales chinoises, y compris l'origine, la base, la source, la mise en œuvre de l'extrait de plantes médicinales chinoises.
Normes, spécifications des préparations et rapports d'audit sur les qualifications des fournisseurs et le système d'assurance qualité de la production ;
4、Détailler le processus de production des extraits, y compris la feuille de route du processus, les paramètres clés, les principaux équipements, etc ;
5, normes de qualité de contrôle interne des extraits ou normes pharmaceutiques nationales des extraits.
Le 29 juillet 2014, le Bureau d'État a publié le Food and Drug Administration Pharmaceutical and Chemical Supervision [2014] No. 135 "Notice of the Food and Drug Administration on Strengthening the Supervision and Management of Extracts and Extracts in the Production of Traditional Chinese Medicines", qui exige que "les extraits de médicaments chinois répertoriés sous la prescription de la norme nationale de médicaments pour les pCms et avec une norme nationale de médicaments distincte doivent être mis en œuvre pour la gestion des enregistrements". "Le succès des entreprises d'extraits de plantes doit être conforme aux exigences des BPF pour organiser la production, garantir la qualité des produits et assurer la supervision quotidienne par l'administration provinciale (régions autonomes et municipalités) chargée de l'alimentation et des médicaments.
Conformément aux exigences de la communication, 47 extraits de médicaments chinois peuvent être soumis à la gestion, c'est-à-dire que l'entreprise peut produire ses propres extraits, qu'elle peut également les acheter et que les autres doivent être extraits par l'entreprise elle-même.
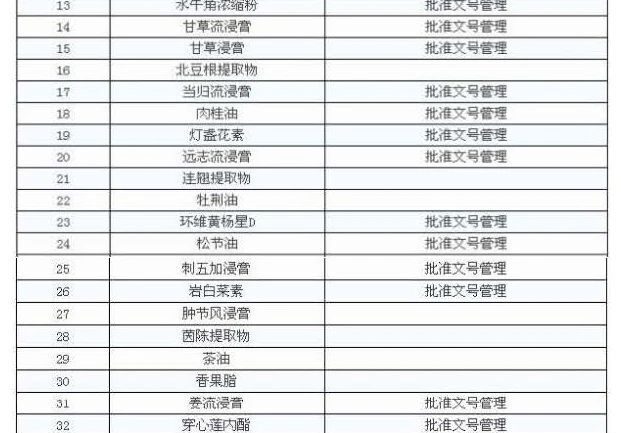
Comme matières premières pour la préparation d'institutions médicales
Les établissements médicaux qui préparent des préparations doivent être titulaires d'une "licence de pratique d'établissement médical" et, conformément à la "norme de gestion de la qualité de la préparation de l'établissement médical", obtenir une "licence de préparation de l'établissement médical".
Les mesures administratives relatives à l'enregistrement des préparations pour les institutions médicales (pour la mise en œuvre des essais) stipulent que les institutions médicales qui demandent des préparations doivent réaliser les études précliniques correspondantes, y compris l'examen des prescriptions, le processus de préparation, les indicateurs de qualité, la pharmacologie, les études toxicologiques, etc. Les médicaments chinois à base de plantes utilisés dans la demande de préparation doivent être autorisés à exercer dans des établissements médicaux. Les médicaments chinois à base de plantes et les comprimés de médecine traditionnelle chinoise utilisés dans la demande de préparation doivent avoir un numéro d'approbation de médicament et respecter les normes légales en matière de médicaments. La méthode spécifie également que l'une des circonstances suivantes ne doit pas être déclarée comme préparation pour les institutions médicales :
1, le marché a été approvisionné en variétés ;
2、Variétés contenant des ingrédients actifs non approuvés par l'administration nationale des denrées alimentaires et des médicaments ;
3, en plus des allergènes et des produits biologiques ;
4. Injection de médicaments chinois ;
5, Médecine chinoise, composition chimique de la préparation du composé ;
6, les stupéfiants, les psychotropes, les médicaments toxiques à usage médical, les médicaments radioactifs.
L'annonce sur la mise en œuvre de la gestion des dossiers sur l'application des techniques traditionnelles pour la préparation des préparations médicinales chinoises par les institutions médicales stipule que les préparations médicinales chinoises traditionnelles comprennent :
1, les formes pharmaceutiques traditionnelles solides (pilules, dispersions, dans, lingots, etc.), semi-solides (pommade, pâte, etc.) et liquides (toniques, etc.) fabriquées à partir de plantes médicinales chinoises par pulvérisation ou uniquement par extraction à l'eau ou à l'huile ;
2, les granulés fabriqués à partir d'herbes médicinales chinoises extraites avec de l'eau et les gélules fabriquées à partir d'herbes médicinales chinoises broyées ;
3, liqueurs et teintures à base de plantes médicinales chinoises extraites selon des méthodes traditionnelles.
Les préparations de médecine traditionnelle chinoise déposées par l'établissement médical doivent être conformes au champ d'application du diagnostic et du traitement défini dans son "autorisation d'exercer dans un établissement médical". Les préparations ne doivent pas être déposées dans l'une des circonstances suivantes :
1, "Préparations pour les mesures de gestion de l'enregistrement des établissements médicaux (pour une mise en œuvre à titre expérimental)" dans les dispositions des circonstances ne doivent pas être déclarées comme des préparations pour les établissements médicaux ;
2, et le marché a été approvisionné avec des variétés de formes de dosage différentes pour la même prescription ;
3, particules de formule de médecine chinoise ;
En résumé, les matières premières des préparations des institutions médicales doivent être des médicaments à base de plantes chinoises ou des comprimés de médicaments chinois, et non des extraits de médicaments chinois, et les institutions médicales ne peuvent acheter que des préparations maison qui ont été approuvées pour l'enregistrement des matières premières.
Matières premières pour les aliments diététiques
Les mesures relatives à l'administration de l'enregistrement et du classement des aliments de santé promulguées en 2015 stipulent clairement que la CFDA interdit le traitement commissionné des extraits de médecine chinoise, et le classement des extraits de plantes est devenu une nouvelle tendance dans le développement de l'industrie.
À la fin de l'année 2016, la CFDA a publié les Review Rules for Health Food Production License (règles de révision pour les licences de production d'aliments de santé), qui normalisent davantage les règles spécifiques relatives à l'inclusion d'extraits de plantes dans la production d'aliments de santé. Les demandeurs qui fournissent des extraits de plantes et d'animaux à d'autres entreprises en tant que matières premières pour la production d'aliments de santé doivent demander des licences de production d'extraits de matières premières conformément aux exigences de ces règles ; ceux qui sont uniquement engagés dans l'extraction de matières premières pour les aliments de santé produits par l'entreprise demandent des licences de production de produits alimentaires de santé, et n'ont pas besoin de demander des licences de production d'extraits de matières premières séparément. Cela signifie que si l'entreprise produit ses propres denrées alimentaires, elle peut extraire elle-même les plantes et les animaux. La licence de production d'extraits de matières premières pour aliments diététiques doit être indiquée dans les détails de l'espèce du nom du projet de l'extrait de matières premières, et dans la colonne Remarques, le nom de l'aliment diététique, le numéro d'enregistrement ou le numéro d'enregistrement et d'autres informations.
Les candidats à l'obtention d'une licence de production d'extraits de matières premières pour aliments diététiques doivent présenter les documents d'enregistrement ou le certificat de dépôt relatifs aux aliments diététiques, ainsi que les documents d'enregistrement ou les certificats de dépôt relatifs au processus de production et aux normes de qualité des extraits de matières premières.
Le catalogue des ingrédients des aliments diététiques, qui fait référence à l'évaluation de la sécurité et de la fonctionnalité, peut être utilisé pour les substances des aliments diététiques et leur liste correspondante d'informations pertinentes. Toute unité ou individu peut, sur la base de recherches pertinentes, proposer au Centre d'évaluation des aliments de santé de l'Administration nationale des aliments et des médicaments les matières premières à inclure dans le catalogue des ingrédients des aliments de santé.
Les matières premières dont l'inclusion dans le catalogue des ingrédients des aliments diététiques est demandée doivent répondre aux exigences suivantes :
1, avec un large éventail de produits alimentaires nationaux et étrangers et des preuves scientifiques suffisantes ;
2, avec une gamme de dosage claire et des fonctions de soins de santé correspondantes, conformément aux exigences du catalogue des fonctions de soins de santé ;
3. Qualité et exigences techniques stables et contrôlables ;
4、Il repose sur une base scientifique qui répond aux exigences de sécurité et d'efficacité ;
5, avec une efficacité scientifiquement applicable, stable et fiable des ingrédients ou des ingrédients de signature, une gamme de contenus et des méthodes d'essai ;
6, conformément à la posologie et au mode de consommation prescrits, sûrs et inoffensifs pour la population concernée.

En tant qu'ingrédient alimentaire
Selon la loi sur la sécurité alimentaire, "on entend par aliments toutes sortes de produits finis et de matières premières destinés à la consommation humaine ou à la boisson, ainsi que les articles qui sont à la fois des aliments et des médicaments selon la tradition, mais non les articles destinés à des fins thérapeutiques". Il ne fait aucun doute que les extraits de plantes destinés à l'alimentation sont des denrées alimentaires et qu'ils doivent faire l'objet d'une autorisation conformément aux exigences de la loi sur la sécurité alimentaire. Les extraits de plantes utilisés pour la transformation des aliments doivent être extraits de matières premières sélectionnées dans le catalogue des aliments médicinaux et alimentaires ou des nouvelles ressources alimentaires.
Les substances qui sont à la fois des aliments et des médicaments sont les parties utilisables des animaux et des plantes qui ont des habitudes alimentaires traditionnelles et qui sont répertoriées dans la norme nationale des médicaments chinois à base de plantes. Les substances incluses dans le catalogue des matières premières pour les aliments et les médicaments doivent répondre simultanément aux exigences suivantes :
1. Conformément à la loi sur la sécurité alimentaire et aux réglementations pertinentes ;
2, dans le canon de la médecine chinoise, il y a des informations sur les produits comestibles, mais aucune information sur la toxicité n'a été trouvée ;
3, dans le cadre des habitudes de consommation traditionnelles, il n'a pas été constaté que la consommation normale pouvait avoir des effets aigus ou subaigus sur la santé humaine,
chroniques ou d'autres dommages potentiels pour la santé humaine, en accord avec les besoins nutritionnels devraient avoir ;
4, conformément à la législation et à la réglementation applicables à la protection des ressources médicinales chinoises ;
5, a été incluse dans les normes nationales relatives aux médicaments chinois à base de plantes.
Les nouvelles ressources alimentaires comprennent
Animaux, plantes et micro-organismes qui ne sont pas habituellement consommés en Chine ;
2, à partir d'animaux, de plantes et de micro-organismes séparés des matières premières alimentaires qui ne sont pas habituellement consommées en Chine ;
3, les nouvelles variétés de micro-organismes utilisées dans la transformation des aliments ;
4, en raison de l'utilisation de nouveaux procédés de production entraînant une modification de la composition ou de la structure d'origine des ingrédients alimentaires.
La production et la gestion ou l'utilisation de nouvelles ressources pour les unités alimentaires ou les individus, dans le produit pour la première fois sur le marché, doivent être signalées au ministère de la santé pour examen et approbation. Soumettre les documents suivants :
1, nouvelles ressources pour l'hygiène alimentaire et formulaire de demande de licence administrative ;
2, des rapports de développement et des rapports de recherche sur la sécurité ;
3, une brève description du processus de production et un organigramme ;
4. Normes de qualité des produits ;
5, la recherche et l'utilisation au niveau national et à l'étranger et les informations relatives à la sécurité ;
6, les étiquettes des produits et les instructions ;
7, d'autres informations pour faciliter l'évaluation.
Si l'entreprise choisit d'autres plantes ou leurs extraits en dehors du catalogue des aliments médicinaux et des nouvelles ressources alimentaires comme matières premières pour la transformation alimentaire, il existe trois solutions conventionnelles :
1, les grandes entreprises évitent le risque de déclarer de nouvelles ressources alimentaires ;
2, peut également être transformé en aliments en tant que matières premières, la préparation des normes d'entreprise, par le biais de l'enregistrement et l'obtention de la certification SC, au moins le gouvernement local reconnu, mais d'autres domaines de risque de vente, (par exemple : Hainan Ganoderma Lucidum event).
3. Il est également possible d'écrire à la commission provinciale de la santé pour voir si l'on peut utiliser le comportement du gouvernement vis-à-vis de la commission nationale de la santé (ce qui nécessite un réseau solide).
(A) les nouveaux ingrédients alimentaires, la définition et la gestion des aliments ordinaires
Les nouvelles matières premières alimentaires se réfèrent aux éléments suivants qui n'ont pas d'habitudes alimentaires traditionnelles en Chine : animaux, plantes et micro-organismes ; composants isolés d'animaux, de plantes et de micro-organismes ; composants alimentaires dont la structure originale a été modifiée ; et autres matières premières alimentaires nouvellement développées. Les articles appartenant à l'une des catégories susmentionnées, s'ils doivent être développés pour la production et l'exploitation d'aliments ordinaires, doivent être déclarés pour approbation conformément aux dispositions des "Mesures administratives pour l'examen de la sécurité des nouveaux ingrédients alimentaires".
Pour les produits alimentaires ayant des habitudes alimentaires traditionnelles, conformément aux mesures administratives relatives à l'examen de la sécurité des nouveaux ingrédients alimentaires, la production et l'exploitation des entreprises peuvent être combinées avec les mesures et mises en œuvre conformément aux dispositions de la loi sur la sécurité alimentaire.
En 2002, l'ancien ministère de la santé a publié un avis sur la normalisation de la gestion des matières premières alimentaires, annonçant que les produits figurant sur la liste des produits qui sont à la fois des aliments et des médicaments peuvent être utilisés pour la production d'aliments ordinaires, et que les souches figurant sur la liste des souches qui peuvent être utilisées pour l'alimentation ont été annoncées en 2010 et qu'elles peuvent être utilisées pour la production d'aliments ordinaires.
En 1998, l'ancien ministère de la santé a publié la circulaire sur l'organisation des travaux de rectification du marché national des aliments de santé en 1998, qui répertoriait les nouvelles ressources alimentaires que sont le pollen de colza, le pollen de maïs, le pollen de pin, le pollen de tournesol, le pollen de Zizyphus, le pollen de sarrasin, le pollen de sésame, le pollen de sorgho, le konjac, la spiruline obtususifoliae, la spiruline viridulae, la figue de Barbarie, l'aubergine rose, la chrysalide de ver à soie, comme des produits alimentaires ordinaires.
(ii) Définition et gestion des matières premières alimentaires courantes et des aliments diététiques
En 2002, l'ancien ministère de la santé a publié un avis sur la normalisation de la gestion des matières premières des aliments de santé, ainsi que la liste des produits pouvant être utilisés dans les aliments de santé et la liste des produits interdits dans les aliments de santé. Veuillez vous référer à la circulaire pour connaître les réglementations spécifiques relatives à la gestion des ingrédients des aliments diététiques.
Les articles énumérés dans la liste des articles pouvant être utilisés dans les aliments de santé, publiée par l'ancien ministère de la santé en 2002, ne peuvent être utilisés que dans les aliments de santé. À l'exception des articles pouvant être utilisés dans l'alimentation générale, les articles figurant sur la liste des articles utilisables dans les aliments de santé ne peuvent être produits et exploités en tant que matières premières pour l'alimentation générale. S'il est nécessaire de développer les articles de la liste des articles utilisables dans les aliments de santé pour la production d'aliments ordinaires, ils doivent être déclarés pour approbation conformément aux procédures stipulées dans les mesures pour l'administration de l'examen de la sécurité des nouvelles matières premières alimentaires.
Comme matières premières cosmétiques
Les cosmétiques à base de plantes sont classés en deux catégories : les cosmétiques à usage spécial et les cosmétiques à usage non spécial, qui nécessitent tous deux une licence de production de cosmétiques.
Les matières premières utilisées dans les cosmétiques doivent figurer dans le catalogue des matières premières cosmétiques ; les matières premières qui ne figurent pas dans le catalogue doivent être conformes aux nouvelles matières premières cosmétiques à base de plantes pour les procédures correspondantes ; les nouvelles matières premières cosmétiques à base de plantes désignent les matières premières naturelles d'origine végétale (y compris les algues) utilisées pour la première fois sur le territoire chinois pour la production de cosmétiques. Un ingrédient unique extrait de plantes ou des ingrédients hautement purifiés n'entrent pas dans cette définition.
La demande d'autorisation administrative pour les nouvelles matières premières cosmétiques à base de plantes doit être conforme aux "dispositions relatives à l'autorisation administrative de la déclaration et de l'acceptation des produits cosmétiques" et à "la déclaration et l'examen des nouvelles matières premières cosmétiques", ainsi qu'à d'autres exigences pertinentes, et doit être accompagnée d'une déclaration d'autorisation administrative. En outre, en tant que matières premières cosmétiques à usage spécial (par exemple : a été largement utilisé dans les produits anti-âge dans un certain nombre d'extraits de médecine chinoise, tels que le ginseng, l'astragale, l'acide gibbérellique, le velours de bois, le Ganoderma lucidum, l'argousier, le Poria cocos, l'Angelica sinensis, la perle, le ginkgo biloba et l'onagre, etc.) Les informations correspondantes relatives à l'évaluation de la sécurité toxicologique doivent également être soumises.
Politiques relatives aux extraits végétaux en Europe, en Amérique et dans d'autres pays
La gestion des médicaments à base de plantes aux États-Unis est relativement ancienne. Dans le Dietary Supplement Health and Education Act adopté par les États-Unis, la définition de "complément alimentaire" inclut les "herbes ou autres plantes" ainsi que "tout concentré" de celles-ci, ce qui inclut indubitablement les "herbes ou autres plantes". "Cela ne laisse aucun doute quant au statut juridique des extraits de plantes en tant que compléments alimentaires.
En Allemagne, les extraits de plantes peuvent être enregistrés en tant que médicaments sur ordonnance dans le cadre de la procédure législative. Il existe environ 60 000 types de médicaments enregistrés en Allemagne qui contiennent des ingrédients à base de plantes, dont la plupart sont des infusions, et il existe une procédure d'approbation stricte pour les médicaments traditionnels chinois s'ils veulent être utilisés comme médicaments botaniques en Allemagne. D'une manière générale, les médicaments chinois entrent en Allemagne sous la forme de produits de santé et font l'objet d'une demande de gestion des denrées alimentaires.
Dans l'Union européenne, les médicaments sont classés en huit catégories : médicaments brevetés, médicaments génériques, médicaments en vente libre, produits botaniques naturels, produits vaccinaux, produits sanguins, produits biologiques et antidépresseurs. Outre le Royaume-Uni et les Pays-Bas, l'Allemagne, la France et l'Italie réglementent tous les produits botaniques naturels en tant que médicaments sur ordonnance ou en vente libre, et l'amendement à la directive européenne sur la procédure d'enregistrement des médicaments botaniques adopté en 2003 stipule que les produits médicinaux botaniques traditionnels qui étaient à l'origine soumis aux réglementations alimentaires pertinentes le seront toujours s'ils contiennent des substances botaniques naturelles ou des extraits de plantes naturelles dans une quantité inférieure à la dose médicale. Réglementation.
L'utilisation de la médecine traditionnelle chinoise au Japon est extrêmement limitée. À l'heure actuelle, outre les 210 prescriptions approuvées, le ministère de la santé et des affaires sociales (MHLW) est exceptionnellement strict dans l'approbation de l'ajout de nouveaux médicaments chinois à base de plantes, traitant les médicaments chinois à base de plantes de la même manière que les nouveaux médicaments de composés, ce qui équivaut presque à fermer la porte, et il existe également un certain nombre de mesures restrictives dans l'approbation des médicaments chinois exclusifs importés. Toutefois, ces dernières années, le gouvernement japonais a apparemment assoupli son contrôle sur les aliments diététiques, notamment en supprimant les restrictions sur les formes de dosage et en assouplissant les restrictions sur les types de plantes naturelles qui peuvent être utilisées dans les aliments diététiques.
