Évaluation par simulation informatique des peptides inhibiteurs de la lipase pancréatique dans les protéines de sang de chameau
Ces dernières années, avec l'amélioration du niveau de vie et les changements d'habitudes alimentaires, l'hyperlipidémie (HLP) est progressivement devenue le "tueur numéro un" qui met en danger la santé humaine. Cette maladie est due à un dérèglement du métabolisme des lipides dans l'organisme. Étant donné la relation étroite entre l'absorption du cholestérol et le métabolisme des lipides, la voie d'absorption du cholestérol est devenue une cible d'intervention importante pour le traitement de l'hyperlipidémie, qui peut prévenir efficacement l'hyperlipidémie en réduisant l'absorption du cholestérol dans l'intestin. Les lipides ingérés dans l'alimentation sont d'abord hydrolysés par la lipase pancréatique, décomposés en acides gras et en monoglycérides, formant des micelles avec le cholestérol, les sels biliaires, etc. et finalement absorbés par les cellules de l'intestin. Par conséquent, l'inhibition efficace de l'activité de la lipase pancréatique (PL) peut réduire l'absorption des lipides par l'organisme, soulager l'affection à la source et prévenir les maladies. Certains médicaments disponibles sur le marché ont des effets secondaires qui peuvent gêner les patients. Il est donc urgent de développer des substances bioactives d'origine naturelle pour aider au traitement de l'hyperlipidémie.
Les peptides bioactifs sont devenus un point chaud de la recherche ces dernières années en raison de leurs sources étendues et de leur facteur de sécurité élevé. Le sang de chameau a une teneur élevée en protéines, avec une teneur totale en protéines de 6,80 g/dl et une teneur en hémoglobine de 141,11 g/l, ce qui est plus élevé que pour les autres animaux d'élevage. Il contient également une grande variété d'acides aminés, répondant aux valeurs recommandées par l'OMS/FAO/UNU, et constitue une source potentielle de peptides bioactifs de haute qualité. La recherche a montré que les hydrolysats de protéase du sang de chameau ont des effets antifatigue, antioxydants et hypotenseurs. Par conséquent, la préparation de peptides inhibiteurs de la lipase pancréatique à partir de protéines de sang de chameau présente un intérêt certain pour la recherche.
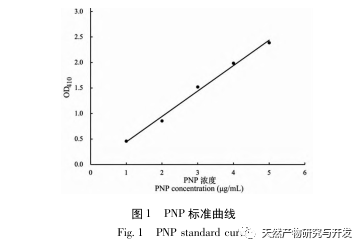
Dans cette étude, la protéase neutre a été utilisée pour hydrolyser les protéines du sang de chameau, et le taux d'inhibition de la lipase pancréatique a été utilisé comme indice d'évaluation pour optimiser le processus d'hydrolyse enzymatique. La spectrométrie de masse par désorption/ionisation laser assistée par matrice (MALDI-TOF-MS) a été utilisée pour déterminer la distribution du poids moléculaire des peptides du sang de chameau, et la chromatographie liquide-spectrométrie de masse (LC-MS) a été utilisée pour identifier et analyser les peptides du sang de chameau. PepSite2 a été utilisé pour modéliser et prédire les sites de liaison, et la simulation de dynamique moléculaire a été utilisée pour évaluer les sites de liaison et les modes d'action des peptides sélectionnés, fournissant ainsi une base pour l'identification et l'analyse des peptides du sang de chameau à l'avenir. L'étude des peptides inhibiteurs de la lipase fournit des références et de nouvelles idées pour le développement et l'utilisation du sang de chameau.
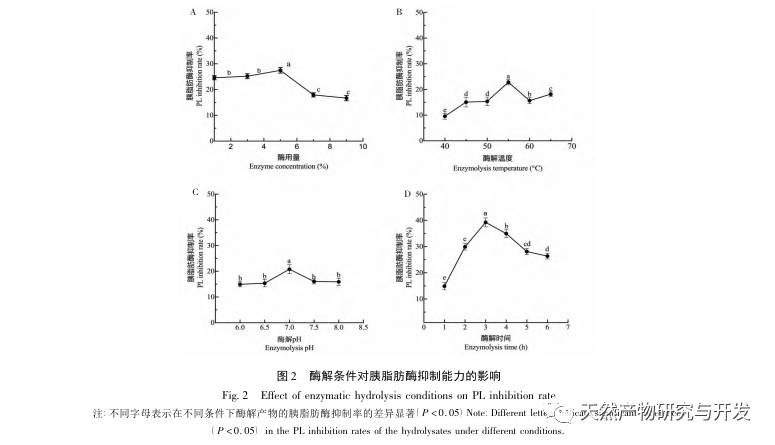
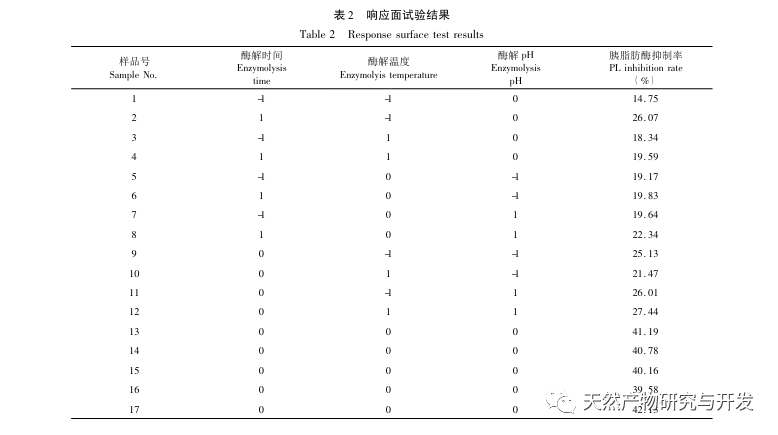
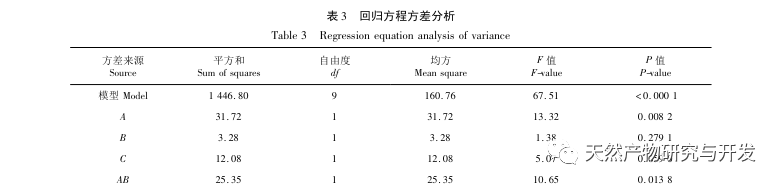
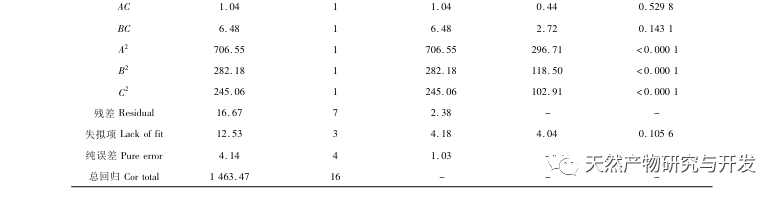
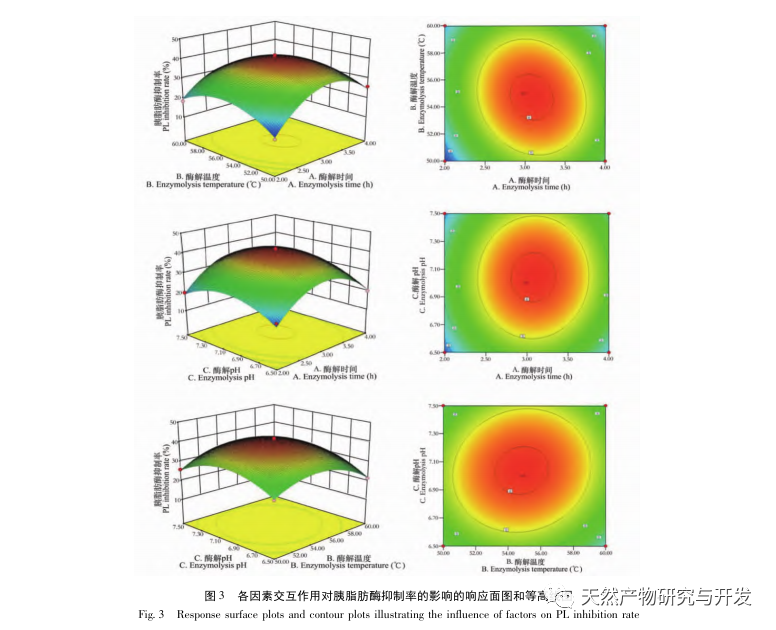
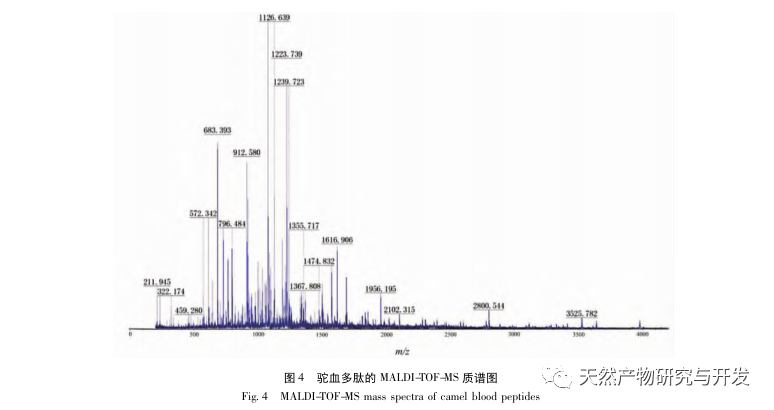


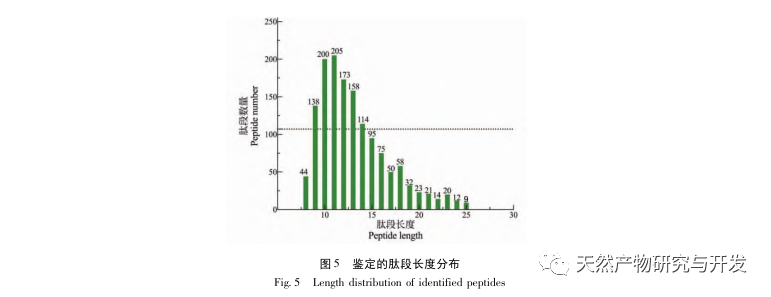
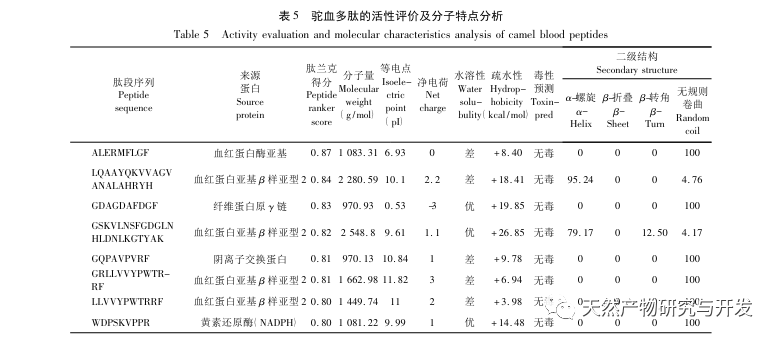

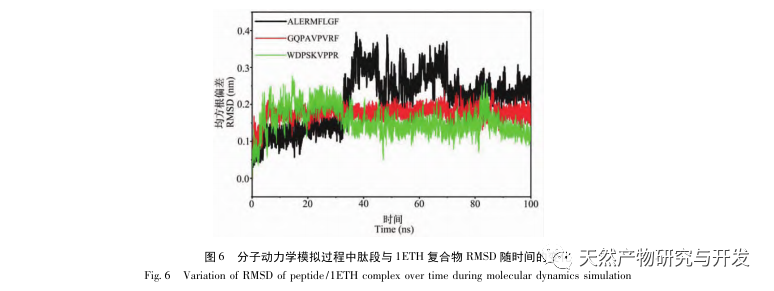
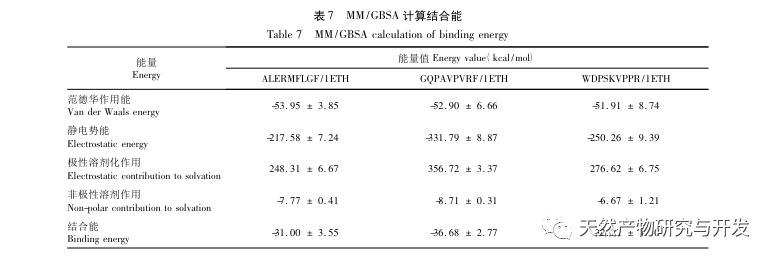
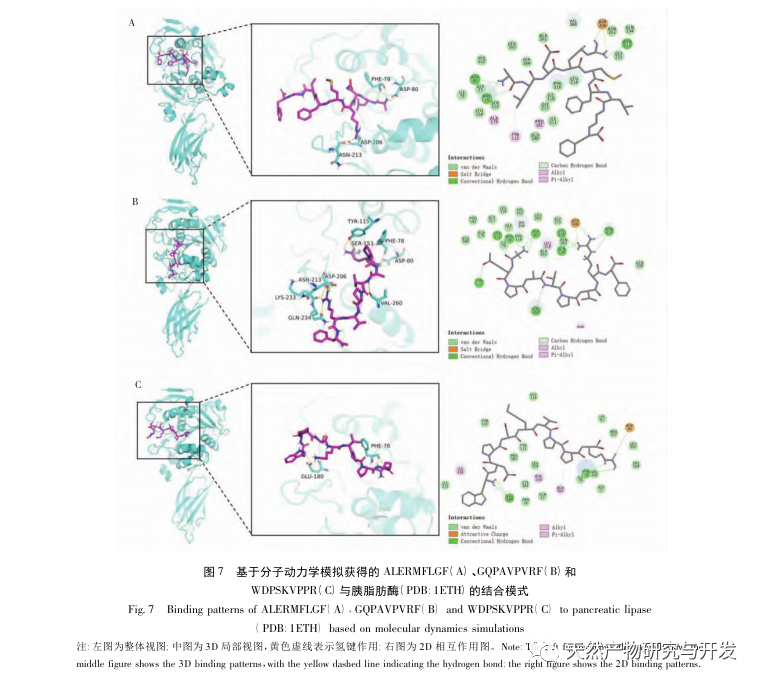
L'inhibition de la lipase pancréatique est considérée comme l'une des interventions thérapeutiques importantes pour l'hyperlipidémie et l'obésité. Cette étude a optimisé le processus de préparation des peptides inhibiteurs de la lipase pancréatique du sang de chameau par hydrolyse à la protéase neutre en fonction de l'activité inhibitrice de la lipase pancréatique par des expériences à facteur unique et à surface de réponse. Dans des conditions optimales, le taux d'inhibition de la lipase pancréatique par le peptide de sang de chameau était de 42,13%. L'analyse des produits de l'hydrolyse enzymatique par MALDI-TOF-MS, LC-MS et bioinformatique a permis d'identifier trois segments peptidiques, ALERMFLGF, GQPAVPVRF et WDPSKVPPR, qui se lient de manière significative à la lipase pancréatique. Des simulations de dynamique moléculaire ont montré que les trois segments peptidiques se lient principalement aux résidus d'acides aminés du site actif de la PL par des liaisons hydrogène et des interactions hydrophobes, perturbant la fonction de la valve du domaine N-terminal de la lipase pancréatique et inhibant son activité. Parmi eux, le GQPAVPVRF a une énergie libre de liaison élevée et un grand nombre de liaisons hydrogène dans les 100ns, ce qui signifie qu'il peut se lier étroitement à 1ETH et devrait devenir un composant des inhibiteurs de la lipase pancréatique. Les résultats de la recherche indiquent que la protéine de sang de chameau peut servir de source de peptides inhibiteurs de la lipase pancréatique. Toutefois, les résultats du criblage virtuel présentent certaines limites et, à l'avenir, il sera nécessaire d'optimiser la solubilité dans l'eau et la stabilité digestive des segments peptidiques. Après la synthèse artificielle, l'effet antihyperlipidémique devrait être vérifié par des expériences in vitro et in vivo.
