El efecto del magnolol regulando la vía de señalización SIRT3/AMPK/mTOR sobre el equilibrio inmunitario Th17/Treg en ratones con colitis ulcerosa.
La colitis ulcerosa (CU) es una enfermedad intestinal inflamatoria crónica asociada a la disbiosis de la microbiota intestinal. En la actualidad, aunque los tratamientos farmacológicos (como el ácido 5-aminosalicílico, los corticosteroides, los inmunosupresores, los productos biológicos y los probióticos) pueden aliviar los síntomas, se ven limitados por las elevadas tasas de recurrencia y los inevitables efectos secundarios (náuseas, vómitos, supresión de la médula ósea, infecciones y riesgo de cáncer). Por lo tanto, existe una necesidad urgente de desarrollar terapias nuevas y eficaces para la CU. Los factores genéticos, el entorno intestinal, la respuesta inmunitaria, la apoptosis celular y las infecciones están asociados a la CU. Según los informes, los pacientes con CU presentan una microbiota intestinal alterada, lo que provoca un aumento de la permeabilidad de la barrera celular epitelial intestinal y desencadena respuestas inflamatorias intestinales; y en la progresión de la CU, suelen aumentar las células T helper 17 (Th17) que causan inflamación, mientras que disminuyen las células T reguladoras (Treg) que inhiben la inflamación. La regulación del equilibrio Th17/Treg mediante la modulación de la microbiota intestinal puede tratar la CU. Por lo tanto, la regulación del equilibrio Th17/Treg se ha convertido en un objetivo importante para el tratamiento de la CU.
El extracto de osmanthus es un producto natural que se encuentra ampliamente en diversas plantas como el crisantemo, el pimiento y la perilla. Tiene efectos antiinflamatorios, antioxidantes, antitumorales y antivirales. Cada vez hay más pruebas de que el magnolol puede reducir la secreción de citoquinas proinflamatorias como el TNF-α y la IL-6, inhibiendo así las respuestas inflamatorias. Se ha aplicado en el tratamiento de enfermedades relacionadas con la inflamación, incluida la CU. Según los informes, la luteolina tiene un efecto regulador sobre la microbiota intestinal y puede tener un impacto eficaz en el tratamiento de la CU mediante el ajuste de la composición y estructura de la microbiota intestinal. Sin embargo, aún no está claro si el magnolol puede regular el equilibrio Th17/Treg en la CU.
El equilibrio dinámico entre Treg y Th17 está regulado por múltiples vías de señalización, entre las cuales la vía de señalización de la proteína quinasa activada por AMP (AMPK)/mammalian target of rapamycin (mTOR) es una de sus vías reguladoras importantes. La investigación ha demostrado que mediante el aumento del nivel de fosforilación de AMPK y la reducción del nivel de fosforilación de mTOR, se puede regular la diferenciación de las células Th17/Treg humanas, y este efecto puede ser bloqueado por el inhibidor de la señalización de AMPK Compuesto C; En el modelo de rata con CU inducida por dextrano sulfato sódico (DSS), el aumento de la fosforilación de AMPK puede reducir la expresión de mTOR y los niveles de varias citoquinas inflamatorias, lo que lleva a la reducción de la diferenciación de células Th17. El regulador silencioso de la información 3 (SIRT3) es un gen antiinflamatorio y supresor de tumores que interactúa con la microbiota intestinal durante la tumorigénesis del colon. Se ha informado de que los ratones deficientes en SIRT3 son muy sensibles a la colitis y al desarrollo de tumores. Sugerencia: SIRT3 puede estar asociado con la progresión de la CU. Mientras tanto, SIRT3 es también un regulador ascendente de la vía AMPK/mTOR, y su sobreexpresión puede aumentar la fosforilación de AMPK y disminuir la fosforilación de mTOR, inhibiendo la inflamación. Un estudio reciente demostró que el magnolol puede aumentar la expresión de SIRT3 y prevenir la lesión cerebral por isquemia-reperfusión mediante la regulación de la vía de señalización SIRT3/AMPK/mTOR. Por lo tanto, este estudio tiene como objetivo explorar si el efecto protector del magnolol en la CU está relacionado con el equilibrio inmunológico Th17/Treg, y analizar su mecanismo, con el fin de aclarar el efecto protector del magnolol en la CU y proporcionar una referencia para el tratamiento de la CU y la aplicación del magnolol.
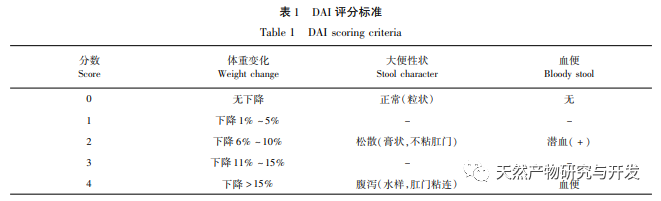
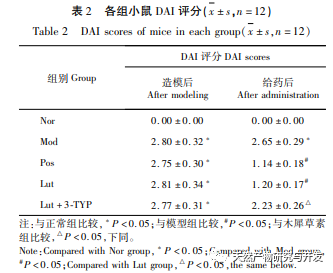
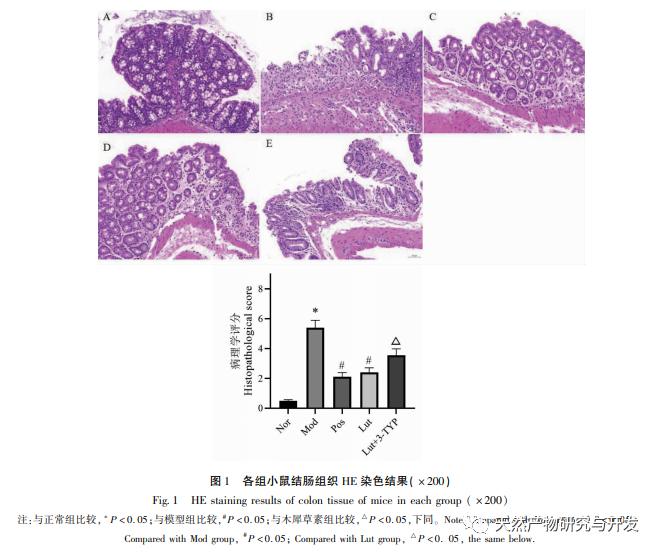

 En los últimos años, la medicina tradicional china se ha utilizado ampliamente para el tratamiento de la CU. Cada vez más estudios indican que la medicina tradicional china desempeña un papel importante en la regulación de la microbiota intestinal durante el tratamiento de la CU. Osmanthus fragrans es uno de los bioflavonoides más estudiados. Los flavonoides son compuestos naturales de baja toxicidad y, hasta la fecha, su uso no se ha registrado con efectos secundarios graves, por lo que son altamente seguros. En este estudio, se investigó in vivo el efecto del magnolol sobre la CU inducida por DSS. Nuestros resultados indican que el magnolol tiene un efecto significativo sobre la CU, que puede demostrarse por la pérdida de peso, la puntuación DAI, la reducción de la necrosis de la mucosa y la infiltración de células inflamatorias. Esto concuerda con las primeras investigaciones y confirma una vez más el efecto protector del magnolol sobre la CU.
En los últimos años, la medicina tradicional china se ha utilizado ampliamente para el tratamiento de la CU. Cada vez más estudios indican que la medicina tradicional china desempeña un papel importante en la regulación de la microbiota intestinal durante el tratamiento de la CU. Osmanthus fragrans es uno de los bioflavonoides más estudiados. Los flavonoides son compuestos naturales de baja toxicidad y, hasta la fecha, su uso no se ha registrado con efectos secundarios graves, por lo que son altamente seguros. En este estudio, se investigó in vivo el efecto del magnolol sobre la CU inducida por DSS. Nuestros resultados indican que el magnolol tiene un efecto significativo sobre la CU, que puede demostrarse por la pérdida de peso, la puntuación DAI, la reducción de la necrosis de la mucosa y la infiltración de células inflamatorias. Esto concuerda con las primeras investigaciones y confirma una vez más el efecto protector del magnolol sobre la CU.
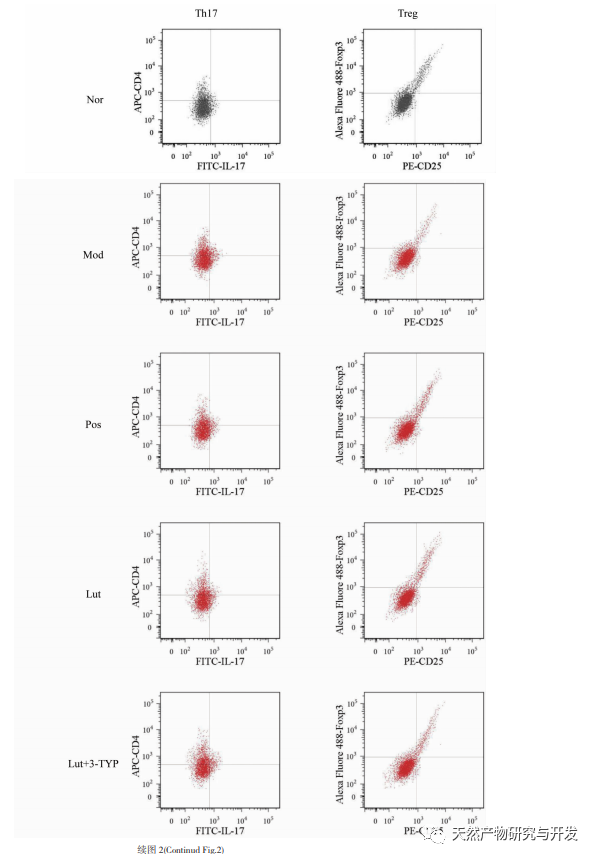
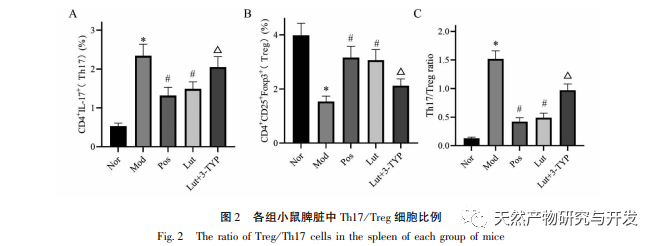
Estudios anteriores han demostrado que la luteolina puede inhibir la respuesta Th17 en las enfermedades autoinmunes mediadas por células T; Y puede ejercer efectos anti-inflamatorios mediante la inducción de CD4 + CD25- para transformarse en células Treg. También se ha informado de que la luteolina puede inhibir la producción de citocinas proinflamatorias como TNF-α, IL-1-β, IL-6 e IL-17 en ratones modelo de CU; los derivados del osmanthus pueden ejercer efectos protectores in vivo en modelos de CU inducidos por DSS reduciendo los niveles de células Th1, Th2 y Th17. Además, investigamos el efecto del magnolol en el equilibrio Th17/Treg, que es uno de los mecanismos importantes que subyacen a la progresión de la CU. En este estudio, encontramos una disminución significativa en el porcentaje de células Treg y un aumento significativo en el porcentaje de células Th17 en los linfocitos esplénicos de ratones con CU. La proporción Th17/Treg en ratones con CU está gravemente desequilibrada. El bazo es un órgano inmunitario importante, y el DSS puede inducir una disfunción inmunitaria en los ratones con CU, dando lugar a una esplenomegalia compensatoria; Y la luteolina puede reducir el índice del bazo y aliviar la colitis inducida por el DSS en los ratones. Este estudio confirma además el importante desequilibrio Th17/Treg en los linfocitos esplénicos de los ratones con CU, que coincide con la CU humana.
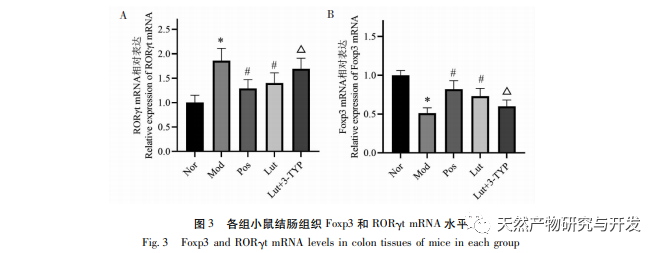
El proceso de diferenciación de las células Th17 está mediado por la regulación transcripcional de ROR γ t. Las células Th17 producen citocinas proinflamatorias, como IL-17, IL-21, IL-22, IL-23 e IL-25, que contribuyen a la progresión de la CU. La diferenciación de las Tregs está regulada por Foxp3, y las Tregs maduras expresan altos niveles de Foxp3. Además, las Treg secretan citocinas inhibidoras, como IL-10, IL-35 y TGF-β, que pueden suprimir las respuestas inmunitarias adaptativas e innatas. Las investigaciones han demostrado que el aumento de células Th17 produce altos niveles de IL-17 e IL-23, promoviendo así la inflamación. Sin embargo, se inhibe la diferenciación de las Treg, lo que conduce a una disminución de las citocinas inmunosupresoras, incluida la IL-10. Mejorar el desequilibrio Th17/Treg puede ayudar a reconstruir la homeostasis inmunitaria intestinal y reducir la CU. Este estudio demostró que la citocina antiinflamatoria IL-10 aumentó y las citocinas proinflamatorias IL-6, IL-17 e IL-23 disminuyeron en el grupo de luteolina; Tip: La intervención de magnolol mejoró el desequilibrio Th17/Treg en el modelo de CU inducida por DSS, en consonancia con estudios anteriores; Además, análisis adicionales mostraron que magnolol significativamente downregulated ROR γ t y upregulated Foxp3 en ratones UC. Debido a la correlación positiva entre ROR γ t y la diferenciación de células Th17, y la correlación positiva entre Foxp3 y la diferenciación de células Treg, los resultados de nuestra investigación demuestran además que el magnolol contribuye al equilibrio de la diferenciación de células Th17/Treg.
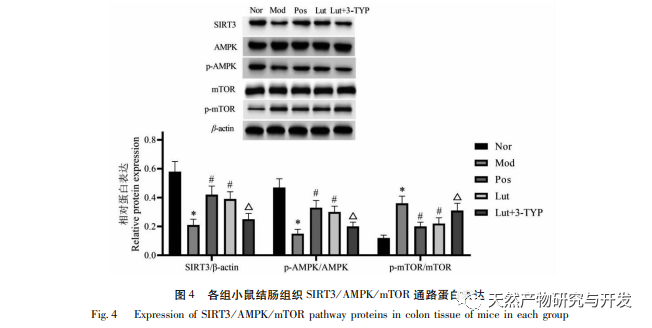
La diferenciación de las células Th17/Treg está regulada por dos vías principales de detección de nutrientes, AMPK y mTOR. SIRT3 es una desacetilasa eficaz, que se ha demostrado que activa la vía AMPK/mTOR para promover la autofagia, mientras que la deficiencia de SIRT3 puede inhibir la vía AMPK/mTOR. En este estudio, observamos que los niveles de proteína SIRT3 y el ratio p-AMPK/AMPK en el tejido de colon de ratones con CU eran significativamente inferiores a los de ratones normales, mientras que el ratio p-mTOR/mTOR era significativamente superior al de ratones normales, lo que indica una deficiencia de SIRT3 en ratones con CU y la inhibición de la activación de AMPK. Osmanthus fragrans puede regular la actividad AMPK modulando la expresión de proteínas reguladoras del silenciamiento. El estudio de Liu et al. demostró que el magnolol puede aumentar la transducción de SIRT3, activar la vía SIRT3/AMPK/mTOR y aliviar la lesión isquémica cerebral. Por lo tanto, especulamos que el efecto del magnolol en el equilibrio Th17/Treg en ratones UC puede estar relacionado con la vía SIRT3/AMPK/mTOR. Los resultados de Western blot mostraron que el magnolol puede aumentar el nivel de proteína SIRT3 en el tejido del colon de ratones con CU, aumentar el nivel de fosforilación de AMPK, y regular a la baja el nivel de fosforilación de mTOR, lo que confirma nuestra hipótesis. 3-TYP es un inhibidor selectivo de SIRT3 y se ha informado que inhibe la expresión de SIRT3. En este estudio, con el fin de aclarar aún más el mecanismo protector de magnolol en ratones con CU, combinamos la intervención de magnolol con 3-TYP. Los resultados mostraron que 3-TYP podría inhibir significativamente la activación de AMPK y debilitar significativamente el efecto de magnolol en el equilibrio de diferenciación de células Th17/Treg en ratones con CU. Sugerencia: El extracto de Osmanthus puede promover el equilibrio Th17/Treg en ratones con CU mediante la activación de la vía SIRT3/AMPK/mTOR.
En resumen, el magnolol puede mejorar el desequilibrio Th17/Treg en modelos de ratón con CU inducida por DSS, y su mecanismo de acción puede estar relacionado con la activación de la vía SIRT3/AMPK/mTOR. Este estudio exploró de forma preliminar el mecanismo protector del magnolol en ratones con CU desde la perspectiva del equilibrio Th17/Treg, indicando que el magnolol puede ser un ingrediente candidato eficaz para tratar la inflamación intestinal, proporcionando un método de tratamiento prometedor para la CU y orientando futuras investigaciones sobre el mecanismo del magnolol para mejorar la CU. Por ejemplo, la vía SIRT3/AMPK/mTOR regula la autofagia, y en futuras investigaciones se estudiará más a fondo si el papel del magnolol en la CU está relacionado con la autofagia. Además, los experimentos con animales son un eslabón clave en la investigación preclínica, y en futuros estudios se analizarán en profundidad la toxicidad y la seguridad del magnolol, sentando las bases para promover la investigación preclínica y lograr la traslación clínica de los fármacos.
