Negative Regulierung der Expression des ribosomalen Proteins S12 durch Luteolin hemmt die Proliferation und Invasion von MDA-MB-231-Zellen
Luteolin (Lut) ist eine natürliche Flavonoidverbindung, die in In-vitro- und In-vivo-Tumorexperimenten wie Leber- und Brustkrebs nachweislich eine gute Anti-Tumorwirkung hat. Darüber hinaus hat Lut eine relativ geringe Zytotoxizität bei der Hemmung der Vermehrung verschiedener Tumorzellen und der Auslösung ihrer Apoptose, was es zu einem potenziellen Antitumormittel macht. Das frühere Experiment zu diesem Thema bestätigte, dass Lut die Aktivität von PI3K/Akt beeinflussen kann, indem es die Expression von PETN hochreguliert, und dann die Proliferation von Brustkrebszellen hemmt. Wenn man jedoch bedenkt, dass das Auftreten und die Entwicklung von Brustkrebs eine Vielzahl von Regulationsmechanismen hat, bleibt unklar, ob Lut andere Mechanismen hat, um die Proliferation von Brustkrebszellen zu hemmen. Das ribosomale Protein (RP) ist einer der Hauptbestandteile der Ribosomen, die an der intrazellulären Proteinbiosynthese, der Transkription, der Translation und der Zellproliferation in anderen regulatorischen, molekularen Bereichen beteiligt sind. Es wird in unterschiedlichem Maße bei Darmkrebs, Magenkrebs, Leberkrebs und Speiseröhrenkrebs abnormal exprimiert. Das ribosomale Protein S12 (RPS12) wird bei Gebärmutterhalskrebspatientinnen stark exprimiert, während seine Expression in normalen Geweben relativ gering ist. Darüber hinaus wird RPS12 auch in Magenkrebsgewebe überexprimiert und kann die Metastasierung von Tumorzellen fördern. Die regulatorische Rolle des RPS12-Gens bei der Proliferation von Brustkrebszellen ist jedoch noch nicht eindeutig geklärt. C-Myc ist ein regulatorischer Faktor für die Ribosomensynthese. Durch eine cDNA-Microarray-Analyse von Fibroblasten wurde festgestellt, dass die Expression von RPS12 in den Zellen mit c-Myc in Verbindung stehen könnte. Ziel dieser Studie ist es, den Mechanismus von c-Myc und RPS12 bei der Hemmung der Proliferation und Invasion von MDA-MB-231-Brustkrebszellen durch Lut zu untersuchen, um neue Ideen für die Entwicklung und Auswahl von Medikamenten für die klinische Behandlung von Brustkrebs zu gewinnen.
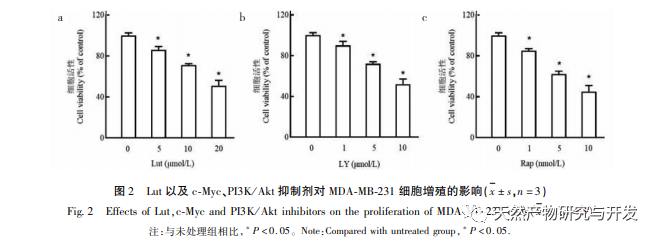

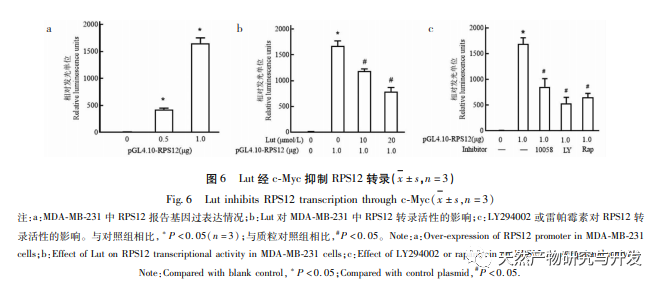
Trotz der raschen Entwicklung des medizinischen Niveaus in den letzten Jahren ist die Wirkung der klinischen Behandlung von Brustkrebs immer noch gering. Der Hauptgrund dafür ist, dass die Entwicklung des Tumors und der Mechanismus der frühen Metastasierung nicht klar sind. Lut, eine natürliche Flavonoidverbindung, hat eine hemmende Wirkung auf das Auftreten und die Entwicklung verschiedener bösartiger Tumore. Obwohl unsere Forschungsgruppe die hemmende Wirkung von Lut auf die Proliferation von Brustkrebszellen bereits bestätigt hat, ist der spezifische Mechanismus noch nicht geklärt. In dieser Studie fanden wir heraus, dass Lut die Expression von c-Myc durch Hemmung des PI3K/Akt/mTOR-Signalwegs herunterregulieren und die Proliferation und Invasion von MDA-MB-231-Brustkrebszellen durch negative Regulierung der Expression von RPS12 hemmen kann. Dies bestätigte die Aussichten von Lut bei der Behandlung von Brustkrebs.
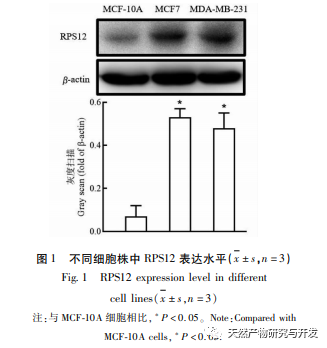
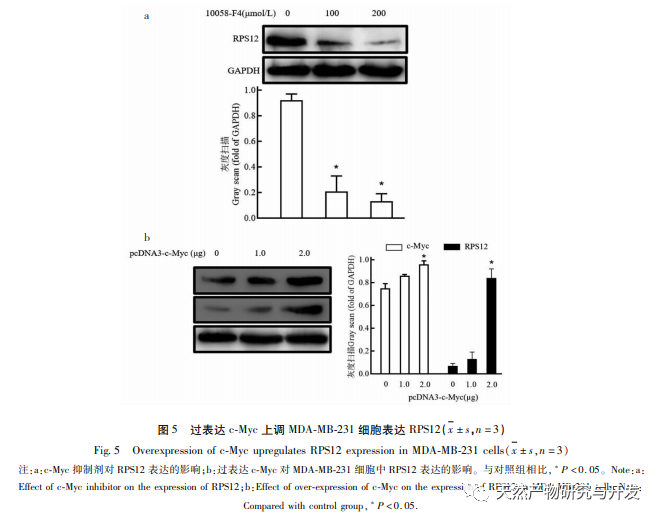
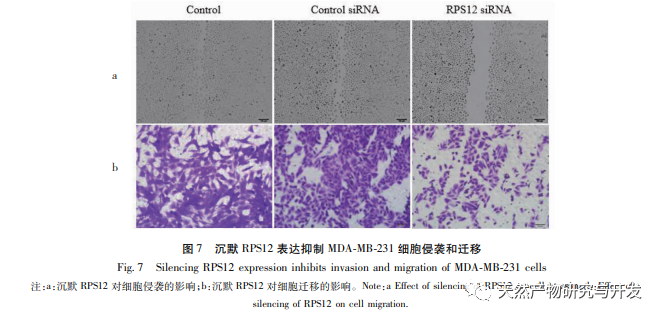
Ribosomen sind die wichtigsten Organellen für die Proteinsynthese in Zellen, und eukaryotische Ribosomen enthalten etwa 80 RPs. RP sind in verschiedenen Tumorzellen wie Gebärmutterhalskrebs und Magenkrebs abnorm hochreguliert und werden mit der Proliferation und Invasion von Tumorzellen in Verbindung gebracht. Untersuchungen haben gezeigt, dass die Expression von RPS12 in Magenkrebszellen deutlich höher ist als in normalen Zellen, was darauf hindeutet, dass RPS12 an der Entstehung und Entwicklung von Magenkrebs beteiligt sein könnte. In dieser Studie wurde festgestellt, dass RPS12 auch in Brustkrebszelllinien stark exprimiert wird, was mit anderen Tumoren übereinstimmt. Wurden Brustkrebszellen jedoch mit Lut behandelt, war die Expression von RPS12 deutlich reduziert. Es wurde bestätigt, dass RPS12 auch an der Regulierung von Lut auf Brustkrebszellen beteiligt ist. Um die Rolle von RPS12 bei der Migration und Invasion von Brustkrebszellen weiter zu klären, testeten wir auch die Wirkung des Silencing von RPS12 auf die Zellinvasion und -migration. Die Ergebnisse zeigten, dass das Silencing von RPS12 die Invasion und Migration von Brustkrebszellen signifikant hemmen konnte. Dies deutet auch darauf hin, dass die hohe Expression von RPS12 bei Brustkrebs zur Tumorentwicklung und Metastasierung beitragen kann. Das c-Myc-Gen ist derzeit als Proto-Onkogen bekannt, das die Zellteilung und -vermehrung wirksam fördern kann und eng mit der Entstehung und Entwicklung verschiedener bösartiger Tumore verbunden ist. Untersuchungen haben gezeigt, dass MicroRNA-184 bei Dickdarmkrebs die Proliferation von Dickdarmkrebszellen hemmen und die Zellapoptose fördern kann, indem sie die Expression von c-Myc herunterreguliert. Darüber hinaus hat c-Myc auch eine ähnliche fördernde Wirkung auf die Zellproliferation in Magenkrebszellen. In dieser Studie wurde festgestellt, dass c-Myc auch in Brustkrebszelllinien in hohem Maße exprimiert wird und dass eine Herabregulierung der c-Myc-Expression die Expression und Transkription von RPS12 in Zellen weiter hemmen kann, wodurch die Proliferation von Brustkrebszellen weiter gehemmt werden kann. In Anbetracht der Rolle von c-Myc in anderen Tumorzellen hat sich erneut gezeigt, dass Lut seine Wirkung durch Beeinflussung der Expression von c-Myc/RPS12 entfalten kann.
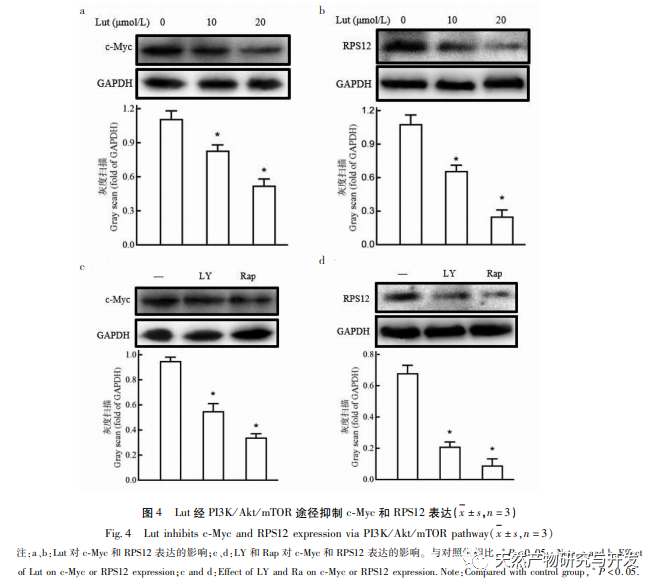
PI3K/Akt ist ein enzymaktiver intrazellulärer Signalweg, der an Prozessen wie Tumorwachstum und -differenzierung beteiligt sein kann. Studien haben gezeigt, dass der PI3K/Akt-Signalweg während der Proliferation und Migration von Brustkrebszellen häufig abnormal aktiviert wird. In dieser Studie wurden sowohl der Akt-Inhibitor LY294002 als auch der mTOR-Inhibitor Rapamycin verwendet, um die Phosphorylierungswerte von mTOR und S6K signifikant zu hemmen. Rapamycin hatte jedoch keine signifikante Wirkung auf die Akt-Phosphorylierungswerte, da mTOR ein nachgeschaltetes Molekül von PI3K/Akt ist und daher keine Wirkung auf die Akt-Phosphorylierung hat. Darüber hinaus können PI3K/Ak- und mTOR-Inhibitoren die Expression von RPS12 und c-Myc in den Zellen deutlich verringern und damit die Zellproliferation hemmen. Diese Ergebnisse deuten darauf hin, dass RPS12 und c-Myc auch nachgeschaltete Moleküle des PI3K/Akt/mTOR-Signalwegs sein können und an der Regulierung von Lut auf die Proliferation und Migration von Brustkrebszellen beteiligt sind.
Zusammenfassend lässt sich sagen, dass Lut die Proliferation und Invasion von MDA-MB-231-Brustkrebszellen hemmen kann, indem es den PI3K/Akt/mTOR-Signalweg hemmt, dadurch die Expression von c-Myc herunterreguliert und anschließend RPS12 negativ reguliert. Diese Ergebnisse deuten darauf hin, dass RPS12 und c-Myc potenzielle Angriffspunkte für die Behandlung von Brustkrebs sein könnten und dass Lut durch die Regulierung der Expression von RPS12 und c-Myc eine antitumorale Rolle spielen kann. Dies wird neue Ideen für die klinische Behandlung von Brustkrebs liefern.
