Bitki özleri ilaç, gıda, kozmetik, katkı maddeleri, sağlık bakım ürünleri ve diğer alanlarda yaygın olarak kullanılmaktadır ve bu nedenle işleme işletmelerinin, kabaca aşağıdaki kategorilere ayrılan kullanımına veya endüstri yönetimine veya ulusal düzenlemelere vb. göre ilgili lisanslama yeterliliğini ele alması gerekir:
1, ilaç hammaddesi olarak dosyalanmalıdır;
2, gıda olarak işlenmiş gıda üretim lisansı (SC) için başvuruda bulunmanız gerekir, gıda kategorileri: katı içecekler, sağlıklı gıdalar, gıda katkı maddeleri;
3, yem katkı maddesi olarak kullanılan, yem katkı maddesi üretim lisansı için başvurmalıdır;
4, ürün ihracat satışları, ihracat üretim işletmeleri dosyalanmalıdır.
İkinci olarak, bitki özü endüstrisinde sistem sertifikasyonu (ISO), ürün sertifikasyonu (Kosher, HALAL, vb.), üretim spesifikasyon sertifikasyonu (GMP), organik sertifikasyon (Çin Organik Sertifikasyonu) ve laboratuvar sertifikasyonu (CNAS, CMA) dahil olmak üzere 30'dan fazla gönüllü sertifikasyon bulunmaktadır.
Aşağıda ilaç, gıda, kozmetik, sağlık ürünleri ve diğer alanlarda kullanılan bitki özleri için gerekli ruhsatların bir açıklaması yer almaktadır.
Çin tıbbı özleri olarak
Çin tıbbı ekstresi dosyalamasının ana organı, Çin tıbbı ekstrelerinin üretim kapsamını içeren İlaç Üretim Ruhsatını alması, GMP gerekliliklerine uyması ve ekstrakt ürünlerini pCm üreticisine sağlaması gereken ekstrakt üreticisidir.
Çin tıbbı ekstresi üreticisinin dosyalama bilgileri şunları içermelidir:
1. İşletmenin temel bilgileri ve ekstraktın teknik bilgileri;
2, "İlaç Üretim Ruhsatı", "İşletme Ruhsatı" ve diğer destekleyici belgeler;
3, Çin bitkisel ilaçları ile ekstraktların üretimi, menşe, baz, kaynak, uygulama dahil olmak üzere Çin tıbbı tablet bilgileri
Standartlar, karışım spesifikasyonları ve tedarikçilerin nitelikleri ve üretim kalite güvence sistemine ilişkin denetim raporları;
4、Süreç yol haritası, temel parametreler, ana ekipman vb. dahil olmak üzere ekstraktların ayrıntılı üretim süreci;
5, ekstraktların iç kontrol kalite standartları veya ekstraktların ulusal farmasötik standartları.
29 Temmuz 2014 tarihinde Devlet Bürosu, Gıda ve İlaç İdaresi İlaç ve Kimya Denetimi [2014] No. 135 "Geleneksel Çin İlaçlarının Üretiminde Ekstrakt ve Ekstraktların Denetim ve Yönetiminin Güçlendirilmesine İlişkin Gıda ve İlaç İdaresi Bildirimi "ni yayınlamıştır; bu bildirime göre "pCms için ulusal ilaç standardı reçetesi altında listelenen ve ayrı bir ulusal ilaç standardına sahip Çin tıbbı ekstraktları kayıt yönetimi için uygulanmalıdır. " Bitki özü işletmelerinin başarısını kaydetmek, üretimini organize etmek, ürünlerinin kalitesini sağlamak ve il (özerk bölgeler ve belediyeler) Gıda ve İlaç İdaresi'nin bulunduğu yer tarafından günlük denetiminden sorumlu olmak için GMP gerekliliklerine uygun olmalıdır.
Bildirimin gerekliliklerine uygun olarak, yönetim için 47 Çin tıbbı özü dosyalanabilir, yani işletme kendi üretebilir, ayrıca satın alınabilir, diğeri işletmenin kendisi tarafından çıkarılmalıdır.
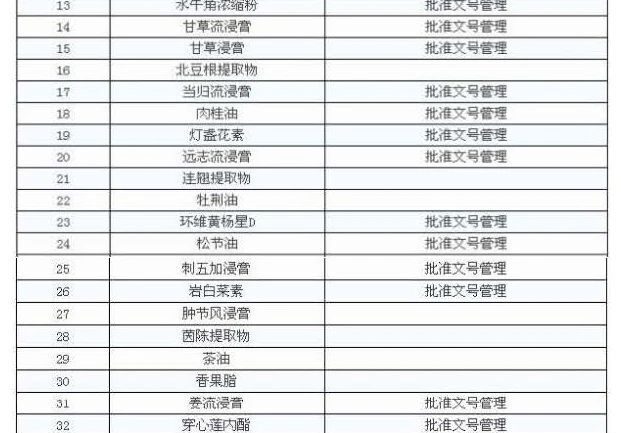
Tıbbi kurum hazırlığı için hammadde olarak
Müstahzar hazırlayacak sağlık kuruluşları "sağlık kuruluşu uygulama ruhsatı" sahibi olmalı ve "sağlık kuruluşu müstahzar hazırlama kalite yönetim standardı "na uygun olarak "sağlık kuruluşu müstahzar hazırlama ruhsatı" alarak, kendi müstahzarlarını yapılandırabilirler.
Tıbbi Kurumlar için Müstahzarların Tescili için İdari Tedbirler (Deneme Uygulaması için), müstahzar başvurusunda bulunan tıbbi kurumların reçete taraması, hazırlama süreci, kalite göstergeleri, farmakoloji, toksikoloji çalışmaları vb. dahil olmak üzere ilgili klinik öncesi çalışmaları yürütmesini şart koşmaktadır. Müstahzar başvurusunda kullanılan Çin bitkisel ilaçlarının tıbbi kurumlarda uygulama ruhsatına sahip olması gerekmektedir. Müstahzar başvurusunda kullanılan Çin bitkisel ilaçları ve geleneksel Çin tıbbı tabletleri ilaç onay numaralarına sahip olmalı ve yasal ilaç standartlarına uygun olmalıdır. Yöntem ayrıca aşağıdaki durumlardan birinin tıbbi kurumlar için müstahzar olarak beyan edilmeyeceğini belirtir:
1, pazara çeşitler tedarik edilmiştir;
2、Devlet Gıda ve İlaç İdaresi tarafından onaylanmamış aktif maddeler içeren çeşitler;
3, biyolojik ürünlere ek olarak alerjenlere ek olarak;
4, Çin tıbbı enjeksiyonu;
5, Çin tıbbı, bileşik preparatın kimyasal bileşimi;
6, narkotik ilaçlar, psikotropik ilaçlar, tıbbi kullanım için toksik ilaçlar, radyoaktif ilaçlar.
Tıbbi Kurumlar Tarafından Çin Tıbbi Preparatlarının Hazırlanmasına Yönelik Geleneksel Tekniklerin Uygulanmasına İlişkin Kayıt Yönetiminin Uygulanmasına Dair Duyuru, geleneksel Çin tıbbi preparatlarının şunları içerdiğini belirtmektedir:
1, Çin şifalı bitkilerinden toz haline getirilerek veya sadece su veya yağ ekstraksiyonu ile yapılan katı (hap, dispersiyon, dans, külçe vb.), yarı katı (merhem, macun vb.) ve sıvı (tonik vb.) geleneksel dozaj formları;
2, su ile ekstrakte edilmiş Çin bitkisel şifalı bitkilerinden yapılan granüller ve ezilmiş Çin bitkisel şifalı bitkilerinden yapılan kapsüller;
3, geleneksel yöntemlerle elde edilen Çin bitkisel şifalı bitkilerinden yapılan likörler ve tentürler.
Sağlık kurumu tarafından dosyalanan geleneksel Çin tıbbı preparatları, "bir sağlık kurumunda uygulama ruhsatında" belirtilen teşhis ve tedavi kapsamıyla tutarlı olmalıdır. Aşağıdaki durumlardan biri dosyalanmayacaktır:
1, "Sağlık Kurumları Kayıt Yönetimi Tedbirleri için Hazırlıklar (deneme uygulaması için)" hükümlerinde yer alan koşullar sağlık kurumu hazırlıkları olarak beyan edilmeyecektir;
2 ve piyasaya aynı reçetenin farklı dozaj formu çeşitleri sunulmuştur;
3, Çin tıbbı formül parçacıkları;
Özetle, tıbbi kurumların preparatları için hammaddeler Çin tıbbı özleri değil, Çin bitkisel ilaçları veya Çin tıbbı tabletleri olmalıdır ve tıbbi kurumlar yalnızca hammadde kaydı için onaylanmış ev yapımı preparatları satın alabilirler.
Sağlıklı gıdalar için hammadde olarak
2015'te yayımlanan Sağlık Gıdası Tescil ve Dosyalama İdaresi Tedbirleri, CFDA'nın Çin tıbbı özütlerinin sipariş üzerine işlenmesini yasakladığını açıkça belirtmektedir ve bitki özütlerinin dosyalanması sektörün gelişiminde yeni bir trend haline gelmiştir.
2016 yılının sonunda CFDA, bitki ekstraktlarının sağlıklı gıda üretimine dahil edilmesine ilişkin spesifik kuralları daha da standartlaştıran Sağlık Gıdası Üretim Lisansı İnceleme Kurallarını yayınladı. Diğer işletmelere sağlıklı gıda üretimi için hammadde olarak bitki ve hayvan ekstraktları sağlayan başvuru sahipleri, bu kuralların gerekliliklerine uygun olarak hammadde ekstraktı üretim ruhsatları için başvurmalıdır; sadece işletme tarafından üretilen sağlıklı gıda için hammadde ekstraksiyonu yapanların sağlıklı gıda ürünü üretim ruhsatları için başvurmaları ve ayrıca hammadde ekstraktı üretim ruhsatları için başvurmaları gerekmez. İşletmenin kendi sağlıklı gıdasını üretmesi durumunda bitki ve hayvanları kendisinin çıkarabileceğini gösterir. Sağlıklı gıda hammadde ekstraktı üretim ruhsatı, hammadde ekstraktının proje adının tür detayında işaretlenmeli ve Açıklamalar sütununda sağlıklı gıdanın adı, kayıt numarası veya sicil numarası ve diğer bilgiler yer almalıdır.
Sağlıklı gıda hammadde ekstraktı üretim ruhsatı için başvuran başvuru sahipleri, sağlıklı gıda kayıt belgeleri veya dosyalama sertifikasının yanı sıra üretim sürecinin hammadde ekstraktında belirtilen kayıt belgeleri veya dosyalama sertifikalarını, kalite standartlarını sunmalıdır.
Sağlıklı gıda bileşenleri kataloğu, güvenlik ve fonksiyonel değerlendirmeyi ifade eder, sağlıklı gıda maddeleri ve bunlara karşılık gelen ilgili bilgi listesi için kullanılabilir. Herhangi bir birim veya birey, ilgili araştırmalara dayanarak, Devlet Gıda ve İlaç İdaresi Sağlık Gıda Değerlendirme Merkezi'ne sağlık gıda bileşenleri kataloğuna dahil edilecek hammaddeleri önerebilir.
Sağlıklı gıda bileşenleri kataloğuna dahil edilmek üzere başvurulan hammaddeler aşağıdaki gereklilikleri karşılamalıdır:
1, geniş bir yelpazede yerli ve yabancı gıda geçmişi ve yeterli bilimsel kanıt ile;
2, sağlık bakım fonksiyonu kataloğunun gereklilikleri doğrultusunda net bir dozaj aralığı ve ilgili sağlık bakım fonksiyonları ile;
3, istikrarlı ve kontrol edilebilir kalite ve teknik gereksinimler ile;
4、Güvenlik ve etkinlik gerekliliklerini karşılayan bilimsel temele sahiptir;
5, bilimsel olarak uygulanabilir, istikrarlı ve güvenilir içerik veya imza bileşenlerinin etkinliği, içerik aralığı ve test yöntemleri ile;
6, öngörülen dozaj ve tüketim yöntemine uygun olarak, ilgili nüfus için güvenli ve zararsızdır.

Gıda için bir bileşen olarak
Gıda Güvenliği Kanunu'na göre, "Gıda, insan tüketimi veya içimi için her türlü bitmiş ürün ve hammaddeyi, ayrıca geleneğe göre hem gıda hem de ilaç olan maddeleri ifade eder, ancak tedavi amaçlı maddeleri içermez." Gıda amaçlı bitki ekstraktlarının gıda olduğuna ve Gıda Güvenliği Kanunu gerekliliklerine uygun olarak ruhsatlandırılması gerektiğine şüphe yoktur. Gıda işleme için kullanılan bitki ekstraktları, tıbbi ve gıda veya yeni kaynak gıdalar kataloğundan seçilen hammaddelerden elde edilmelidir.
Hem gıda hem de ilaç olan maddeler, geleneksel beslenme alışkanlıkları olan ve Çin bitkisel ilaçlarının ulusal standardında listelenen hayvanların ve bitkilerin kullanılabilir kısımlarını ifade eder. Hem gıda hem de ilaç hammaddeleri kataloğunda yer alan maddeler aşağıdaki gereklilikleri aynı anda karşılamalıdır:
1. Gıda Güvenliği Kanunu ve ilgili yönetmeliklere uygun olarak;
2, Çin tıbbı kanonunda yenilebilir kayıtlar vardır, toksisite kaydı bulunmaz;
3, geleneksel tüketim alışkanlıklarıyla, normal tüketimin insan sağlığına herhangi bir akut, subakut neden olduğu bulunmamıştır,
Kronik veya insan sağlığına diğer potansiyel zararlar doğrultusunda, beslenme gereksinimlerine sahip olmalıdır;
4, Çin bitkisel ilaç kaynaklarının korunmasına yönelik ilgili yasa ve yönetmelikler doğrultusunda;
5, Çin bitkisel ilaçları için ulusal standartlara dahil edilmiştir.
Yeni kaynak gıdalar şunlardır:
Çin'de geleneksel olarak tüketilmeyen hayvanlar, bitkiler ve mikroorganizmalar;
2, Çin'de geleneksel olarak tüketilmeyen gıda hammaddelerinden ayrılan hayvan, bitki ve mikroorganizmalardan;
3, gıda işlemede kullanılan yeni mikroorganizma çeşitleri;
4. Gıda bileşenlerinin orijinal bileşiminin veya yapısının değişmesine yol açan yeni üretim süreçlerinin kullanılması nedeniyle.
Gıda birimleri veya bireyler için yeni kaynakların üretimi ve yönetimi veya kullanımı, piyasada ilk kez yer alan üründe inceleme ve onay için Sağlık Bakanlığı'na bildirilmelidir. Aşağıdaki materyalleri gönderin:
1, gıda hijyeni için yeni kaynaklar ve idari ruhsat başvuru formu;
2, geliştirme raporları ve güvenlik araştırma raporları;
3, üretim sürecinin ve akış şemasının kısa bir açıklaması;
4, ürün kalite standartları;
5, yerli ve yabancı araştırma ve kullanım ve ilgili güvenlik bilgileri;
6, ürün etiketleri ve talimatları;
7. Değerlendirmeye yardımcı olacak diğer bilgiler.
İşletme, gıda işleme için hammadde olarak tıbbi gıda ve yeni kaynak gıda kataloğu dışındaki diğer bitkileri veya bunların özlerini seçerse, üç geleneksel çözüm vardır:
1, büyük işletmeler yeni kaynak gıdaları beyan etme riskinden kaçınmak için;
2, artık hammadde olarak gıdaya işlenebilir, kurumsal standartların hazırlanması, kayıt yoluyla ve en azından yerel yönetim tarafından tanınan SC sertifikası alınabilir, ancak diğer satış riski alanları (örneğin: Hainan Ganoderma Lucidum etkinliği).
3, hükümetin Ulusal Sağlık Komisyonu'na davranışını kullanıp kullanamayacağınızı görmek için il sağlık komisyonuna da yazılabilir (güçlü bir ağ gerektirir).
(A) yeni gıda bileşenleri, sıradan gıda tanımı ve yönetimi
Yeni gıda hammaddeleri, Çin'de geleneksel beslenme alışkanlığı olmayan şu maddeleri ifade eder: hayvanlar, bitkiler ve mikroorganizmalar; hayvanlardan, bitkilerden ve mikroorganizmalardan izole edilmiş bileşenler; orijinal yapısı değiştirilmiş gıda bileşenleri; ve diğer yeni geliştirilmiş gıda hammaddeleri. Yukarıdaki durumlardan birine ait olan maddeler, sıradan gıdaların üretimi ve işletilmesi için geliştirilmeleri gerekiyorsa, "Yeni Gıda Bileşenlerinin Güvenliğinin İncelenmesine Yönelik İdari Tedbirler" hükümlerine uygun olarak onay için beyan edilmelidir.
Yeni Gıda Bileşenlerinin Güvenliğinin İncelenmesine İlişkin İdari Tedbirler uyarınca geleneksel beslenme alışkanlıkları olan gıda ürünleri için, işletmelerin üretim ve işletimi Tedbirler ile birleştirilebilir ve Gıda Güvenliği Kanunu hükümlerine uygun olarak uygulanabilir.
Eski Sağlık Bakanlığı 2002 yılında Sağlık Gıdası Hammaddelerinin Yönetiminin Daha Fazla Standartlaştırılmasına İlişkin Tebliği yayınlayarak Hem Gıda Hem de İlaç Olan Maddeler Listesinde yer alan maddelerin normal gıda üretimi için kullanılabileceğini; Gıda İçin Kullanılabilecek Suşlar Listesinde yer alan suşların ise 2010 yılında ilan edildiğini ve normal gıda üretimi için kullanılabileceğini duyurmuştur.
1998 yılında eski Sağlık Bakanlığı, kolza tohumu poleni, mısır poleni, çam poleni, ayçiçeği poleni, Zizyphus poleni, karabuğday poleni, susam poleni, sorgum poleni, konjac, Spirulina obtususifoliae, Spirulina viridulae, Dikenli Armut, Gül Patlıcanı, İpekböceği Pupası gibi yeni kaynak gıdaları sıradan gıda ürünleri olarak listeleyen 1998 Ulusal Sağlık Gıda Piyasası Düzeltme Çalışmalarının Düzenlenmesine İlişkin Genelge'yi yayınladı.
(ii) Ortak gıda ve sağlıklı gıda hammaddelerinin tanımı ve yönetimi
Eski Sağlık Bakanlığı 2002 yılında Sağlık Gıdası Hammaddelerinin Yönetiminin Daha Fazla Standartlaştırılmasına İlişkin Tebliği yayınlayarak Sağlık Gıdalarında Kullanılabilecek Maddelerin Listesini ve Sağlık Gıdalarında Kullanılması Yasak Maddelerin Listesini yayınlamıştır. Sağlıklı gıda bileşenlerinin yönetimine ilişkin özel düzenlemeler için lütfen Genelgeye bakınız.
Mülga Sağlık Bakanlığı tarafından 2002 yılında yayımlanan Sağlık Gıdalarında Kullanılabilecek Maddeler Listesinde yer alan maddeler sadece sağlık gıdalarında kullanılabilir. Genel gıdalarda kullanılabilecek maddeler hariç olmak üzere, Sağlık Gıdalarında Kullanılabilecek Maddeler Listesinde yer alan maddeler genel gıda hammaddesi olarak üretilemez ve işletilemez. Sağlık Gıdalarında Kullanılabilecek Maddeler Listesinde yer alan maddelerin normal gıda üretimi için geliştirilmesine ihtiyaç duyulması halinde, Yeni Gıda Hammaddelerinin Güvenliğinin İncelenmesine İlişkin İdare Tedbirlerinde öngörülen usullere uygun olarak onay için beyan edilecektir.
Kozmetik hammaddesi olarak
Bitki bazlı kozmetikler, her ikisi de kozmetik üretim ruhsatı gerektiren özel kullanımlı kozmetikler ve özel kullanımlı olmayan kozmetikler olarak kategorize edilir.
Kozmetikte kullanılan hammaddeler kozmetik hammaddeleri kataloğunda yer almalıdır, katalogda yer almayan hammaddeler, ilgili prosedürler için bitki bazlı kozmetik yeni hammaddelere uygun olmalıdır, bitki bazlı kozmetik yeni hammaddeler, Çin topraklarında ilk kez bitki (yosun dahil) kökenli doğal hammaddelerin kozmetik üretimi için kullanılmasını ifade eder. Bitkilerden elde edilen tek bir bileşen veya yüksek oranda saflaştırılmış bileşenler bu tanıma girmez.
Yeni bitki bazlı kozmetik hammaddelerin idari ruhsatlandırılması için başvuru, "kozmetik beyanı ve kabulü idari ruhsatlandırma hükümleri" ve "yeni kozmetik hammadde beyanı ve Kılavuzun gözden geçirilmesi" ve diğer ilgili gerekliliklere uygun olmalı, idari ruhsatlandırma beyanı sunmalıdır. Buna ek olarak, özel amaçlı bir kozmetik hammadde olarak (örneğin: ginseng, astragalus, gibberellik asit, boynuz kadife, Ganoderma lucidum, deniz topalak, Poria cocos, Angelica sinensis, inci, ginkgo biloba ve çuha çiçeği gibi bir dizi Çin tıbbı özünde yaşlanma karşıtı ürünlerde yaygın olarak kullanılmaktadır). İlgili toksikolojik güvenlik değerlendirme bilgileri de sunulmalıdır.
Avrupa, Amerika ve diğer ülkelerde bitkisel ekstraktlara ilişkin politikalar
Amerika Birleşik Devletleri'nde bitkisel ilaçların yönetimi nispeten geri kalmış durumdadır. Amerika Birleşik Devletleri tarafından çıkarılan Besin Takviyesi Sağlık ve Eğitim Yasası'nda "besin takviyesi" tanımı "bitki veya diğer bitkileri" ve bunların "herhangi bir konsantresini" içermektedir ki bu da şüphesiz "bitki veya diğer bitkileri" kapsamaktadır. "Bu durum, bitki özlerinin besin takviyesi olarak yasal statüsü konusunda hiçbir şüpheye yer bırakmamaktadır.
Almanya'da bitki özlerinin yasama prosedüründe reçeteli ilaç olarak kaydedilmesine izin verilmektedir. Almanya'da çoğu bitkisel infüzyon olmak üzere bitkisel içerikli yaklaşık 60.000 çeşit kayıtlı ilaç bulunmaktadır ve Almanya'da botanik ilaç olarak kullanılmak isteyen geleneksel Çin ilaçları için sıkı bir onay prosedürü bulunmaktadır. Genel olarak, Çin'deki Çin ilaçları Almanya'ya sağlık bakım ürünleri şeklinde girmekte ve gıda yönetimi için başvurmaktadır.
Avrupa Birliği'nde ilaçlar; patentli ilaçlar, jenerik ilaçlar, reçetesiz satılan ilaçlar, doğal botanikler, aşı ürünleri, kan ürünleri, biyolojik ürünler ve antidepresanlar olmak üzere 8 türe ayrılmaktadır. İngiltere ve Hollanda'nın yanı sıra Almanya, Fransa ve İtalya da doğal botanikleri reçeteli ilaç veya reçetesiz ilaç olarak düzenlemektedir. 2003 yılında kabul edilen Botanik İlaçların Kayıt Prosedürüne ilişkin Avrupa Direktifinde yapılan değişiklik, başlangıçta ilgili gıda yönetmeliklerine tabi olan geleneksel botanik tıbbi ürünlerin, tıbbi dozajdan daha düşük miktarda doğal botanik maddeler veya doğal botanik özleri içermeleri halinde ilgili gıda yönetmeliklerine tabi olmaya devam edeceğini öngörmektedir. Yönetmelikler.
Japonya'da geleneksel Çin tıbbının kullanımı son derece kısıtlıdır. Şu anda Sağlık ve Refah Bakanlığı (MHLW), onaylanmış 210 reçetenin dışında, yeni Çin bitkisel ilaçlarının eklenmesini onaylama konusunda son derece katıdır ve Çin bitkisel ilaçlarına neredeyse kapıyı kapatmakla eşdeğer olan yeni bileşik ilaçlarla aynı şekilde muamele etmektedir ve ithal tescilli Çin ilaçlarının onaylanmasında da oldukça kısıtlayıcı önlemler vardır. Bununla birlikte, son yıllarda Japon Hükümeti, dozaj formları üzerindeki kısıtlamaları kaldırmak ve sağlıklı gıdalarda kullanılabilecek doğal botanik türleri üzerindeki kısıtlamaları gevşetmek gibi sağlıklı gıdalar üzerindeki kontrolünü hafifletmiş görünmektedir.
