Получение фукоидана нано-селена и его ингибирование пролиферации опухолевых клеток
В настоящее время, помимо сердечно-сосудистых заболеваний, рак стал второй ведущей причиной смерти людей. Из-за сложности лечения, длительного цикла терапии и высокой стоимости лечения он ложится тяжелым бременем на жизнь людей. Химиотерапия является одним из основных методов лечения рака в современной западной медицине, но из-за серьезных побочных эффектов и лекарственной устойчивости химиотерапевтических препаратов эффект лечения не является идеальным. Поэтому разработка противоопухолевого препарата широкого спектра действия с высокой эффективностью и отсутствием токсичных побочных эффектов остается актуальной задачей, требующей решения.
Селен (Se) - важнейший микроэлемент для организма человека, играющий важную роль в синтезе глутатионпероксидазы, тиоредоксинредуктазы и других ферментов. Он участвует в различных видах жизнедеятельности и имеет огромное значение для здоровья человека. В то же время селен обладает различными функциональными свойствами, такими как антиоксидантное и противоопухолевое. Исследования показали, что больные раком страдают от дефицита селена в организме. Достаточное потребление селена может защитить нормальные клетки и снизить вероятность возникновения рака. Однако диапазон безопасных доз Se, которые можно использовать в организме, очень узок, и при чрезмерном употреблении легко вызвать отравление. Поэтому очень важно изучить и разработать безопасные формы Se, чтобы снизить его токсичность. Исследования показали, что по сравнению с традиционными формами Se наночастицы селена (SeNPs) обладают меньшей токсичностью и лучшей биодоступностью благодаря своим уникальным размерам и поверхностным эффектам. Однако SeNP обладают высокой активностью из-за отсутствия соседних координирующих атомов на их поверхности, что делает их крайне нестабильными при комнатной температуре и склонными к агрегации с образованием более токсичного элементарного Se. Поэтому при приготовлении SeNPs обычно используются диспергаторы для повышения их дисперсности. Полисахариды имеют в своей молекулярной структуре гидроксильные группы, которые могут связываться с Se через межмолекулярные водородные связи, предотвращая агрегацию SeNPs. Поэтому полисахариды часто используются для диспергирования SeNPs. В настоящее время полисахариды, используемые в качестве модификаторов наноселена, включают полисахариды астрагала, глюкоманнан конжака и др.
Фукоидан (FD) - это натуральный водорастворимый полисахарид, получаемый из бурых водорослей и состоящий из сульфатированного фукоидана, маннозы, арабинозы, глюкуроновой кислоты и других моносахаридов. Исследователи обнаружили, что фукоидан обладает различными функциональными свойствами, такими как противоопухолевое, антиоксидантное и противовоспалительное действие. Однако в настоящее время нет сообщений о модификации наноселена фукоиданом. Поэтому в данной статье мы используем FD в качестве стабилизатора для получения наночастиц селена с фукоиданом (FD SeNPs) с помощью окислительно-восстановительных реакций. Однофакторные эксперименты и эксперименты с поверхностью отклика используются для оптимизации параметров процесса получения, а затем изучаются структурная идентификация и ингибирование пролиферации опухолевых клеток, что обеспечивает теоретическую поддержку разработки и применения FD SeNPs в качестве ингибиторов опухолевых клеток.
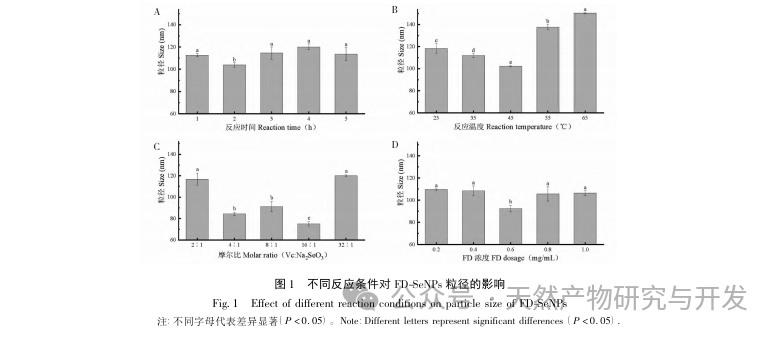
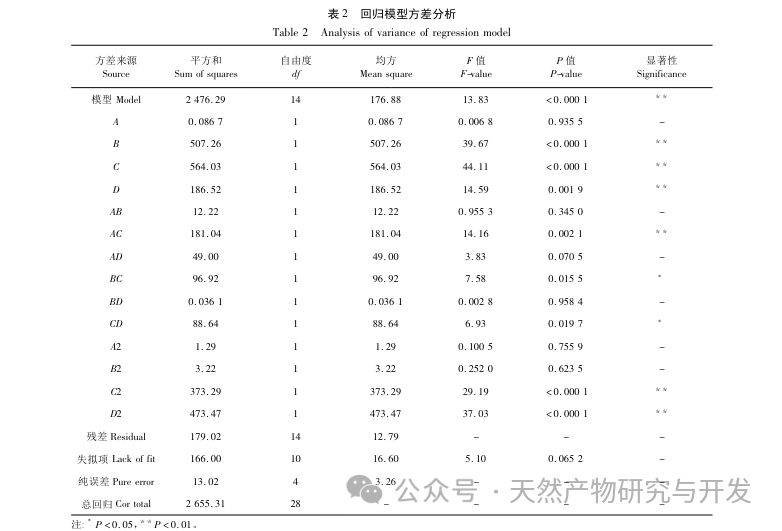
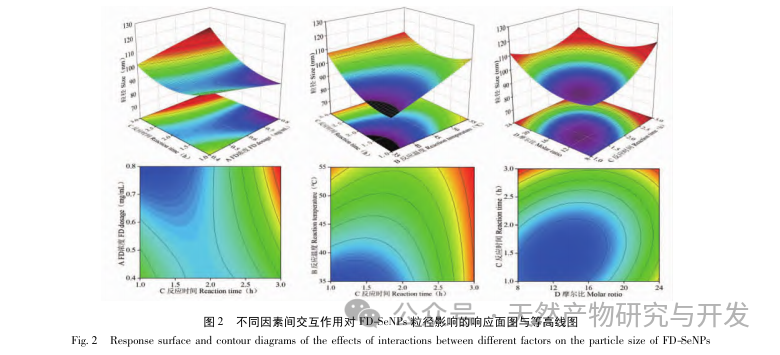
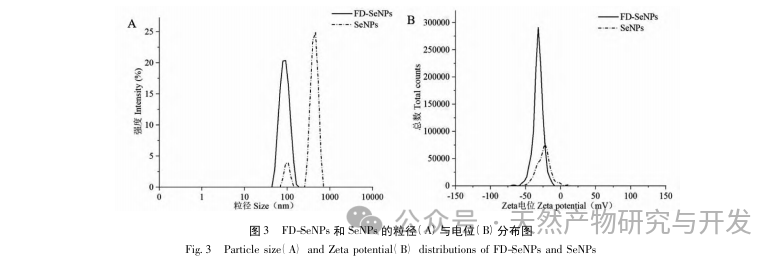


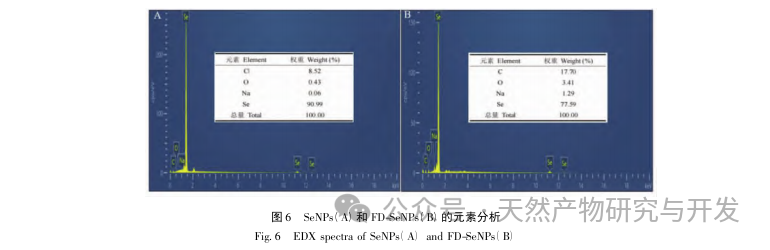
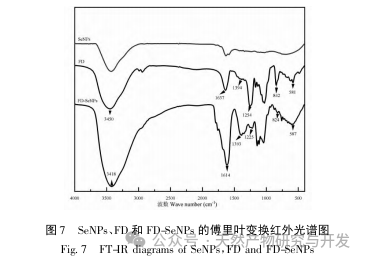
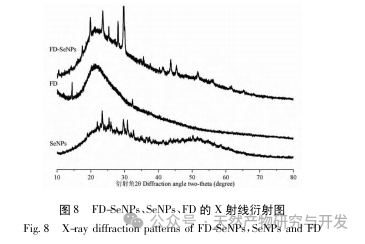
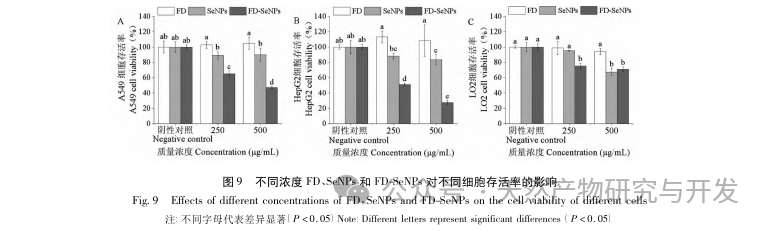
В данной статье с помощью однофакторных экспериментов и экспериментов по оптимизации поверхности отклика были получены оптимальные параметры процесса приготовления FD SeNPs: температура реакции 35 ℃, время реакции 1 час, молярное соотношение аскорбиновой кислоты и селенита натрия 14:1 и концентрация FD 0,8 мг/мл. В этих условиях минимальный размер частиц составил (83,40 ± 0,55) нм, потенциал - (-31,89 ± 0,47) мВ, а содержание селена достигло 29,93%. Дальнейшая идентификация его структуры показала, что ФД образует равномерно сферические наночастицы на поверхности SeNPs за счет адсорбции гидроксила, что указывает на то, что полярные группы полисахаридов могут эффективно ингибировать агрегацию SeNPs.
Современные исследования показали, что противоопухолевые механизмы в основном включают ингибирование роста опухолевых клеток, ингибирование метастазирования или инвазии опухолевых клеток и усиление иммунной регуляции организма для достижения противоопухолевого эффекта. Исследования показали, что SeNPs, использующие полисахариды в качестве шаблонов, могут способствовать экспрессии соответствующих апоптотических белков и маркерных белков аутофагии, тем самым индуцируя апоптоз и аутофагию опухолевых клеток. Противоопухолевый эксперимент in vitro в рамках данного исследования показал, что модифицированные FD SeNPs могут значительно усилить способность SeNPs ингибировать пролиферацию опухолевых клеток и обладают хорошей клеточной селективностью, однако их конкретный механизм действия нуждается в дальнейшем изучении.
