Механизм каэмпферола, индуцирующего апоптоз клеток тройного негативного рака молочной железы через митохондриальный путь апоптоза
Тройной негативный рак молочной железы (TNBC), как особый подтип рака молочной железы, составляет 15%~20% от общего числа случаев рака молочной железы. Его клиническими характеристиками являются короткий период общей выживаемости, высокая степень злокачественности, сильная инвазия, высокая частота ранних рецидивов и т. д. После появления метастазов медиана выживаемости пациентов составляет всего 10~13 месяцев. В связи с нечувствительностью TNBC к эндокринной терапии и таргетной терапии основным методом лечения является химиотерапия. Однако резистентность к препаратам и побочные эффекты, связанные с лечением, по-прежнему вызывают беспокойство. В последние годы роль традиционной китайской медицины в профилактике и лечении ТНБК получает все большее признание благодаря ее уникальной теоретической системе и опыту составления индивидуальных планов лечения. Наша исследовательская группа в ходе предыдущих исследований установила, что добавление и уменьшение дозы отвара Чайху Гуйчжи в сочетании с капецитабином может подавлять рост подкожно пересаженной опухоли тройного негативного рака молочной железы у голых мышей. Дальнейший анализ с использованием метода сетевой фармакологии показал, что каэмпферол (KA) является важным эффективным компонентом в добавлении и сокращении отвара Чайху Гуйчжи, что дает нам экспериментальную основу для использования каэмпферола для лечения тройного негативного рака молочной железы.
Каемпферол - флавоноидное соединение, широко распространенное в овощах, фруктах и традиционной китайской медицине. Он обладает различными эффектами, такими как противораковый, противовоспалительный, антиоксидантный и противовирусный. Он может подавлять пролиферацию и инвазию опухолевых клеток, вызывая их апоптоз, регулируя клеточный цикл, ингибируя ангиогенез и метастазирование опухолей. Исследования показали, что KA вызывает ингибирование роста и апоптоз в клетках рака легких путем активации MEK-MAPK. In vitro и in vivo KA ингибирует пути AKT/PI3K и ERK, активирует митохондриальный путь апоптоза и увеличивает радиационное уничтожение клеток рака легкого. При раке толстой кишки KA восстанавливает межклеточную коммуникацию gap junctions, усиливая экспрессию и фосфорилирование junction protein 43 в клетках рака толстой кишки, тем самым индуцируя апоптоз клеток. KA также может вызывать апоптоз и старение в клетках рака шейки матки человека путем снижения регуляции путей PI3K/AKT и hTERT. При раке молочной железы, как сообщается, KA играет противоопухолевую роль через различные механизмы. KA может подавлять инвазию клеток рака молочной железы, блокируя экспрессию и активность каскада PKC δ/MAPK/AP-1, а затем и матричной металлопротеиназы-9 (MMP-9). Ли и др. обнаружили, что KA может ингибировать пролиферацию клеток рака молочной железы SK-BR-3 путем регулирования белка Notch1. Кроме того, KA может подавлять эпителиально-мезенхимальную трансформацию (EMT) и метастазирование клеток рака молочной железы MCF-7, вызванное триклозаном. Хотя противораковый эффект KA в различных опухолях был подтвержден, нет данных о том, может ли KA индуцировать апоптоз клеток тройного негативного рака молочной железы и каков его молекулярный механизм. В данном исследовании в качестве объекта исследования взята человеческая TNBC-клетка MDA-MB-231, чтобы изучить влияние каэмпферола на апоптоз клеток MDA-MB-231 и возможный механизм, связанный с митохондриальным путем апоптоза, чтобы обеспечить теоретическую базу и экспериментальную основу для клинического использования каэмпферола в лечении тройного негативного рака молочной железы.
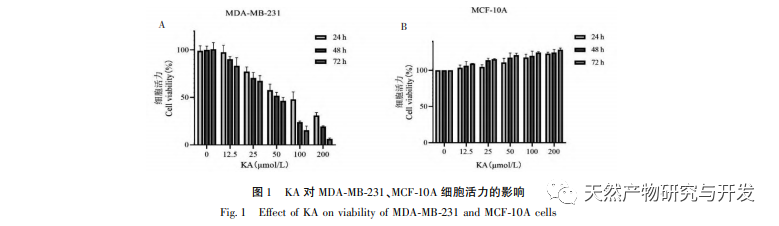
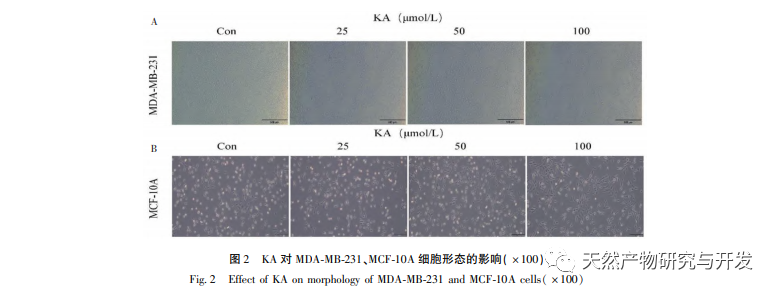
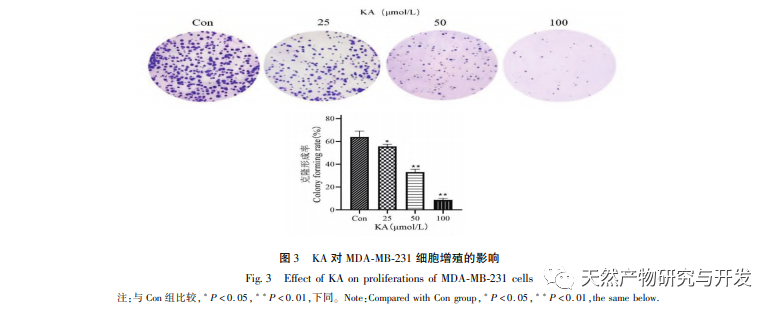
Каэмпферол, широко распространенный в различных растениях полиол-гидрокси-флавоноид, может не только эффективно подавлять рост опухолевых клеток и вызывать апоптоз, но и поддерживать жизнеспособность нормальных клеток. Чен и др. обнаружили, что KA может вызывать остановку клеточного цикла рака простаты, ингибировать пролиферацию клеток и не влияет на жизнеспособность нормальных фибробластов крайней плоти человека (HFF), что свидетельствует о хорошей противоопухолевой эффективности и низкой токсичности KA. Ту и др. обнаружили, что KA может эффективно подавлять пролиферацию и метастазирование клеток рака шейки матки человека, в то время как его цитотоксическое действие на карциноэмбриональные клетки почек и нормальные клетки печени относительно невелико, что свидетельствует о высокой способности KA к таргетному воздействию на раковые клетки. Существует мало исследований по изучению KA в клетках тройного негативного рака молочной железы. Таким образом, данное исследование подтвердило, что KA может значительно подавлять пролиферацию клеток TNBC и способствовать апоптозу клеток с помощью исследований in vitro на клетках MDA-MB-231 и MCF-10A, но не влияет на пролиферацию нормальных эпителиальных клеток молочной железы MCF-10A.
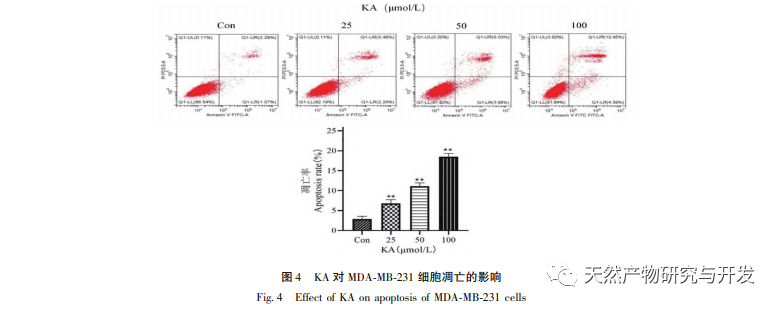
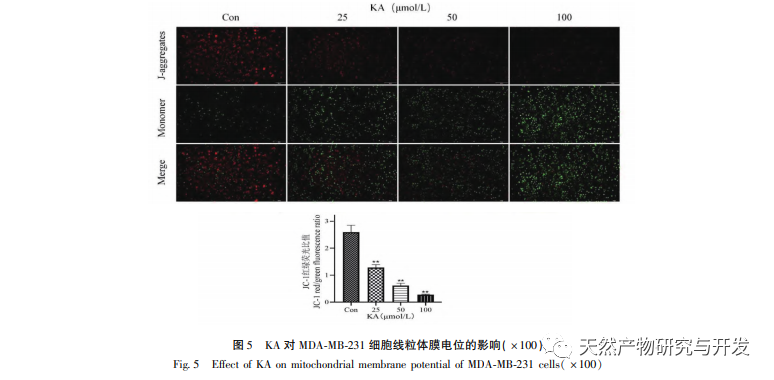
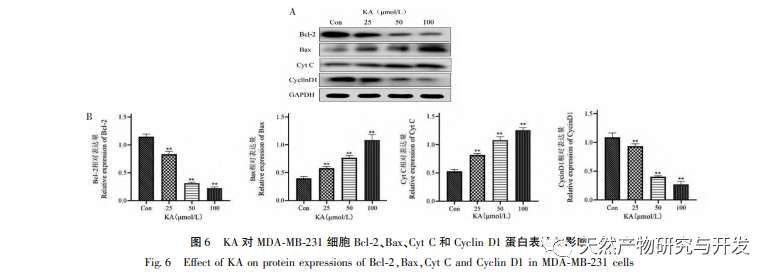
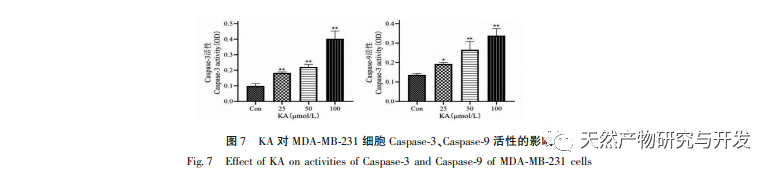
Исходя из этого, в данном эксперименте изучается механизм индукции апоптоза KA на клетках MDA-MB-231. В настоящее время исследования показали, что клеточный апоптоз в основном включает три пути, основанные на процессе инициации: митохондриальный путь, путь рецепторов смерти и путь эндоплазматического ретикулума, и митохондриальный путь играет важную роль в опосредовании клеточного апоптоза. Мембранный потенциал митохондрий - один из лучших показателей, отражающих проницаемость внутренней мембраны митохондрий. Снижение мембранного потенциала митохондрий считается самым ранним событием в каскадной реакции клеточного апоптоза. Как только потенциал митохондриальной мембраны снижается, апоптоз клеток становится необратимым. Фенг и др. выделили арабиногалактан из Artemisia scoparia, который может убивать клетки носоглоточной карциномы человека CNE-2, вызывая потерю митохондриального мембранного потенциала. Данное исследование показало, что KA обладает эффектом снижения митохондриального мембранного потенциала в клетках MDA-MB-231, что позволяет предположить, что один из механизмов, с помощью которого каэмпферол ингибирует пролиферацию клеток и способствует апоптозу, может осуществляться через митохондриальный опосредованный апоптотический путь. Для дальнейшего изучения взаимосвязи между KA-индуцированным апоптозом клеток MDA-MB-231 и митохондриальным сигнальным путем апоптоза в данном исследовании определяли экспрессию Bcl-2, Bax, CytC, Cyclin D1, а также активность каспазы-3 и каспазы-9.
Семейство белков Bcl-2 включает антиапоптотический белок Bcl-2 и проапоптотический белок Bax. Являясь регуляторами целостности внешней мембраны митохондрий, они играют важную роль в регуляции митохондриального пути апоптоза. После получения апоптотического сигнала Bax в цитоплазме транслоцируется в митохондрии, а антиапоптотический белок Bcl-2 направляет высвобождение цитохрома С из митохондрий, способствуя самоактивации предшественника каспазы-9. Активированная каспаза-9 активирует каспазу-3, что в конечном итоге приводит к апоптозу клеток. Лю и др. обнаружили, что KA ингибирует пролиферацию клеток рака желчного пузыря человека и вызывает их апоптоз через митохондриальный путь апоптоза. В данном исследовании мы наблюдали, что KA повышает экспрессию Bax и снижает экспрессию Bcl-2 в клетках MDA-MB-231, способствуя высвобождению CytC в цитоплазму через митохондриальный путь апоптоза, что приводит к увеличению экспрессии. В то же время повышается проницаемость митохондриальной мембраны, снижается мембранный потенциал, высвобождаются преапоптотические факторы, запускающие последующую активацию каспазы-3 и каспазы-9, что в конечном итоге приводит к апоптозу клеток. Кроме того, апоптоз тесно связан с аномальной клеточной пролиферацией, а основной причиной клеточной пролиферации является нарушение клеточного цикла. Циклин D1, как важный регуляторный белок клеточного цикла, может способствовать переходу клеток из фазы G1 в фазу S, ускорять процесс клеточного цикла, а его повышение может вызвать аномальную пролиферацию клеток, индуцировать изменения мембранного потенциала митохондрий и привести к развитию опухоли. Результаты этого эксперимента показывают, что KA может снижать экспрессию связанных с апоптозом белков Cyclin D1 и Bcl-2 в клетках MDA-MB-231, уменьшать мембранный потенциал митохондрий, подавлять пролиферацию клеток и способствовать их апоптозу.
Таким образом, данное исследование позволило уточнить противораковый эффект каэмпферола на клетки тройного негативного рака молочной железы in vitro и его определенную безопасность, а также выяснить механизм индуцирования KA апоптоза клеток MDA-MB-231 через митохондриальный путь передачи сигнала апоптоза. В дальнейшем ингибирующий эффект KA на TNBC может быть дополнительно изучен в экспериментах in vivo, что обеспечит экспериментальную базу для разработки и клинического применения KA.
