Исследование ингибирующего действия алкалоида из листьев лотоса на путь гликолиза Akt/mTOR/4EBP1 и его антипролиферативного эффекта на клетки холангиокарциномы
Холангиокарцинома (ХКА) по анатомическому расположению делится на внепеченочную холангиокарциному (ВХК) и внутрипеченочную холангиокарциному (ВХК). Хотя на долю МТП приходится всего 10% - 20% случаев первичного рака печени, она очень коварна на ранних стадиях, имеет высокий процент послеоперационных рецидивов и плохой прогноз. В последние десятилетия уровень заболеваемости и смертности от МТП в Азии и даже в мире неуклонно растет. Программа химиотерапии первой линии при распространенном МТП чревата лекарственной устойчивостью и побочными реакциями после длительного применения, поэтому необходимо искать безопасные и эффективные терапевтические препараты.
Поиск природных лекарственных активных ингредиентов с противоопухолевым действием из растений и животных всегда был актуальным направлением исследований как на внутреннем, так и на международном уровне. Нуциферин (NUF) получают из высушенных листьев Nelumbo nucifera Gaertn, растения из семейства Nymphaeaceae. Он обладает определенной противоопухолевой активностью, но о его влиянии на клетки МТП сообщается редко. В данном исследовании изучено влияние алкалоида листьев лотоса на пролиферацию и процесс гликолиза клеток HuCCT1, а также предварительно исследован механизм его действия, что создает теоретическую основу для разработки безопасных и эффективных терапевтических препаратов для лечения МТП.
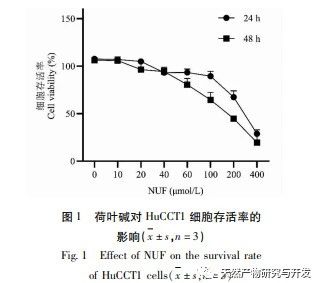
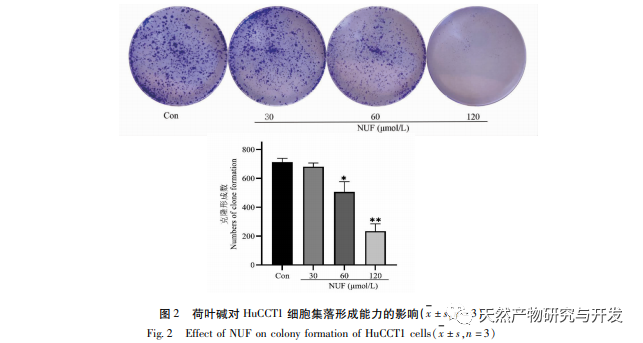
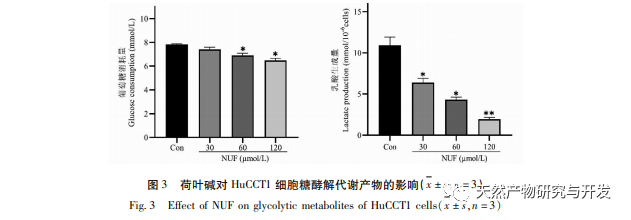
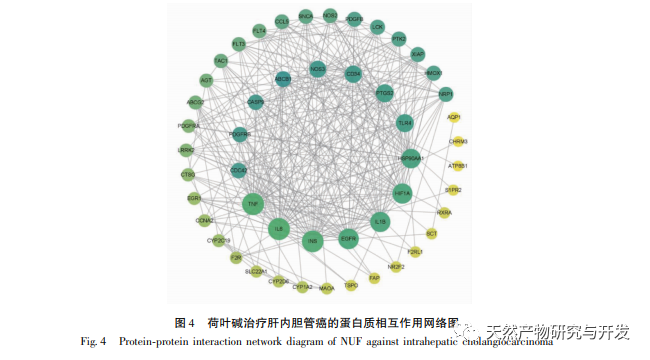
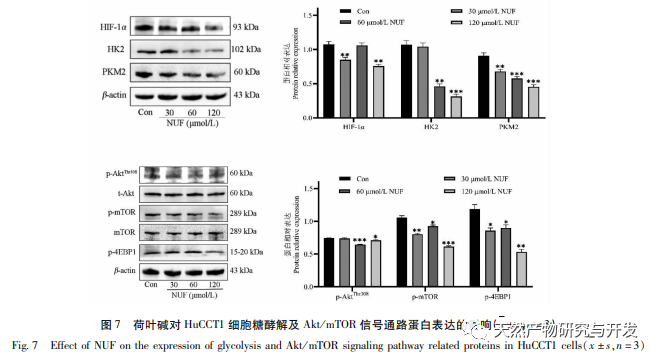
Современные фармакологические исследования показывают, что активный компонент алкалоид, выделенный из листьев лотоса, обладает определенным антиротационным действием на многие опухолевые клетки, такие как рак печени, рак легких, рак молочной железы, и может повысить их чувствительность к химиотерапевтическим препаратам. Данное исследование показало, что определенная концентрация алкалоида из листьев лотоса может значительно подавлять пролиферацию клеток HuCCT1 in vitro и положительно коррелирует с уменьшением потребления глюкозы и выработки лактата. Углеводы являются важными источниками энергии для жизнедеятельности клеток, а эффект Варбурга указывает на то, что даже в нормальных условиях кислорода раковые клетки предпочитают получать энергию за счет гликолиза, а не аэробных метаболических путей. Высокий уровень гликолиза может быстро обеспечить энергией рост раковых клеток, а его продукты, такие как пировиноградная и молочная кислоты, служат сырьем для синтеза веществ раковых клеток и способствуют метастазированию и инвазии раковых клеток. Поэтому можно предположить, что ингибирование пролиферации клеток HuCCT1 алкалоидами листьев лотоса связано с их ингибированием клеточного метаболизма гликолиза.
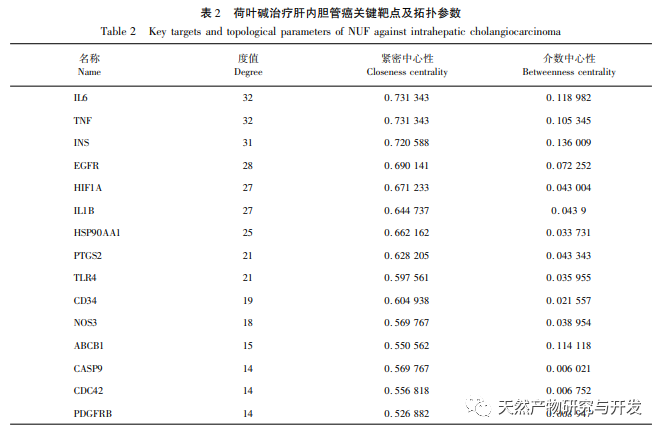
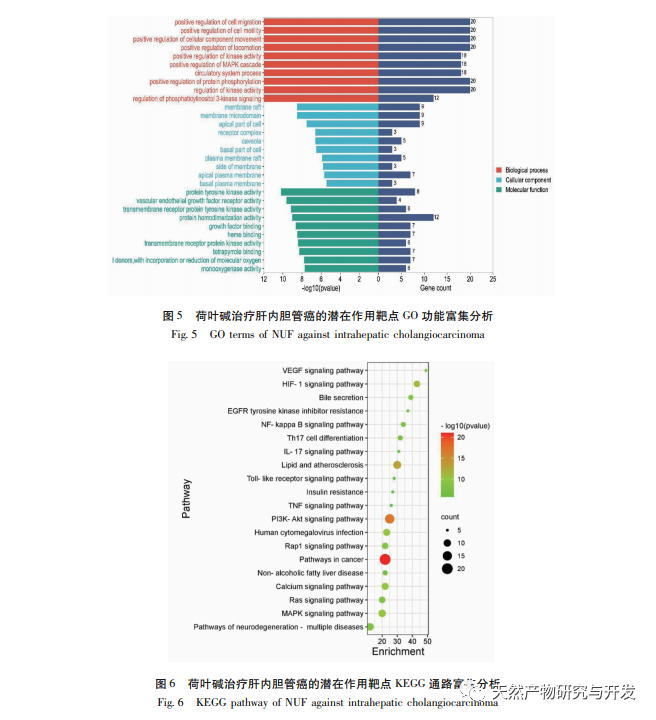
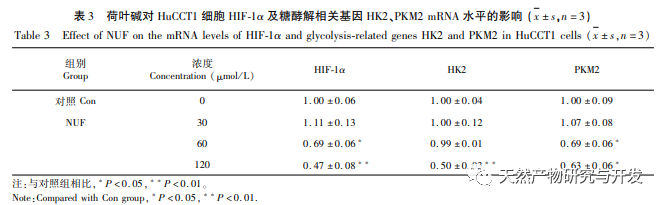
Анализ сетевой фармакологии выявил высокую корреляцию между матрином и HIF-1 α, а также такими мишенями, как TNF, INS, EGFR и др. HIF-1 α участвует во многих процессах, таких как метаболизм глюкозы, клеточная пролиферация, инвазия и метастазирование, воспалительная реакция в опухолевых клетках. Он может активировать активность транспортера глюкозы (GLUT) и различных гликолитических ферментов, таких как HK2, PKM2 и киназа пируватдегидрогеназы 1 (PDK1), и непосредственно участвовать в процессе гликолиза, значительно способствуя прогрессии опухоли. Гексокиназа (HK) и пируваткиназа (PK) - две ключевые киназы в процессе гликолиза, регулирующие начальную и конечную стадии процесса соответственно. В ходе исследования было установлено, что уровень мРНК и экспрессия белка HIF-1 α и ключевых гликолитических ферментов HK2 и PKM2 в клетках постепенно снижались при увеличении концентрации алкалоида листьев лотоса. Таким образом, можно предположить, что алкалоид листьев лотоса может влиять на процесс гликолиза в клетках HuCCT1 путем снижения активности HIF-1 α.
HIF-1 - это тип транскрипционного фактора, на который клетки реагируют в условиях низкого содержания кислорода или гипоксии, состоящий из двух субъединиц: Остаток пролина HIF-1 α и HIF-1 β. В нормоксических условиях остаток пролина HIF-1 α подвержен гидроксилированию и связывается со своей молекулой настройки (von Hippel Lindau, pVHL), которая затем деградирует путем убиквитинирования. В условиях низкого содержания кислорода активность белков, содержащих пролил-гидроксилазный домен (PHD), снижается, что приводит к значительному накоплению HIF-1 α, который затем мигрирует в ядро и образует димер с HIF-1 β. Затем димер связывается с элементом гипоксического ответа (HRE), способствуя транскрипции генов-мишеней HIF-1. Кроме того, HIF-1 α может активироваться и независимым от кислорода образом, например, сигнальный каскад PI3K/Akt/mTOR может стимулировать транскрипцию и трансляцию HIF-1 α путем нарушения целостности эукариотического фактора инициации трансляции 4E (eIF4E), связывающего белок 1 (4EBP1). Некоторые ученые называют механизм активации этого независимого от кислорода сигнала HIF-1 α "псевдогипоксией". В данном исследовании KEGG-анализ показал, что матрин действует на потенциальные пути МТП, при этом значительно усиливается сигнальный путь PI3K/Akt. Иммуноблотинг показал, что матрин может снижать уровни фосфорилирования белков mTOR и 4EBP1 в клетках HuCCT1, а общий уровень белка p-AktTrr308 имеет тенденцию к снижению, что позволяет предположить, что снижение уровня транскрипции и трансляции HIF-1 α под действием матрина может быть связано с ингибированием сигнального пути Akt/mTOR/4EBP1.
Многочисленные исследования показали, что помимо индукции апоптоза опухолевых клеток in vitro, ингибирования инвазии и метастазирования, блокирования их различных циклов, алкалоиды листьев лотоса способны задерживать рост эктопических пересаженных опухолей у мышей nude и оказывать значительное противоопухолевое действие. Основной механизм связан с регулированием алкалоидами листьев лотоса экспрессии белков, связанных с клеточным циклом и апоптозом, прямым нацеливанием на конкретные гены, ингибированием сигнальных путей, таких как PI3K Akt, Wnt/β - катенин, SOX2 Akt, STAT3 и TLR4/NF - κ B. В ходе данного исследования было предварительно установлено, что алкалоиды листьев лотоса подавляют пролиферацию клеток внутрипеченочной холангиокарциномы, возможно, за счет подавления процесса клеточного гликолиза, регулируемого сигнальным путем Akt/mTOR/4EBP1. На следующем этапе исследований будет изучена внутренняя логическая связь между ними, чтобы выяснить механизм анти ICC алкалоидов листьев лотоса и обеспечить теоретическую основу для глубокого развития ресурсов листьев лотоса и их клинического применения.
