Изучение регуляторного влияния хонокиола на HIF-1 α - VEGF путь в клетках PC12 на основе сетевой фармакологии и клеточных экспериментов
Магнолия лекарственная, как препарат, регулирующий Ци, способный высушивать сырость, устранять мокроту и снимать избыток Ци, в последние годы широко изучается как на внутреннем, так и на международном уровне. Основные компоненты Magnolia officinalis и магнолол представляют собой класс высокобиоактивных фенольных соединений с минимальной токсичностью и такими фармакологическими эффектами, как противовоспалительный, болеутоляющий, противоопухолевый и противопатогенный микроорганизмам. Фенол хоупо может проникать в центральную нервную систему через гематоэнцефалический барьер и оказывать прямое воздействие на нервную ткань, что делает его перспективным препаратом для лечения неврологических заболеваний; с другой стороны, хонокиол также оказывает терапевтическое воздействие на различные виды рака, такие как рак желудка, рак легких, рак печени и рак поджелудочной железы.
Активация экспрессии HIF-1 α может способствовать ангиогенезу, нейропротекции и восстановлению нейронов, тем самым леча ишемию головного мозга у крыс. Кроме того, HIF-1 является ключевым фактором в регуляции опухолевого ангиогенеза, а магнолол подавляет экспрессию HIF-пути и опосредованных гипоксией проангиогенных генов в большинстве опухолей и ишемических заболеваниях сетчатки. Приведенные выше исследования показывают, что регулирование HIF-1 α магнололом в различных состояниях является ключевым механизмом его фармакологического действия. Данное исследование берет "HIF-1 α" в качестве отправной точки и использует сетевую фармакологию и экспериментальную проверку для изучения регуляторных эффектов магнолола на HIF-1 α - VEGF-путь в клетках PC12 в нормоксических и гипоксических условиях.
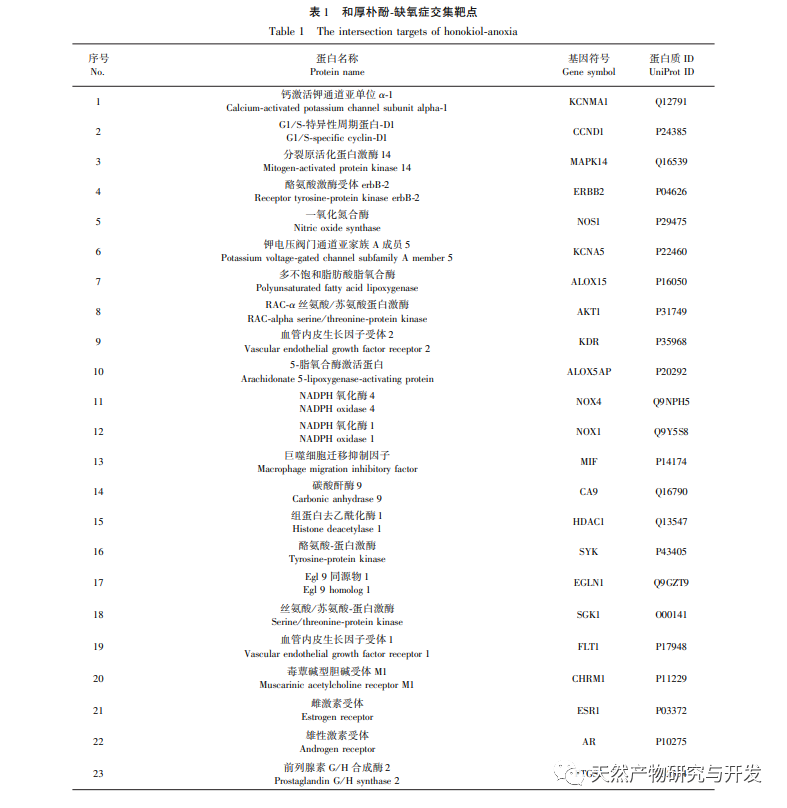
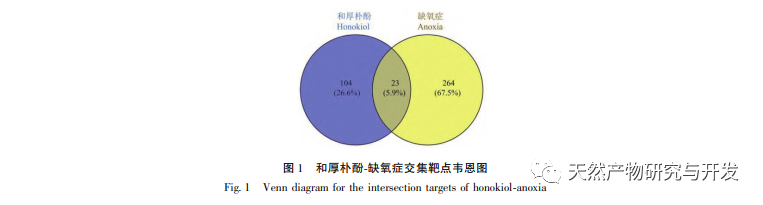
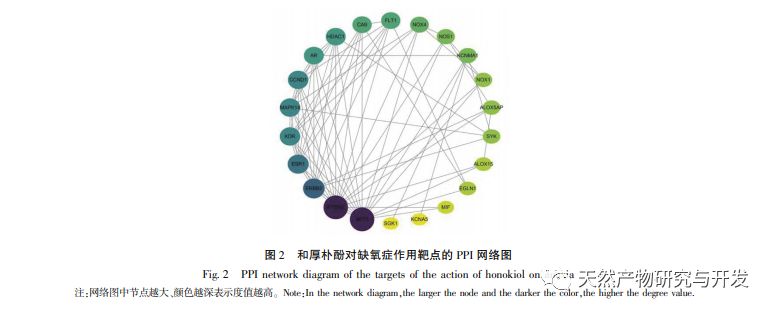
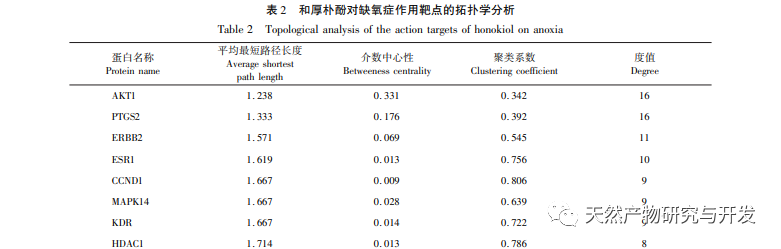
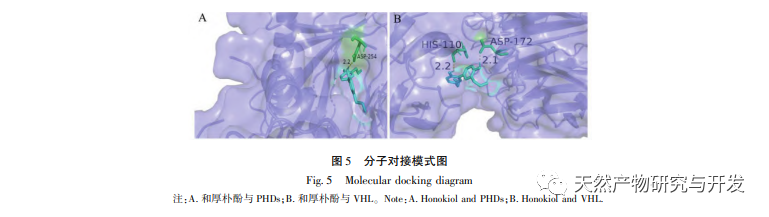
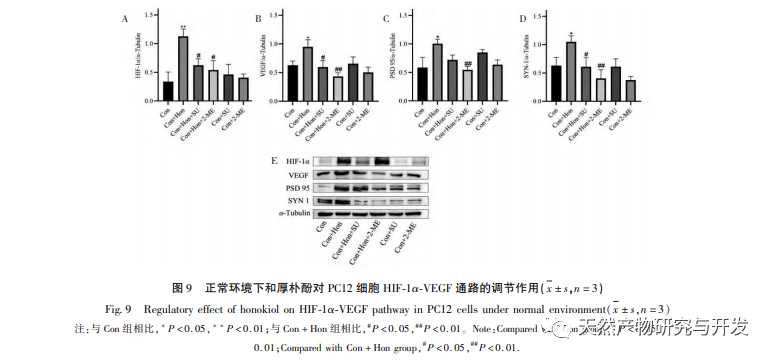
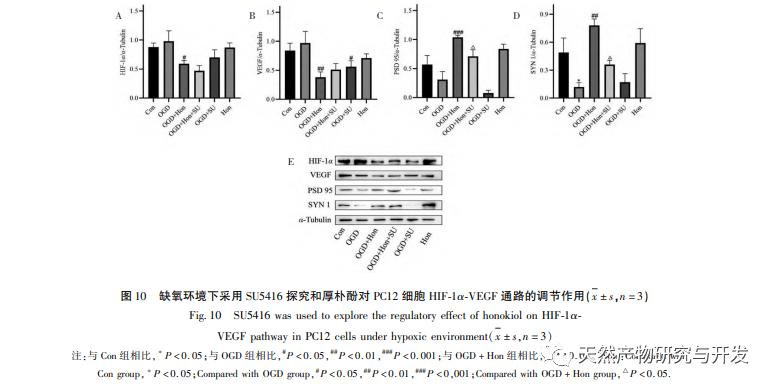
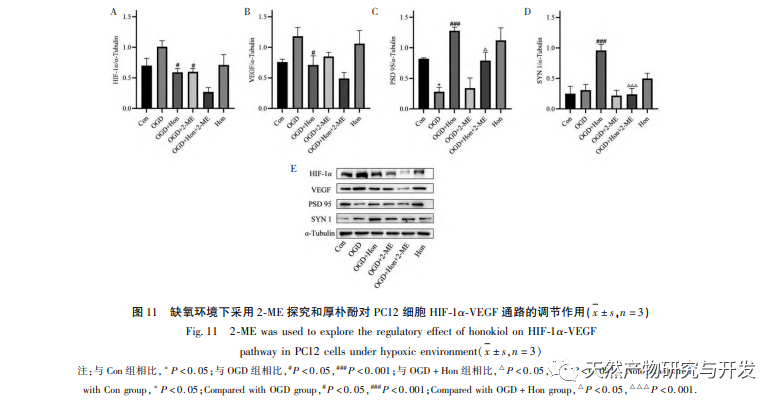 В нормоксических условиях экспрессия HIF-1 α и VEGF низкая, но введение магнолола значительно повышает экспрессию белков HIF-1 α и VEGF; в гипоксических условиях экспрессия HIF-1 α и VEGF высокая, а введение хонокиола значительно ингибирует экспрессию HIF-1 α и VEGF. Хонокиол проявляет различные регуляторные эффекты на HIF-1 α и VEGF в разных состояниях, что имеет большое значение для изучения его фармакологического механизма и развития его применения. Что касается того, как хонокиол влияет на образование и деградацию HIF-1 α, результаты молекулярного докинга в этом исследовании показали, что хонокиол обладает хорошей связывающей активностью с двумя ферментами деградации, PHDs и VHL. Однако мы до сих пор не можем понять, активируется или ингибируется конкретный фермент деградации, что также является направлением, которое необходимо изучить в будущем.
В нормоксических условиях экспрессия HIF-1 α и VEGF низкая, но введение магнолола значительно повышает экспрессию белков HIF-1 α и VEGF; в гипоксических условиях экспрессия HIF-1 α и VEGF высокая, а введение хонокиола значительно ингибирует экспрессию HIF-1 α и VEGF. Хонокиол проявляет различные регуляторные эффекты на HIF-1 α и VEGF в разных состояниях, что имеет большое значение для изучения его фармакологического механизма и развития его применения. Что касается того, как хонокиол влияет на образование и деградацию HIF-1 α, результаты молекулярного докинга в этом исследовании показали, что хонокиол обладает хорошей связывающей активностью с двумя ферментами деградации, PHDs и VHL. Однако мы до сих пор не можем понять, активируется или ингибируется конкретный фермент деградации, что также является направлением, которое необходимо изучить в будущем.
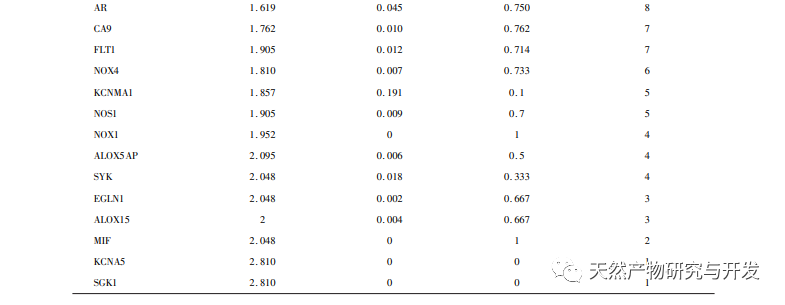
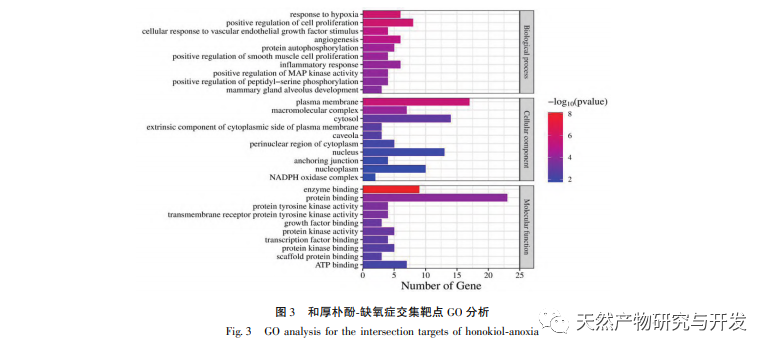
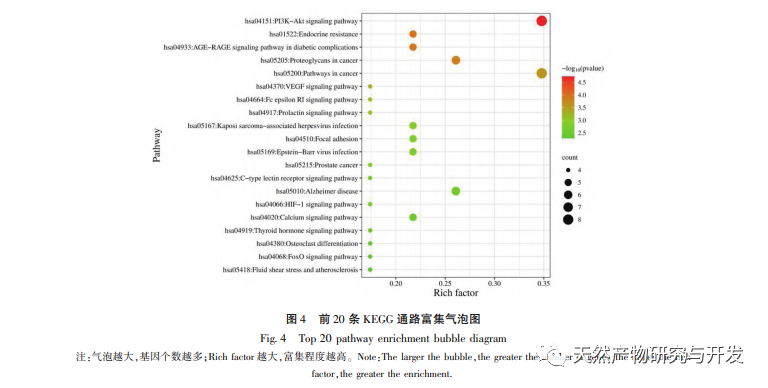
Сетевая фармакология - это исследование, проводимое с помощью методов системной биологии, которое может облегчить идентификацию лекарственных мишеней и широко применяется для прогнозирования активных ингредиентов и механизмов действия в традиционной китайской медицине. Например, исследование обобщило механизм сетевой регуляции традиционной китайской медицины при лечении антидепрессантами, и результаты показали, что традиционная китайская медицина оказывает антидепрессивное действие через "многоцелевой мультипуть", регуляцию "нейроэндокринно-иммунной сети" и сигнального пути PI3K Akt. В исследованиях сетевой фармакологии противоопухолевого действия традиционной китайской медицины сообщается, что традиционная китайская медицина оказывает противоопухолевое действие через противовоспалительный, противоиммунный, противоангиогенный, энергетический метаболизм и другие механизмы. Кроме того, некоторые ученые обнаружили, что традиционная китайская медицина способствует росту и пролиферации нервных клеток и подавляет апоптоз клеток, регулируя PI3K Akt путь, HIF-1 путь и TNF путь, тем самым играя определенную регуляторную роль в гипоксии. Результаты анализа GO-богатства включают реакции на гипоксию, клеточные реакции на стимуляцию фактором роста эндотелия сосудов, воспалительные реакции и другие биологические процессы, которые могут быть связаны со сложным патогенезом гипоксии. Это указывает на то, что хонокиол может вмешиваться в возникновение и развитие заболеваний на нескольких уровнях и путях. Результаты анализа обогащения KEGG включают путь HIF-1, путь VEGF, путь PI3K Akt и т.д. Путь PI3K Akt может регулировать связанные белки через фосфорилирование, тем самым способствуя росту клеток и подавляя апоптоз. Путь HIF-1 может изменять экспрессию генов, улучшая способность организма к снабжению кислородом и увеличивая кровоснабжение для адаптации к ишемической и гипоксической среде. VEGF является геном-мишенью HIF-1 α. В условиях гипоксии он может стимулировать выработку и стабилизацию HIF-1 α и инициировать транскрипцию VEGF, что приводит к увеличению экспрессии VEGF. Ниже мы сосредоточимся на обсуждении депрессии, церебральной ишемии и опухолевых заболеваний.
Активация сигнального пути HIF-1 α - VEGF играет важную роль в развитии синаптической пластичности и эффективном обращении вспять депрессивноподобного поведения и нарушений памяти в CUMS. Среди них гипоксия индуцибельный фактор-1 (HIF-1) - транскрипционный фактор, реагирующий на гипоксию. Являясь клеточным кислородным рецептором, он представляет собой гетеродимер, состоящий из нестабильных альфа- и бета-субъединиц, широко экспрессирующихся в клетках человека. Исследования показали, что гипоксическое прекондиционирование (ГП) может увеличить экспрессию HIF-1 α в гиппокампе, паравентрикулярном ядре гипоталамуса и неокортексе крыс. Имеются сообщения о том, что прерывистая гипоксия (ПГ) может стимулировать ангиогенез и нейрогенез в гиппокампе, а также улучшать нарушения памяти мозга. Таким образом, сигнальный путь HIF-1 α является перспективной потенциальной мишенью для лечения депрессии. Сосудистый эндотелиальный фактор роста (VEGF) обладает высокой специфичностью для эндотелиальных клеток и способен оказывать нейротрофическое и нейропротекторное действие в центральной нервной системе. Исследования показали, что VEGF влияет на синаптическую пластичность нейронов и может способствовать росту аксонов и нейрогенезу. VEGFR-2 (KDR) - рецептор клеточной поверхности для VEGF, который играет роль в обучении и памяти, опосредуя долгосрочное усиление, повышение пластичности и улучшение когнитивных функций через свой рецептор VEGFR-2. Таким образом, активация сигнального пути HIF-1 α - VEGF является одной из наиболее изученных стратегий улучшения депрессивноподобного поведения. Кроме того, в нервных клетках путь PI3K Akt может регулировать пролиферацию и дифференцировку нервных клеток, а также участвовать в регуляции мозгового кровотока и способствовать выживанию нейронов, что тесно связано с возникновением и развитием депрессии. Патогенез депрессии связан с нарушением синаптической пластичности. Изменения синаптической пластичности тесно связаны с экспрессией синаптических белков. PSD95 относится к семейству белков постсинаптического плотного материала (PSD), которые могут регулировать синаптическую передачу и синаптическую функцию. SYN1 - специфический маркерный белок для синаптических везикул, который может отражать количество, плотность и распределение синапсов. PSD95 и SYN1 играют важнейшую роль в обеспечении передачи сигнала и синаптической пластичности, а некоторые антидепрессанты могут значительно усиливать синаптическую пластичность. Это согласуется с результатами 2.8 и 2.9, где хонокиол может повышать уровни белков PSD95 и SYN1 для усиления синаптической пластичности в клетках PC12.
Улучшение неврологических функций крыс с фокальной ишемией головного мозга может быть связано с повышением экспрессии сигнального пути HIF-1 α - VEGF и формированием синаптической пластичности после ишемии головного мозга. Ученые установили, что механизм защиты мозга связан с увеличением экспрессии HIF-1 α и его нижележащих целевых генов VEGF и EPO. Механизм улучшения ишемии головного мозга, вызванной высотной гипоксией, также связан с повышением регуляции пути HIF-1 α. Активация PI3K Akt-пути также может улучшить неврологический дефицит и оказать нейропротекторное действие на крыс с ишемически-реперфузионным повреждением головного мозга. Кроме того, сигнальный путь HIF-1 α - VEGF играет важную роль в возникновении и развитии опухолей, особенно опухолей центральной нервной системы. Исследования показали, что хонокиол подавляет пролиферацию клеток глиомы за счет снижения экспрессии HIF-1 α и его целевых генов VEGF и GLUT1. В экспериментах на животных некоторые ученые использовали мышей nude для создания модели твердой опухоли из клеток рака толстой кишки человека. После перорального приема магнолол значительно подавляет рост опухоли, а механизм его действия связан с ингибированием HIF-1 α - VEGF-пути и PI3K Akt-пути.
Таким образом, магнолол оказывает различное регулирующее воздействие на сигнальный путь HIF-1 α - VEGF в нормальных и гипоксических условиях. Магнолол может лечить депрессию, церебральную ишемию и опухолевые заболевания через множество путей и мишеней, что дает направление для дальнейших исследований механизма действия магнолола в лечении этих заболеваний. Кроме того, были обнаружены предсказанный угол молекулярной стыковки и хорошая стыковка между хонокиолом и ферментом, разрушающим HIF-1 α. Это исследование будет продолжено для изучения того, как хонокиол влияет на HIF-1 α с помощью молекулярной биологии и других методов.
