Исследование ингибирующего действия акацетина J8 на мишени пролиферации эндотелиальных клеток и сигнальные пути клеток, связанные с апоптозом, на основе молекулярного докинга
Кора акации - это высушенная кора бобового растения Albizia julibrissin Durazz. Она обладает сладким и мягким вкусом, а в фармакопее записано, что она снимает депрессию, успокаивает ум, способствует циркуляции крови и уменьшает отеки. В основном его используют для лечения таких симптомов, как беспокойство, депрессия, бессонница, абсцесс легких, язвы и боль, вызванная падениями. Современные фармакологические исследования показали, что сырые экстракты и общие сапонины коры акации обладают активностью ингибирования пролиферации опухолевых клеток in vivo и in vitro. Известные врачи, такие как Чжу Лянчунь, добились хороших клинических результатов в лечении рака легких с помощью таких препаратов, как кора акации. Под руководством антиопухолевой активности ангиогенеза, в предварительной работе данного проекта были выделены и очищены эффективные компоненты и активные ингредиенты, которые ингибируют опухолевый ангиогенез из коры акации, и идентифицировано их активное вещество как юлиозид J8 (J8). Результаты исследования показали, что J8 обладает значительной ингибирующей активностью в отношении пролиферации эндотелиальных клеток. Кроме того, он может вызывать апоптоз клеток. Однако до сих пор неясно, как он регулирует передачу сигнала извне клетки и через клеточную мембрану, цитоплазму в ядро, чтобы оказать свое воздействие, и нет никаких отчетов об исследованиях в стране и за рубежом. В данном исследовании использовался молекулярный докинг в сочетании с экспериментами на клетках in vitro для анализа целей ингибирующего действия J8 на пролиферацию эндотелиальных клеток и связанных с апоптозом клеточных сигнальных путей.
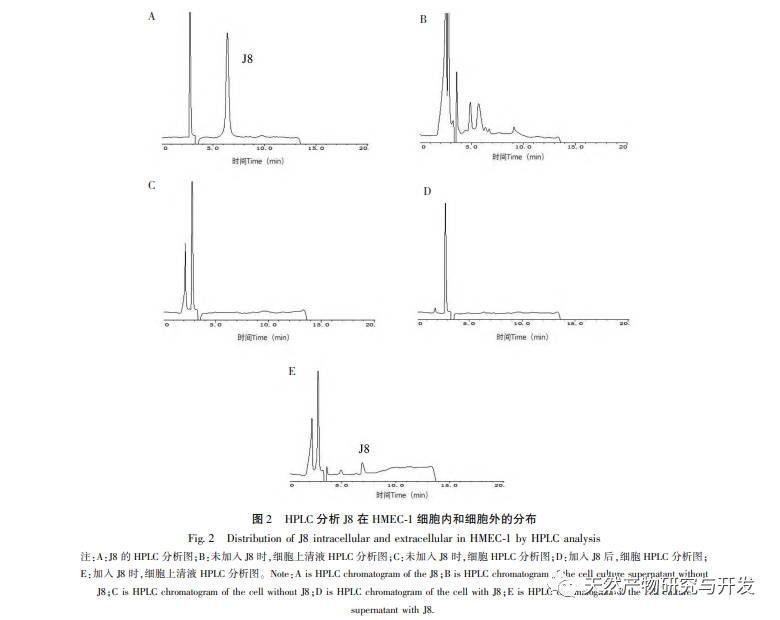
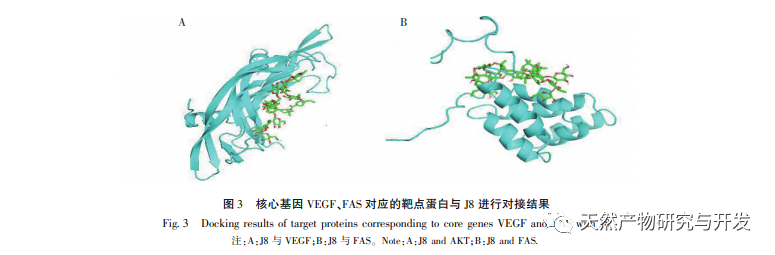
 J8 - это сапонин, выделенный из коры акации. Предыдущие исследования показали, что он оказывает ингибирующее действие на опухолевый ангиогенез как in vitro, так и in vivo, и может вызывать апоптоз эндотелиальных клеток. Однако путь, по которому он индуцирует апоптоз клеток, не совсем ясен. Чтобы изучить механизм J8-индуцированного апоптоза эндотелиальных клеток, была подготовлена новая партия образцов с использованием методов экстракции, выделения и идентификации, описанных в литературе, и определена их активность. Для изучения механизма действия J8 на клетки, попадает ли J8 внутрь клеток или взаимодействует с поверхностными белками на клеточной мембране, использовали ВЭЖХ для определения концентрации J8 внутри и снаружи клетки. Результаты показали, что J8 не проникает внутрь эндотелиальных клеток и взаимодействует только с поверхностными белками на клеточной мембране. Для дальнейшего изучения его взаимодействия с определенными белками в эксперименте сначала использовали молекулярный докинг для стыковки с мембранными белками FAS, FAS и FAS, которые связаны с апоптозом DR3、DR4、DR5、TFR-1, И было обнаружено, что J8 хорошо связывается только с FAS и VEGF, которые являются белками, связанными с пролиферацией клеток.
J8 - это сапонин, выделенный из коры акации. Предыдущие исследования показали, что он оказывает ингибирующее действие на опухолевый ангиогенез как in vitro, так и in vivo, и может вызывать апоптоз эндотелиальных клеток. Однако путь, по которому он индуцирует апоптоз клеток, не совсем ясен. Чтобы изучить механизм J8-индуцированного апоптоза эндотелиальных клеток, была подготовлена новая партия образцов с использованием методов экстракции, выделения и идентификации, описанных в литературе, и определена их активность. Для изучения механизма действия J8 на клетки, попадает ли J8 внутрь клеток или взаимодействует с поверхностными белками на клеточной мембране, использовали ВЭЖХ для определения концентрации J8 внутри и снаружи клетки. Результаты показали, что J8 не проникает внутрь эндотелиальных клеток и взаимодействует только с поверхностными белками на клеточной мембране. Для дальнейшего изучения его взаимодействия с определенными белками в эксперименте сначала использовали молекулярный докинг для стыковки с мембранными белками FAS, FAS и FAS, которые связаны с апоптозом DR3、DR4、DR5、TFR-1, И было обнаружено, что J8 хорошо связывается только с FAS и VEGF, которые являются белками, связанными с пролиферацией клеток.
Фактор роста эндотелия сосудов VEGF - это высокоспецифичный проэндотелиальный фактор роста, способствующий пролиферации эндотелиальных клеток, их миграции, повышению проницаемости сосудов и ангиогенезу. Ингибирование активности VEGF может значительно подавить образование опухолевых кровеносных сосудов, тем самым достигая терапевтической цели противоопухолевого лечения. По литературным данным, общие сапонины из коры акации могут значительно подавлять образование опухолевых кровеносных сосудов и подавлять активность VEGF. J8 является одним из сапонинов, а молекулярная стыковка и молекулярное определение in vitro показали, что J8 может связываться с VEGF, тем самым подавляя пролиферацию эндотелиальных клеток.
Современные исследования в области молекулярной и клеточной фармакологии свидетельствуют о том, что сигнальная трансдукция клеточного апоптоза может быть разделена на два пути: экзогенный и эндогенный (митохондриальный). Экзогенный путь апоптоза опосредован рецепторами апоптоза, такими как TNF-a, TRAIL, FAS-L. Fas-L связывается с FAS, рекрутируя и подключая FADD, чтобы инициировать апоптоз клеток. Митохондрии являются центром регуляции эндогенного клеточного апоптоза, который можно разделить на каспазозависимый и некаспазозависимый апоптотические сигнальные пути, основанные на различных сигнальных путях. Связывание FADD с каспазой-8 может привести к димеризации каспазы-8, то есть к ее активации. Активированная каспаза-8 реактивирует каспазу-3/9, вызывая апоптоз клеток. Некаспазозависимый апоптотический сигнальный путь осуществляется в основном за счет высвобождения AIF и EnDOG, которые могут вызывать большое количество фрагментации ДНК и индуцировать апоптоз клеток. В результате экспериментальной проверки было установлено, что после добавления J8 (2,5 мкг/мл) в клетки HUVEC экспрессия VEGF, JNK и других белков значительно снижалась, а экспрессия белков, связанных с апоптозом, p-JNK, Bax и EnDOG значительно повышалась. J8 не оказывал существенного влияния на уровни экспрессии каспазы-3, каспазы-8 и каспазы-9, а также способствовал фосфорилированию JNK, активируемой стрессом протеинкиназы. Активированный JNK-путь может регулировать экспрессию генов-мишеней, связанных с апоптозом, тем самым индуцируя апоптоз клеток. Bax и EnDOG являются целевыми генами JNK-пути. После обработки J8 уровень их экспрессии также повышается, что позволяет предположить, что J8 может вызывать гибель клеток, ослабляя активность VEGF/JNK-пути. Результаты данного исследования позволяют предположить, что J8 может способствовать апоптозу сосудистых эндотелиальных клеток, регулируя сигнальный путь JNK, что дает идеи для будущих исследований других ученых и предлагает новые препараты для терапии ингибирования опухолевого ангиогенеза. Однако данное исследование также имеет определенные недостатки, и в будущих исследованиях необходимо всестороннее определение белков, расположенных выше и ниже по течению от сигнального пути JNK. Эксперименты на клетках in vitro могут иметь определенные отклонения, и экспериментальные результаты должны быть подтверждены в клинических экспериментах и экспериментах на животных.
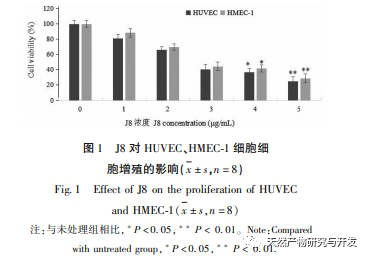
Таким образом, J8 может подавлять пролиферацию клеток, воздействуя на VEGF, а регулирование сигнального пути JNK способствует апоптозу эндотелиальных клеток сосудов, причем скорость апоптоза значительно возрастает с увеличением концентрации.
