Изучение механизма действия эмодина при лечении острого повреждения почек, связанного с сепсисом, на основе анализа данных и экспериментальной проверки
Сепсис - это угрожающая жизни дисфункция органов, вызванная дисбалансом в реакции организма на инфекцию. Почки - один из наиболее часто поражаемых органов при сепсисе, а сепсис-ассоциированное острое повреждение почек (ОППП) часто становится непосредственной причиной смерти пациентов с сепсисом, причем смертность высока и ставит перед клиническими врачами беспрецедентные задачи. АКИ сохраняется и повышает потенциальный риск развития хронической болезни почек (ХБП). Выжившие пациенты часто неизбежно прогрессируют до конечной стадии болезни почек (ESRD), что представляет серьезную угрозу для качества их жизни и безопасности.
К сожалению, в настоящее время возможности профилактики и лечения СА-АКИ весьма ограничены. Активная жидкостная терапия не имеет надежной доказательной базы и даже может быть вредной. Использование вазоактивных препаратов для поддержания артериального давления требует баланса между большим кровообращением и микроциркуляцией, и нет единого мнения о том, насколько необходимо поддерживать целевой уровень артериального давления, чтобы помочь предотвратить возникновение АКИ. Если почечная профилактика не помогает, для лечения необходимо использовать заместительную почечную терапию (ЗПТ), но оптимальные сроки и метод проведения ЗПТ не ясны. Если пациенты с SA-AKI выживают, хотя функция почек у большинства из них восстанавливается, мало что известно о механизмах восстановления почек или их недостаточности, а также о пожизненном риске прогрессирования ЦП и ESRD. До сих пор не существует определенного и надежного препарата для лечения АКИ. Традиционные клинические меры лечения в основном заключаются в замене почки и симптоматическом комплексном лечении. Восстановление функции почек зависит от надежной поддержки самой почки в организме в целом. Поэтому поиск препаратов или мер, способных эффективно предотвратить или своевременно лечить СА-АКИ, избежать возникновения хронического заболевания почек или способствовать их восстановлению, имеет важное клиническое значение для снижения смертности пациентов с сепсисом и улучшения качества жизни выживших пациентов.
Эмодин - это природное соединение, полученное из китайских трав, таких как ревень и Polygonum cuspidatum, которое обладает различными фармакологическими эффектами, такими как противовоспалительный, противовирусный и противоопухолевый. Предыдущие исследования подтвердили, что эмодин оказывает защитное действие на пациентов с сепсисом; недавние исследования показали, что эмодин обладает защитным действием против повреждений, вызванных окислительным стрессом, воспалением и апоптозом клеток. Однако до сих пор неясно, может ли эмодин улучшить прогноз пациентов с SA-AKI. В этом исследовании мы изучим ключевые гены, участвующие в патогенезе SA-AKI, с помощью баз данных, связанных с наукой о жизни, и проанализируем воспалительные сигнальные пути, вовлеченные в эти ключевые гены. Кроме того, были проведены эксперименты на животных, чтобы выяснить, влияет ли эмодин на воспалительный путь SA-AKI и его защитный эффект и механизм на крыс с SA-AKI, что даст новые идеи для его профилактики и лечения.



Исследования показали, что патогенез SA-AKI многофакторный и сложный, включающий взаимодействие между воспалением, микроциркуляторной дисфункцией и метаболическим перепрограммированием. Патофизиология включает в себя повреждение и дисфункцию множества типов клеток. В процессе сепсиса бактерии выделяют эндотоксины или эндотоксиноподобные вещества, которые активируют воспалительные клетки, такие как нейтрофилы, моноциты и эндотелиальные клетки в организме, высвобождая большое количество эндогенных медиаторов воспаления в кровоток. С одной стороны, это вызывает повреждение множества органов, включая почки, а с другой - активирует еще больше воспалительных клеток для участия в болезни, формируя злокачественный ответ иммунной сети. В модели SD крыс с липополисахаридом (LPS) - индуцированной SA-AKI, неролидол облегчает SA-AKI путем ингибирования NF - κ B и Toll-подобных рецепторов 4 (TLR4) сигнальных путей. Было подтверждено, что путь TLR4/NF - κ B вовлечен в процесс воспалительной реакции почек, а ингибирование TLR4/NF - κ B опосредованной воспалительной реакции оказывает защитное действие на LPS-индуцированный AKI. Как видно, воспалительный ответ является важным механизмом в патогенезе SA-AKI, а ингибирование пути воспалительного ответа - важным методом лечения сепсиса, что дает новые идеи для клинического лечения пациентов с SA-AKI.
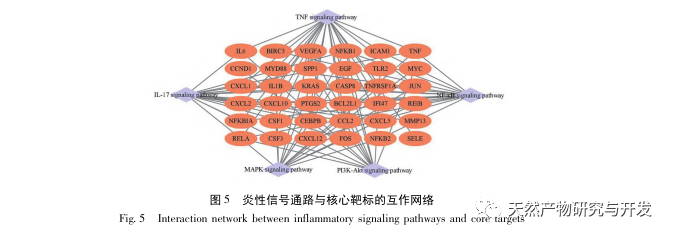
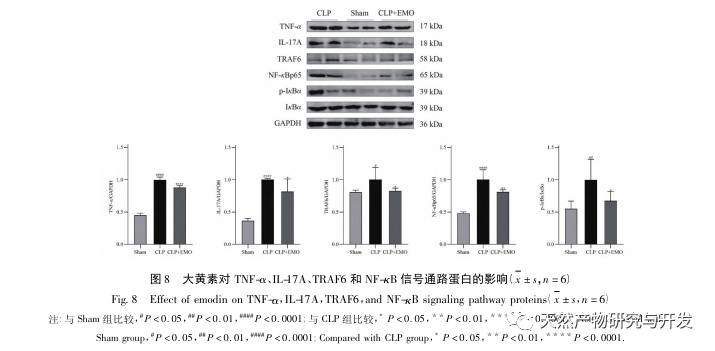
В данном исследовании использовалась биологическая база данных для анализа 2801 ключевой мишени, вовлеченной в патогенез SA-AKI. KEGG-анализ этих мишеней выявил в общей сложности 5 ключевых сигнальных путей воспалительной реакции, среди которых сигнальный путь TNF и сигнальный путь IL-17 занимали высокие позиции, а сигнальный путь NF - κ B служил узлом для участия обоих путей в патогенезе СА-АКИ. В сигнальном пути TNF, TNF - α является не только ключевым активатором сигнального пути NF - κ B, но также служит ответной молекулой сигнального пути NF - κ B, что предполагает, что он способствует развитию сигнального пути NF - κ B через положительную обратную связь, и эти два пути дополняют друг друга. В сигнальном пути IL-17 IL-17A является основным инициирующим фактором семейства IL-17, а клетки Th17 - основными секретирующими клетками. На модели индуцированного CLP было обнаружено, что IL-17A высоко экспрессируется в брюшной полости и играет ключевую роль в воспалительном ответе после тяжелого сепсиса. Нейтрализация IL-17A в брюшной полости может снизить выработку провоспалительных цитокинов. Между тем, исследования показали, что Toll-подобный рецептор 9 (TLR9) в дендритных клетках (ДК) может играть ключевую роль в развитии SA-AKI, опосредуя выработку IL-17A гамма-дельта Т-клетками; другие исследования показали, что нокаут IL-17A может предотвратить SA-AKI. Вышеизложенное свидетельствует о том, что TNF - α и IL-17A являются провоспалительными факторами при сепсисе, а сигнальный путь TNF и сигнальный путь IL-17 широко вовлечены в возникновение и развитие сепсиса, что согласуется с результатами анализа данных.
Было проведено множество исследований по лечению сепсиса эмодином, в основном на тканях мозга, крови, сердца, кишечника и легких. При сепсис-ассоциированной энцефалопатии (САЭ) эмодин может улучшать когнитивные нарушения и патологические повреждения, а также подавлять воспаление, вызванное CLP, у мышей за счет регуляции BDNF/TrkB-сигнализации. В кровеносной системе эмодин снижает уровень P-селектина, улучшает количество тромбоцитов и их агрегационную способность на поздней стадии сепсиса, повышает активность эндогенных факторов свертывания и функцию фибриногена, оказывая противовоспалительное действие. При септической кардиомиопатии было обнаружено, что эмодин может устранить сердечную дисфункцию и улучшить состояние миокарда у септических крыс, что может быть связано с его ингибированием активации инфламмасомы. При сепсисе, вызванном повреждением кишечника, эмодин может улучшить повреждение слизистой оболочки кишечника за счет снижения уровня воспалительных факторов и маркеров окислительного стресса, а механизм его действия может быть связан с VDR/Nrf2/HO-1 путем; и, повышая уровень экспрессии белка плотного соединения (TJ), он защищает целостность кишечного барьера и ингибирует проницаемость кишечного барьера. Помимо улучшения воспалительной реакции и барьерной функции кишечника, эмодин также может предотвратить перемещение кишечной палочки, предотвратить распространение и передачу бактерий, а также уменьшить вторичный вред, наносимый бактериями. При остром повреждении легких, связанном с сепсисом, эмодин может ингибировать пути NF - κ B и бокса 1 группы высокой подвижности (HMGB1), тем самым уменьшая легочный окислительный стресс и воспалительную реакцию. Другое исследование легких основано на пути аутофагии, и вмешательство эмодина может эффективно предотвратить прогрессирование острого повреждения легких. Более того, другие исследования показали, что эмодин может эффективно облегчить отек легочной ткани при остром повреждении легких, вызванном сепсисом, путем регулирования аквапорина (AQP), TJ, факторов воспаления и апоптоза клеток легких. Об изучении действия эмодина на SA-AKI пока не сообщалось. В ходе данного исследования было установлено, что у крыс модели CLP, получавших эмодин, наблюдалось снижение экспрессии TNF - α, IL-17 и IFN - γ в результатах ИФА, что соответствует ингибирующему действию эмодина на воспаление при сепсисе.
Также было выяснено влияние эмодина на воспалительную ось Th17/Treg. В исследовании острого панкреатита было обнаружено, что эмодин подавляет иммунный ответ при тяжелом остром панкреатите, регулируя соотношение IFN - γ/IL-17, тем самым облегчая дисфункцию кишечного барьера. А данное исследование показало, что при SA-AKI эмодин также может снижать экспрессию IL-17A и улучшать воспалительную реакцию.
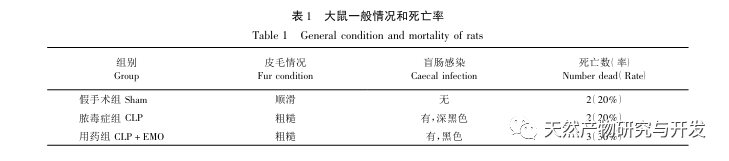
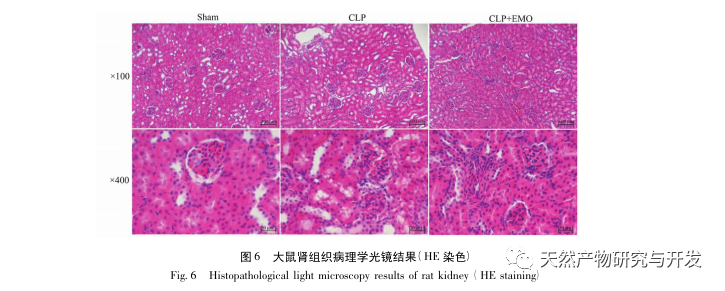
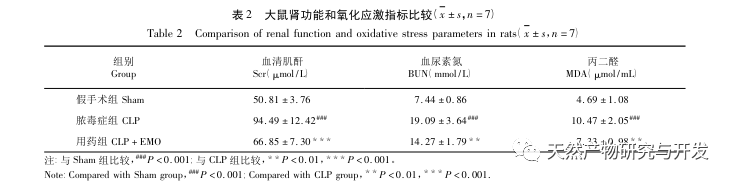
Таким образом, в ходе данного исследования с помощью анализа данных был выявлен 2801 ключевой ген, участвующий в патогенезе эмодзина. Анализ биологических процессов GO позволяет предположить, что биологические функции этих мишеней в основном включают трансдукцию мембранных сигналов, регуляцию сосудов и заживление ран. Анализ обогащения путей KEGG показал, что сигнальные пути TNF, IL-17, PI3K Akt, NF - κ B и MAPK были включены в сигнальные пути, связанные с воспалением. Экспериментальная проверка показала, что лечение эмодином улучшило функцию почек при SA-AKI, а уровни окислительного стресса (MDA) и воспалительных цитокинов (TNF - α, IL-17 и IFN - γ) снизились. Экспрессия белков IL-17A, TNF - α, TRAF6, NF - κ Bp65 и уровень фосфорилирования I κ B α были значительно снижены по сравнению с группой CLP, что согласуется с результатами анализа данных. Предполагается, что эмодин может улучшить SA-AKI у крыс, что может быть связано с сигнальными путями IL-17/NF - κ B и TNF/NF - κ B.
