Растительные экстракты широко используются в фармацевтике, пищевой промышленности, косметике, добавках, продуктах здравоохранения и других областях, поэтому перерабатывающие предприятия должны пройти соответствующую лицензирование квалификации в соответствии с их использованием или управлением отраслью или национальными правилами и т.д., которые условно делятся на следующие категории:
1, как сырье для лекарств, должны быть поданы;
2, для переработки в пищу необходимо получить лицензию на производство продуктов питания (SC), категории продуктов питания: твердые напитки, здоровая пища, пищевые добавки;
3, используемые в качестве кормовых добавок, должны получить лицензию на производство кормовых добавок;
4, экспортные продажи продукции, экспортные производственные предприятия должны быть поданы.
Во-вторых, в индустрии растительных экстрактов существует более 30 добровольных сертификатов, включая сертификацию системы (ISO), сертификацию продукции (Kosher, HALAL и т.д.), сертификацию производственных условий (GMP), сертификацию органических продуктов (China Organic Certification) и сертификацию лабораторий (CNAS, CMA).
Ниже приводится описание лицензий, необходимых для получения растительных экстрактов, используемых в фармацевтике, пищевой промышленности, косметике, медицинских препаратах и других областях.
Как экстракты китайской медицины
Основным органом подачи заявки на экстракт китайской медицины является производитель экстракта, который должен получить лицензию на производство лекарственных средств, содержащую объем производства экстрактов китайской медицины, соблюдать требования GMP и предоставлять продукты экстракта производителю pCm.
Информация о регистрации производителя экстракта китайской медицины должна включать:
1. Основная информация о предприятии и техническая информация об экстракте;
2, "Лицензия на производство лекарств", "Лицензия на ведение бизнеса" и другие подтверждающие документы;
3, производство экстрактов с китайскими травяными лекарствами, информация о таблетках китайской медицины, включая происхождение, основу, источник, реализацию
Стандарты, спецификации на кондитерские изделия и отчеты о проверке квалификации поставщиков и системы обеспечения качества производства;
4、 Подробный процесс производства экстрактов, включая дорожную карту процесса, ключевые параметры, основное оборудование и т.д.;
5, внутренние контрольные стандарты качества экстрактов или национальные фармацевтические стандарты экстрактов.
29 июля 2014 года Государственное бюро выпустило постановление Управления по контролю за фармацевтической и химической продукцией [2014] № 135 "Уведомление Управления по контролю за продуктами и лекарствами об усилении надзора и управления экстрактами и вытяжками в производстве традиционных китайских лекарственных средств", в котором содержится требование, что "экстракты китайской медицины, перечисленные в рецепте национального стандарта лекарственных средств для пКмс и с отдельным национальным стандартом лекарственных средств, должны быть реализованы для управления записями. " Запись успеха растительного экстракта предприятия должны быть в соответствии с требованиями GMP для организации производства, чтобы обеспечить качество своей продукции, и его повседневный надзор по месту нахождения провинциального (автономных районов и муниципалитетов) Управление по контролю за продуктами и лекарствами несет ответственность за.
В соответствии с требованиями уведомления существует 47 экстрактов китайской медицины, которые могут быть поданы на управление, то есть предприятие может производить свои собственные, также могут быть приобретены, другие должны быть добыты самим предприятием.
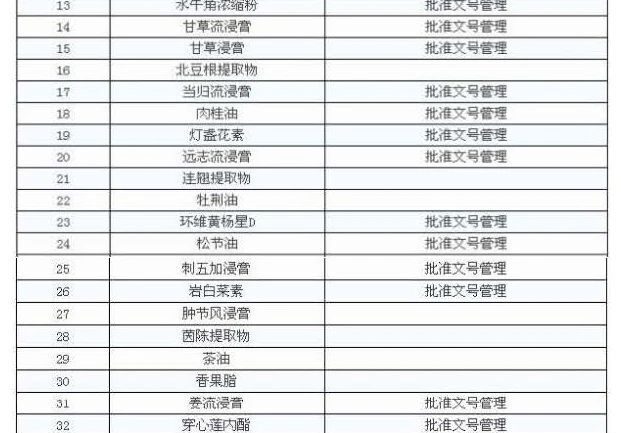
В качестве сырья для приготовления медицинских препаратов
Медицинские учреждения для приготовления препаратов должны иметь "лицензию медицинского учреждения на практику", и в соответствии со "стандартом управления качеством приготовления препаратов медицинского учреждения" получить "лицензию медицинского учреждения на приготовление препаратов", могут настраивать свои собственные препараты.
Административные меры по регистрации препаратов для медицинских учреждений (для проведения испытаний) предусматривают, что медицинские учреждения, подающие заявки на препараты, должны провести соответствующие доклинические исследования, включая проверку рецептов, процесс приготовления, показатели качества, фармакологические, токсикологические исследования и т.д. Китайские травяные лекарства, используемые в заявке на получение препаратов, должны иметь лицензию на практику в медицинских учреждениях. Китайские травяные препараты и таблетки традиционной китайской медицины, используемые в заявке на препарат, должны иметь номера одобрения лекарственных средств и соответствовать законодательным стандартам лекарственных средств. В методике также указано одно из следующих обстоятельств, при которых препарат не может быть заявлен в качестве препарата для медицинских учреждений:
1, на рынок поставляются различные сорта;
2、 Сорта, содержащие активные ингредиенты, не одобренные Государственным управлением по контролю качества пищевых продуктов и лекарственных средств;
3, помимо аллергенов, в дополнение к биологическим продуктам;
4, Инъекции китайской медицины;
5, Китайская медицина, химический состав сложного препарата;
6, наркотические средства, психотропные средства, токсичные средства для медицинского применения, радиоактивные средства.
Объявление о внедрении управления записями о применении традиционных методов приготовления китайских лекарственных препаратов медицинскими учреждениями гласит, что к традиционным китайским лекарственным препаратам относятся:
1, твердые (пилюли, дисперсии, даны, слитки и т.д.), полутвердые (мазь, паста и т.д.) и жидкие (тоники и т.д.) традиционные лекарственные формы, изготовленные из китайских лекарственных растений путем измельчения или только водной или масляной экстракции;
2, гранулы из китайских травяных лекарственных растений, экстрагированные водой, и капсулы из китайских травяных лекарственных растений, измельченные;
3, ликеры и настойки, изготовленные из китайских лекарственных трав, добытых традиционным способом.
Препараты традиционной китайской медицины, поданные медицинским учреждением, должны соответствовать объему диагностики и лечения, указанному в его "лицензии на практику в медицинском учреждении". Не допускается подача заявки при одном из следующих обстоятельств:
1, "Подготовка к мерам по управлению регистрацией медицинских учреждений (для пробного внедрения)" в соответствии с положениями обстоятельств не должна быть объявлена подготовкой медицинского учреждения;
2, и на рынке появилось множество различных лекарственных форм одного и того же рецепта;
3, частицы формулы китайской медицины;
Таким образом, сырьем для препаратов медицинских учреждений должны быть китайские травяные лекарства или таблетки китайской медицины, а не экстракты китайской медицины, и медицинские учреждения могут приобретать только препараты домашнего приготовления, которые были одобрены для учета сырья.
В качестве сырья для производства продуктов здорового питания
Меры по регистрации и подаче заявок на медицинские продукты питания, опубликованные в 2015 году, четко определяют, что CFDA запрещает заказную переработку экстрактов китайской медицины, и подача заявок на растительные экстракты стала новой тенденцией в развитии отрасли.
В конце 2016 года CFDA выпустило Правила пересмотра лицензий на производство продуктов здорового питания, которые дополнительно стандартизировали конкретные правила включения растительных экстрактов в производство продуктов здорового питания. Заявители, которые предоставляют другим предприятиям растительные и животные экстракты в качестве сырья для производства здорового питания, должны подавать заявки на получение лицензий на производство экстракта сырья в соответствии с требованиями этих правил; те, кто занимается только добычей сырья для здорового питания, производимого предприятием, подают заявки на получение лицензий на производство продуктов здорового питания, и им не нужно отдельно подавать заявки на получение лицензий на производство экстракта сырья. Это говорит о том, что если предприятие само производит продукты здорового питания, то оно может самостоятельно добывать растительное и животное сырье. Лицензия на производство экстракта сырья для производства продуктов здорового питания, должна быть отмечена в видовых реквизитах проекта названием экстракта сырья, а в графе "Примечания" содержится название продукта здорового питания, регистрационный номер или номер записи и другая информация.
Заявителям, претендующим на получение лицензии на производство экстракта сырья для здорового питания, необходимо представить регистрационные документы или свидетельство о подаче документов, а также регистрационные документы или свидетельство о подаче документов, установленных в экстракте сырья для производственного процесса, стандарты качества.
Каталог ингредиентов здорового питания, относящийся к оценке безопасности и функциональности, может быть использован для веществ здорового питания и их соответствующего списка соответствующей информации. Любое подразделение или частное лицо может на основе соответствующих исследований предложить Центру оценки здорового питания Государственного управления по контролю за продуктами и лекарствами сырье для включения в каталог ингредиентов здорового питания.
Сырье, заявленное для включения в каталог ингредиентов здорового питания, должно отвечать следующим требованиям:
1, с широкой историей отечественных и зарубежных продуктов питания и достаточным научным обоснованием;
2, с четким диапазоном дозировок и соответствующими функциями здравоохранения в соответствии с требованиями каталога функций здравоохранения;
3, со стабильным и контролируемым качеством и техническими требованиями;
4、Это научно обоснованный препарат, отвечающий требованиям безопасности и эффективности;
5, с научно применимой, стабильной и надежной эффективностью ингредиентов или фирменных ингредиентов, диапазоном содержания и методами тестирования;
6, в соответствии с предписанной дозировкой и способом употребления, безопасен и безвреден для применимого населения.

В качестве ингредиента для пищевых продуктов
Согласно Закону о безопасности пищевых продуктов, "Пища означает все виды готовых продуктов и сырья для потребления человеком или питья, а также изделия, которые по традиции являются как пищей, так и лекарством, но не включает изделия для терапевтических целей". Несомненно, растительные экстракты для пищевых продуктов являются продуктами питания и должны быть лицензированы в соответствии с требованиями Закона о безопасности пищевых продуктов. Растительные экстракты, используемые в пищевой промышленности, должны быть получены из сырья, отобранного из каталога лекарственных и пищевых продуктов или новых ресурсных продуктов питания.
Вещества, являющиеся одновременно и пищей, и лекарством, относятся к пригодным к употреблению частям животных и растений, которые традиционно употребляются в пищу и перечислены в национальном стандарте китайских травяных лекарств. Вещества, включенные в каталог сырья для пищевых и лекарственных продуктов, должны одновременно отвечать следующим требованиям:
1. В соответствии с Законом о безопасности пищевых продуктов и соответствующими нормативными актами;
2, в каноне китайской медицины есть записи о съедобности, записей о токсичности не найдено;
3, при традиционных привычках потребления, нормальное потребление, как было установлено, не вызывает острых и подострых последствий для здоровья человека,
Хронический или другой потенциальный вред здоровью человека, в соответствии с требованиями к питанию должны иметь;
4, в соответствии с соответствующими законами и правилами по защите ресурсов китайских травяных лекарств;
5, был включен в национальные стандарты для китайских травяных лекарств.
Новые продукты питания включают:
Животные, растения и микроорганизмы, которые не принято употреблять в пищу в Китае;
2, из животных, растений и микроорганизмов, выделенных из пищевого сырья, которое не принято употреблять в Китае;
3, новые разновидности микроорганизмов, используемых в пищевой промышленности;
4, в связи с использованием новых производственных процессов, приводящих к изменению первоначального состава или структуры пищевых ингредиентов.
Производство и управление или использование новых ресурсов для пищевых единиц или отдельных лиц, в продукте, впервые представленном на рынке, должно быть сообщено в Министерство здравоохранения для рассмотрения и утверждения. Представьте следующие материалы:
1, новые ресурсы для пищевой гигиены и административного лицензирования;
2, отчеты о разработке и исследованиях в области безопасности;
3, краткое описание производственного процесса и технологическая схема;
4, стандарты качества продукции;
5, отечественные и зарубежные исследования и использование и соответствующая информация о безопасности;
6, этикетки и инструкции к продуктам;
7, другая информация, помогающая в оценке.
Если предприятие выбирает в качестве сырья для переработки другие растения или их экстракты, не входящие в каталог лекарственных продуктов и новых ресурсных продуктов питания, есть три традиционных решения:
1, крупные предприятия, чтобы избежать риска декларирования новых ресурсов продуктов питания;
2, также теперь может быть переработан в пищу в качестве сырья, подготовка корпоративных стандартов, через запись и получить SC сертификации, по крайней мере, местные власти признали, но другие области продаж риска, (например: Хайнань Ganoderma Lucidum события).
3, можно также написать в провинциальную комиссию по здравоохранению, чтобы узнать, можете ли вы использовать поведение правительства для Национальной комиссии по здравоохранению (для этого требуется сильная сеть).
(A) новые пищевые ингредиенты, определение обычных продуктов питания и управление ими
Под новым пищевым сырьем понимаются следующие объекты, которые не имеют традиционных пищевых привычек в Китае: животные, растения и микроорганизмы; компоненты, выделенные из животных, растений и микроорганизмов; пищевые компоненты, первоначальная структура которых была изменена; и другое вновь разработанное пищевое сырье. Статьи, относящиеся к одному из вышеперечисленных обстоятельств, если они должны быть разработаны для производства и эксплуатации обычных продуктов питания, должны быть заявлены для утверждения в соответствии с положениями "Административных мер по проверке безопасности новых пищевых ингредиентов".
Для пищевых продуктов с традиционными пищевыми привычками в соответствии с Административными мерами по экспертизе безопасности новых пищевых ингредиентов производство и деятельность предприятий могут быть объединены с этими мерами и осуществляться в соответствии с положениями Закона о безопасности пищевых продуктов.
В 2002 году бывшее Министерство здравоохранения выпустило Уведомление о дальнейшей стандартизации управления сырьем для производства продуктов питания для здоровья, в котором объявило, что предметы из Списка предметов, которые являются одновременно и продуктами питания, и лекарствами, могут использоваться для производства обычных продуктов питания; а штаммы из Списка штаммов, которые могут быть использованы для производства продуктов питания, были объявлены в 2010 году и могут использоваться для производства обычных продуктов питания.
В 1998 году бывшее Министерство здравоохранения издало Циркуляр о порядке ректификации национального рынка здорового питания в 1998 году, в котором новые продукты питания - пыльца рапса, пыльца кукурузы, пыльца сосны, пыльца подсолнечника, пыльца зизифуса, пыльца гречихи, пыльца кунжута, пыльца сорго, конжак, Spirulina obtususifoliae, Spirulina viridulae, колючая груша, розовый баклажан, пупа шелкопряда - были отнесены к обычным продуктам питания.
(ii) Определение и управление обычными продуктами питания и сырьем для здорового питания
В 2002 году бывшее Министерство здравоохранения выпустило Уведомление о дальнейшей стандартизации управления сырьем для продуктов здорового питания, в котором был опубликован Список товаров, которые могут быть использованы для производства продуктов здорового питания, и Список товаров, запрещенных для производства продуктов здорового питания. Пожалуйста, обратитесь к Циркуляру, чтобы ознакомиться с конкретными правилами управления ингредиентами для здорового питания.
Предметы, перечисленные в Перечне предметов, которые могут быть использованы в здоровом питании, опубликованном бывшим Министерством здравоохранения в 2002 году, могут быть использованы только в здоровом питании. За исключением изделий, которые могут быть использованы в пищевых продуктах общего назначения, изделия, включенные в Перечень изделий, которые могут быть использованы в пищевых продуктах общего назначения, не могут производиться и использоваться в качестве сырья для пищевых продуктов общего назначения. Если существует необходимость в разработке изделий, включенных в Список изделий, пригодных для использования в здоровом питании, для производства обычных продуктов питания, они должны быть заявлены на утверждение в соответствии с процедурами, предусмотренными Меры по управлению экспертизой безопасности новых пищевых сырьевых материалов.
В качестве косметического сырья
Косметика на основе растений подразделяется на косметику специального назначения и косметику неспециального назначения, для производства которой требуется лицензия.
Сырье, используемое в косметике, должно быть в каталоге косметического сырья, сырье, не входящее в каталог, должно соответствовать растительному косметическому новому сырью для соответствующих процедур, растительное косметическое новое сырье относится к впервые используемому на территории Китая для производства косметики натуральному сырью растительного (в том числе водорослевого) происхождения. Отдельный ингредиент, извлеченный из растений, или высокоочищенные ингредиенты не подпадают под это определение.
Заявка на административное лицензирование нового растительного косметического сырья, должна быть в соответствии с "положениями административного лицензирования косметики декларации и принятия" и "новые косметические сырьевые декларации и обзор руководства" и другие соответствующие требования, представить административное лицензирование декларации. Кроме того, в качестве специального косметического сырья (например: широко используется в антивозрастных продуктов в ряде китайской медицины экстракты, такие как женьшень, астрагал, гибберелловая кислота, пантовый бархат, Ganoderma lucidum, облепиха, Poria cocos, Angelica sinensis, жемчуг, гинкго билоба и вечерней примулы, и т.д.). Также должна быть представлена соответствующая информация о токсикологической оценке безопасности.
Политика в отношении травяных экстрактов в Европе, Америке и других странах
Управление травяными лекарствами в Соединенных Штатах является относительно отсталым. В Законе о здоровье и образовании в области диетических добавок, принятом в США, определение "диетической добавки" включает "травы или другие растения", а также "любой их концентрат", который, несомненно, включает "травы или другие растения". Это не оставляет сомнений в правовом статусе растительных экстрактов как диетических добавок".
В Германии экстракты растений могут быть зарегистрированы в качестве рецептурных препаратов в законодательном порядке. В Германии зарегистрировано около 60 000 видов лекарств, содержащих растительные ингредиенты, большинство из которых - травяные настои, и существует строгая процедура утверждения традиционных китайских лекарств, если они хотят использоваться в Германии в качестве растительных лекарств. Как правило, китайские лекарства ввозятся в Германию в виде медицинских препаратов и подают заявки на управление продуктами питания.
В Европейском Союзе лекарства делятся на 8 типов: патентованные лекарства, непатентованные лекарства, безрецептурные лекарства, натуральные ботанические препараты, вакцинные препараты, препараты крови, биологические препараты и антидепрессанты. Помимо Великобритании и Нидерландов, Германия, Франция и Италия регулируют натуральные ботанические препараты как рецептурные или безрецептурные, а принятая в 2003 году поправка к Европейской директиве о порядке регистрации ботанических лекарственных средств предусматривает, что традиционные ботанические лекарственные средства, которые изначально подпадали под действие соответствующих пищевых норм, по-прежнему будут подпадать под действие соответствующих пищевых норм, если они содержат натуральные ботанические вещества или экстракты натуральных ботанических веществ в количестве, меньшем, чем медицинская дозировка. Правила.
Использование традиционной китайской медицины в Японии крайне ограничено. В настоящее время, помимо 210 утвержденных рецептов, Министерство здравоохранения и благосостояния (MHLW) исключительно строго относится к утверждению новых китайских травяных лекарств, рассматривая китайские травяные лекарства так же, как и новые лекарства из соединений, что почти равносильно закрытию двери, а также существует довольно много ограничительных мер при утверждении импортных патентованных китайских лекарств. Однако в последние годы японское правительство, по-видимому, ослабило контроль над продуктами здорового питания, например, сняло ограничения на лекарственные формы и ослабило ограничения на типы натуральных ботанических веществ, которые могут использоваться в продуктах здорового питания.
