A lótuszlevél alkaloid gátló hatásának vizsgálata az Akt/mTOR/4EBP1 glikolízis útvonalra és antiproliferatív hatása az epekőcarcinoma sejtekre
A kolangiókarcinómát (CCA) anatómiai elhelyezkedés alapján extrahepatikus kolangiókarcinómára (extrahepatikus kolangiókarcinóma) és intrahepatikus kolangiókarcinómára (ICC) osztják. Bár az ICC az elsődleges májráknak csak 10% és 20% közötti részét teszi ki, a korai stádiumban igen alattomos, magas posztoperatív kiújulási aránnyal és rossz prognózissal. Az utóbbi évtizedekben az ICC előfordulási aránya és mortalitása Ázsiában, sőt a világon is folyamatosan emelkedett. Az előrehaladott ICC első vonalbeli kemoterápiás programja hajlamos a gyógyszerrezisztenciára és a mellékhatásokra a hosszú távú használat után, ezért biztonságos és hatékony terápiás gyógyszerek feltárására van szükség.
A növényekből és állatokból származó, daganatellenes hatású természetes gyógyászati hatóanyagok szűrése mindig is a hazai és nemzetközi kutatások egyik legjelentősebb területe volt. A nuciferin (NUF) a Nymphaeaceae családba tartozó Nelumbo nucifera Gaertn szárított leveleiből származik. Bizonyos tumorsejt-ellenes aktivitással rendelkezik, de ICC-sejtekre gyakorolt hatásáról ritkán számoltak be. Ez a tanulmány a lótuszlevél alkaloid hatását vizsgálta a HuCCT1 sejtek proliferációjára és glikolízis folyamatára, és előzetesen feltárta a hatásmechanizmusát, elméleti alapot nyújtva a biztonságos és hatékony ICC terápiás gyógyszerek kifejlesztéséhez.
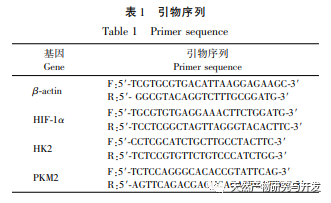
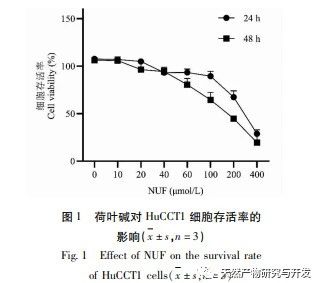
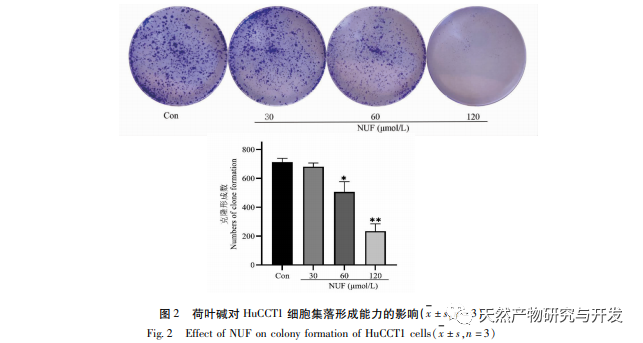
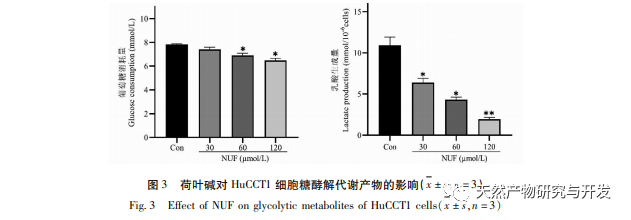
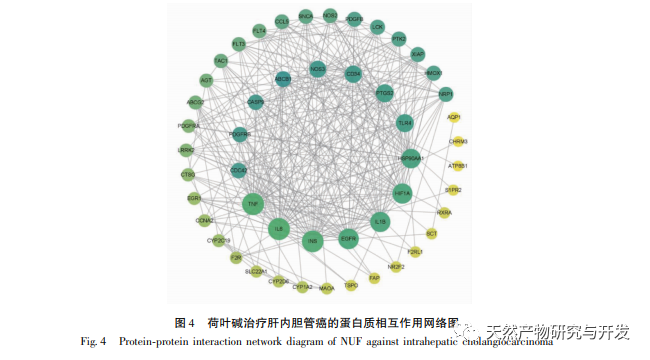
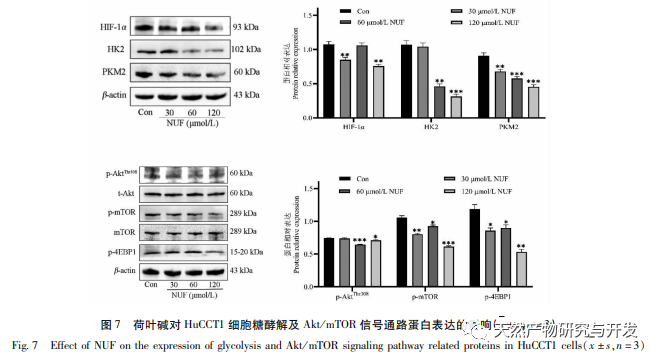
A modern farmakológiai kutatások azt mutatják, hogy a lótuszlevélből kivont lótuszlevél alkaloid aktív összetevője bizonyos növekedést gátló hatással van számos daganatos sejtre, például májrákra, tüdőrákra, mellrákra, és javíthatja a kemoterápiás gyógyszerekkel szembeni érzékenységét. Ez a vizsgálat megállapította, hogy a lótuszlevél alkaloid bizonyos koncentrációja jelentősen gátolja a HuCCT1 sejtek proliferációját in vitro, és pozitívan korrelál a glükózfogyasztás és a laktáttermelés csökkentésével. A szénhidrátok fontos energiaforrások a sejtek élettevékenységében, és a Warburg-hatás azt jelzi, hogy a rákos sejtek még normál oxigénellátás mellett is inkább a glikolízisen keresztül szolgáltatnak energiát, mint az aerob anyagcsere-utakon keresztül. A glikolízis magas szintje gyors energiát biztosíthat a rákos sejtek növekedéséhez, és termékei, például a piruvinsav és a tejsav szintén nyersanyagot szolgáltatnak a rákos sejtek anyagainak szintéziséhez, és elősegítik a rákos sejtek áttétképzését és invázióját. Ezért feltételezhető, hogy a HuCCT1 sejtek proliferációjának lótuszlevél alkaloidák általi gátlása a sejtek glikolízis anyagcseréjének gátlásával függ össze.
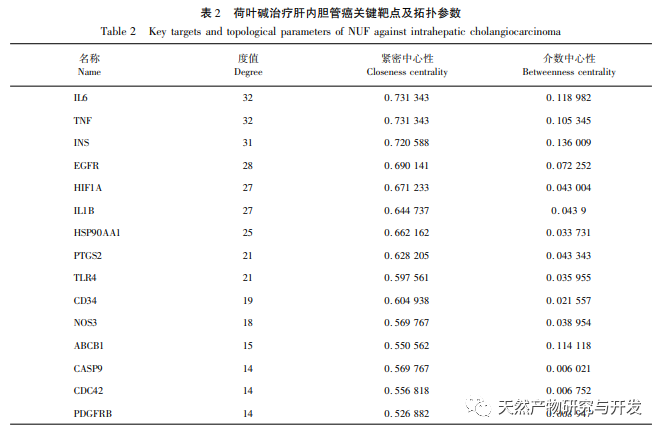
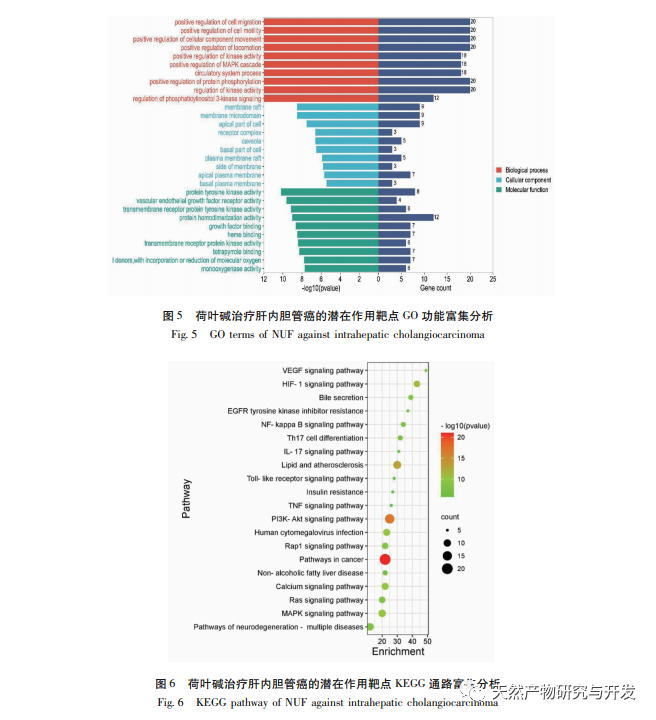
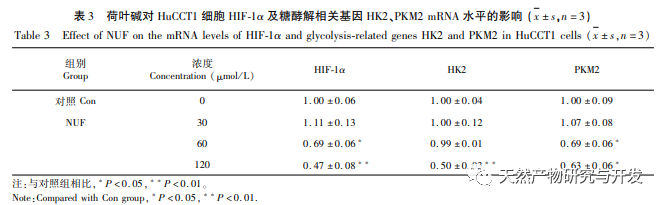
A hálózati farmakológiai elemzés magas korrelációt talált a matrin és a HIF-1 α, valamint az olyan célpontok között, mint a TNF, INS, EGFR stb. A HIF-1 α számos folyamatban részt vesz, például a glükóz anyagcserében, a sejtproliferációban, az invázióban és metasztázisban, valamint a tumorsejtek gyulladásos válaszában. Aktiválhatja a glükóztranszporter (GLUT) és különböző glikolitikus enzimek, mint a HK2, PKM2 és a piruvát-dehidrogenáz kináz 1 (PDK1) aktivitását, és közvetlenül részt vesz a glikolízis folyamatában, nagyban elősegítve a tumor progresszióját. A hexokináz (HK) és a piruvát-kináz (PK) két kulcsfontosságú kináz a glikolízis folyamatában, amelyek a folyamat kezdeti és végső szakaszát szabályozzák. Ez a tanulmány azt találta, hogy a HIF-1 α és a kulcsfontosságú glikolitikus enzimek, a HK2 és a PKM2 mRNS-szintje és fehérjeexpressziója a sejtekben fokozatosan csökkent a lótuszlevél alkaloid koncentrációjának növekedésével. Ezért feltételezhető, hogy a lótuszlevél alkaloid a HIF-1 α aktivitásának csökkentésével befolyásolhatja a HuCCT1 sejtek glikolízisfolyamatát.
A HIF-1 egy olyan transzkripciós faktor, amelyre a sejtek alacsony oxigénszintű vagy hipoxiás környezetben reagálnak, és amely két alegységből áll: A HIF-1 α prolin-maradványa normoxikus körülmények között hajlamos a hidroxilálódásra, és kötődik a hangoló molekulájához (von Hippel Lindau, pVHL), amely ubikvitinációval lebomlik. Alacsony oxigénszintű környezetben a proil-hidroxiláz domént tartalmazó fehérjék (PHD) aktivitása csökken, ami a HIF-1 α jelentős felhalmozódásához vezet, amely ezután a sejtmagba vándorol, hogy dimert képezzen a HIF-1 β-vel. A dimer ezután a hipoxiás válaszelemhez (HRE) kötődik, hogy elősegítse a HIF-1 célgének transzkripcióját. Ezenkívül a HIF-1 α oxigéntől független módon is aktiválódhat, például a PI3K/Akt/mTOR jelátviteli kaszkád felszabályozhatja a HIF-1 α transzkripcióját és transzlációját az eukarióta transzláció iniciációs faktor 4E (eIF4E) kötő fehérje 1 (4EBP1) integritásának megbontásával. Egyes tudósok ennek az oxigéntől független HIF-1 α jelnek az aktiválási mechanizmusát "pszeudo-hipoxiának" nevezik. Ebben a tanulmányban a KEGG-elemzés kimutatta, hogy a matrin az ICC potenciális útvonalaira hat, a PI3K/Akt jelátviteli útvonal jelentős növekedésével. Az immunoblotting kimutatta, hogy a matrin képes csökkenteni az mTOR és a 4EBP1 fehérjék foszforilációs szintjét a HuCCT1 sejtekben, és a teljes p-AktTrr308 fehérje csökkenő tendenciát mutatott, ami arra utal, hogy a HIF-1 α transzkripció és transzláció szintjének matrin általi lefelé szabályozása az Akt/mTOR/4EBP1 jelátviteli útvonal gátlásával függhet össze.
Több tanulmány kimutatta, hogy a lótuszlevél alkaloidok a tumorsejtek in vitro apoptózisának kiváltása, az invázió és az áttétképződés gátlása, valamint a különböző ciklusok blokkolása mellett a lótuszlevél alkaloidok késleltethetik az ektopikusan átültetett tumorok növekedését meztelen egerekben, és jelentős tumorellenes hatást fejtenek ki. A fő mechanizmus a sejtciklussal és az apoptózissal kapcsolatos fehérjeexpressziónak a lótuszlevél alkaloidák általi szabályozásával, a specifikus gének közvetlen célzásával, a jelátviteli útvonalak, mint például a PI3K Akt, Wnt/β - katenin, SOX2 Akt, STAT3 és TLR4/NF - κ B gátlásával függ össze. Ez a tanulmány előzetesen megállapította, hogy a lótuszlevél alkaloidák gátolják az intrahepatikus kolangiókarcinóma sejtek proliferációját, valószínűleg az Akt/mTOR/4EBP1 jelátviteli útvonal által szabályozott sejtglikolízis folyamat elnyomása révén. A kettő közötti belső logikai kapcsolatot a kutatás következő lépésében feltárjuk, hogy tisztázzuk a lótuszlevél alkaloidák ICC-ellenes mechanizmusát, és elméleti alapot biztosítsunk a lótuszlevélforrások és a klinikai alkalmazások mélyreható fejlesztéséhez.
