A kaempferol mechanizmusa a tripla negatív emlőráksejtek apoptózisának kiváltása a mitokondriális apoptózis útvonalon keresztül
A hármas negatív emlőrák (TNBC), mint az emlőrák egy speciális altípusa, az emlőrák teljes számának 15%~20% %-át teszi ki. Klinikai jellemzői a rövid teljes túlélési idő, a magas malignitás, az erős invázió, a magas korai kiújulási arány stb. Az áttétképződés után a betegek medián túlélési ideje mindössze 10~13 hónap. A TNBC endokrin terápiára és célzott terápiára való érzéketlensége miatt a kemoterápia a fő kezelési módszer. A gyógyszerrezisztencia és a kezeléssel kapcsolatos mellékhatások azonban továbbra is aggodalomra adnak okot. Az elmúlt években egyre inkább felértékelődött a hagyományos kínai orvoslás szerepe a TNBC megelőzésében és kezelésében, köszönhetően egyedülálló elméleti rendszerének és az egyénre szabott kezelési tervekben való jártasságának. Kutatócsoportunk korábbi kutatásai során megállapította, hogy a Chaihu Guizhi főzet hozzáadása és csökkentése kapecitabinnal kombinálva gátolja a tripla negatív emlőrák szubkután transzplantált tumorjának növekedését meztelen egerekben. A hálózati farmakológiai módszerrel végzett további elemzés kimutatta, hogy a kaempferol (KA) fontos hatékony összetevője a Chaihu Guizhi Decoction hozzáadásának és csökkentésének, ami kísérleti alapot biztosít számunkra a kaempferol hármas negatív emlőrák kezelésére.
A kaempferol egy flavonoid vegyület, amely széles körben megtalálható a zöldségekben, gyümölcsökben és a hagyományos kínai orvoslásban. Különböző hatásai vannak, például rákellenes, gyulladáscsökkentő, antioxidáns és vírusellenes. A sejtek apoptózisának kiváltásával, a sejtciklus szabályozásával, az angiogenezis és a tumoros áttétképződés gátlásával gátolhatja a tumorsejtek proliferációját és invázióját. A kutatások megállapították, hogy a KA a MEK-MAPK aktiválásával növekedési gátlást és apoptózist indukál a tüdőráksejtekben. In vitro és in vivo a KA gátolja az AKT/PI3K és ERK útvonalakat, aktiválja a mitokondriális apoptózis útvonalat, és növeli a tüdőráksejtek sugárzás általi elpusztítását. Vastagbélrákban a KA helyreállítja a réskapcsolatok intercelluláris kommunikációját azáltal, hogy fokozza a csomóponti fehérje 43 expresszióját és foszforilációját a vastagbélráksejtekben, ezáltal sejt apoptózist indukál. A KA a PI3K/AKT és a hTERT útvonalak downregulálásával apoptózist és öregedést is előidézhet humán méhnyakráksejtekben. Mellrákban arról számoltak be, hogy a KA különböző mechanizmusokon keresztül tumorellenes szerepet játszik. A KA gátolhatja az emlőráksejtek invázióját a PKC δ/MAPK/AP-1 kaszkád expressziójának és aktivitásának, majd a mátrix metalloproteináz-9 (MMP-9) gátlásával. Li és munkatársai megállapították, hogy a KA a Notch1 fehérje szabályozásával gátolhatja az emlőrák SK-BR-3 sejtek proliferációját. Ezenkívül a KA gátolni tudja az MCF-7 emlőráksejtek triklozán által indukált epiteliális-mesenchymális transzformációját (EMT) és metasztázissal kapcsolatos viselkedését is. Bár a KA rákellenes hatását számos tumorban megerősítették, nincs jelentés arról, hogy a KA képes-e apoptózist indukálni a tripla negatív emlőráksejtekben és annak molekuláris mechanizmusáról. Ez a tanulmány az MDA-MB-231 humán TNBC-sejtet veszi kutatási tárgynak, hogy megfigyelje a kaempferol hatását az MDA-MB-231 sejt apoptózisára, és hogy a lehetséges mechanizmus kapcsolódik-e a mitokondriális apoptózis útvonalához, hogy elméleti alapot és kísérleti alapot biztosítson a kaempferol klinikai alkalmazásához a hármas negatív emlőrák kezelésében.
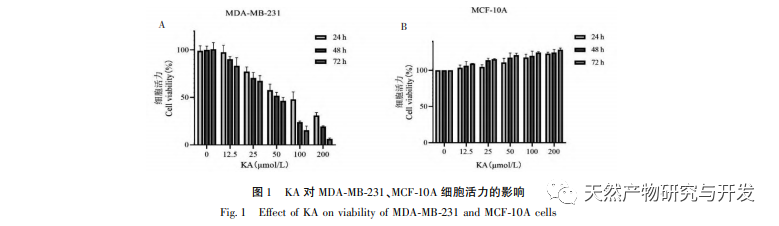
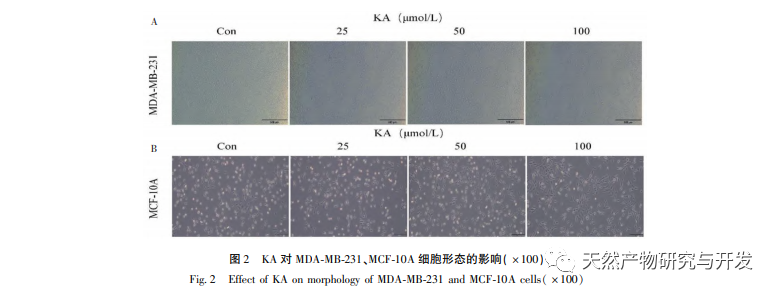
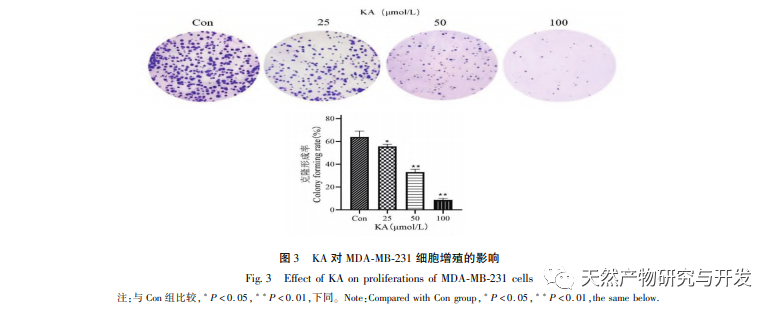
A kaempferol, mint a különböző növényekben széles körben jelen lévő poliol-hidroxi-flavonoid vegyület, nemcsak hatékonyan gátolja a tumorsejtek növekedését és apoptózist indukálhat, hanem fenntartja a normál sejtek növekedési vitalitását is. Chen és munkatársai megállapították, hogy a KA képes a prosztatarák sejtciklus-megállást indukálni, gátolja a sejtproliferációt, és nincs hatása a normál emberi fityma fibroblasztok (HFF) életképességére, ami azt jelzi, hogy a KA jó daganatellenes hatékonysággal és alacsony toxicitással rendelkezik. Tu és munkatársai megállapították, hogy a KA hatékonyan képes gátolni a humán méhnyakráksejtek proliferációját és metasztázisát, míg a karcinoembriós vesesejtekre és a normál májsejtekre gyakorolt citotoxikus hatása viszonylag kicsi, ami azt jelzi, hogy a KA magas ráksejt-célzó képességgel rendelkezik. Kevés tanulmány született a KA-ról a tripla negatív emlőráksejtekben. Ezért ez a tanulmány megerősítette, hogy a KA jelentősen gátolja a TNBC sejtek proliferációját és elősegíti a sejtek apoptózisát az MDA-MB-231 és MCF-10A sejteken végzett in vitro vizsgálatokon keresztül, de nincs hatása a normál emlő epiteliális MCF-10A sejtek proliferációjára.
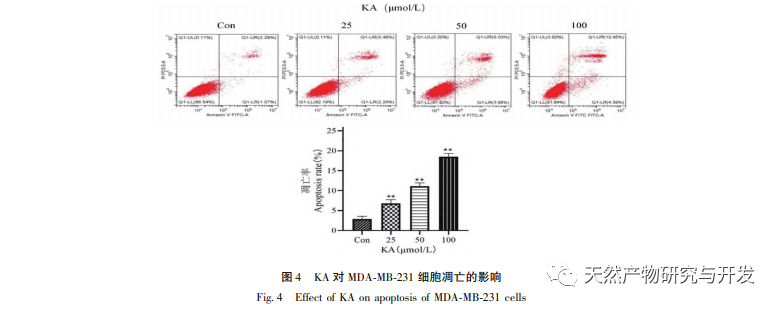
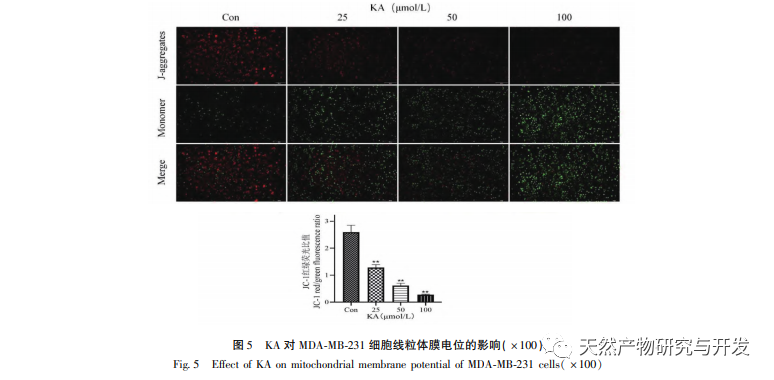
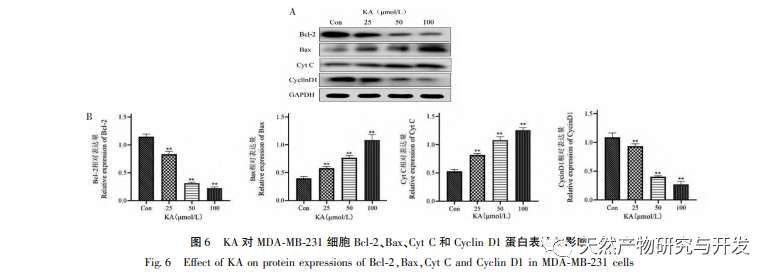
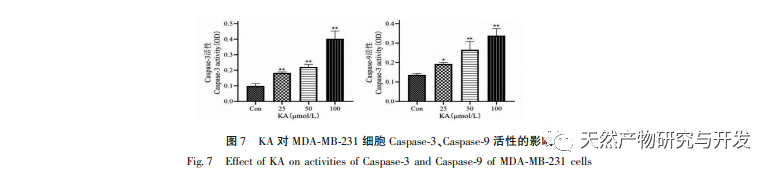
Ennek alapján ez a kísérlet tovább vizsgálja a KA apoptózis indukciós mechanizmusát az MDA-MB-231 sejteken. Jelenleg a kutatások azt találták, hogy a sejt apoptózis elsősorban három útvonalat foglal magában a kezdeményezési folyamat alapján: mitokondriális útvonal, halálreceptor útvonal és endoplazmatikus retikulum útvonal, és a mitokondriális útvonal fontos szerepet játszik a sejt apoptózis közvetítésében. A mitokondriális membránpotenciál az egyik legjobb mutató, amely a mitokondriális belső membrán áteresztőképességét tükrözi. A mitokondriális membránpotenciál csökkenését tekintik a sejt apoptózis kaszkádreakciójának legkorábbi eseményének. Amint a mitokondriális membránpotenciál összeomlik, a sejt apoptózisa visszafordíthatatlanná válik. Feng és munkatársai izoláltak egy arabinogalaktánt az Artemisia scoparia-ból, amely képes elpusztítani a humán orrgarati karcinóma CNE-2 sejteket azáltal, hogy mitokondriális membránpotenciál-vesztést okoz. Ez a tanulmány megállapította, hogy a KA hatására csökken a mitokondriális membránpotenciál az MDA-MB-231 sejtekben, ami arra utal, hogy a kaempferol egyik mechanizmusa, amellyel gátolja a sejtek proliferációját és elősegíti az apoptózist, a mitokondriális közvetítésű apoptotikus útvonalon keresztül valósulhat meg. A KA által kiváltott MDA-MB-231 sejtek apoptózisa és a mitokondriális apoptózis jelátviteli útvonal közötti kapcsolat további vizsgálata érdekében ez a tanulmány kimutatta a Bcl-2, Bax, CytC, Cyclin D1 expresszióját, valamint a Caspase-3 és Caspase-9 aktivitását.
A Bcl-2 fehérjecsaládhoz tartozik a Bcl-2 antiapoptotikus fehérje és a Bax proapoptotikus fehérje. A mitokondriális külső membrán integritásának szabályozóiként fontos szerepet játszanak a mitokondriális apoptózis útjának szabályozásában. Az apoptotikus jel beérkezése után a citoplazmában lévő Bax transzlokálódik a mitokondriumba, és az antiapoptotikus fehérje, a Bcl-2 irányítja a citokróm C felszabadulását a mitokondriumból, elősegítve a kaszpáz-9 prekurzor önaktiválódását. Az aktivált kaszpáz-9 aktiválja a kaszpáz-3-at, ami végül a sejt apoptózisához vezet. Liu és munkatársai megállapították, hogy a KA gátolja az emberi epehólyagráksejtek proliferációját, és a mitokondriális apoptózis útvonalán keresztül apoptózist indukál. Ebben a vizsgálatban megfigyeltük, hogy a KA növelte a Bax expresszióját és csökkentette a Bcl-2 expresszióját az MDA-MB-231 sejtekben, elősegítve a CytC citoplazmába történő felszabadulását a mitokondriális apoptózis útvonalon keresztül, ami fokozott expressziót eredményezett. Ezzel egyidejűleg a mitokondriális membrán permeabilitása megnő, a membránpotenciál csökken, preapoptotikus faktorok szabadulnak fel, kiváltva a kaszpáz-3 és kaszpáz-9 downstream aktiválódását, ami végül a sejt apoptózisához vezet. Ezenkívül az apoptózis szorosan összefügg a rendellenes sejtburjánzással, és a sejtburjánzás fő oka a rendellenes sejtciklus. A ciklin D1, mint a sejtciklus fontos szabályozó fehérjéje, elősegítheti a sejtek G1 fázisból az S fázisba való átmenetét, felgyorsíthatja a sejtciklus folyamatát, és felszabályozása kóros sejtproliferációt okozhat, változásokat idézhet elő a mitokondriális membránpotenciálban, és tumor kialakulásához vezethet. A kísérlet eredményei azt mutatják, hogy a KA képes lefelé szabályozni az apoptózissal kapcsolatos fehérjék, a Cyclin D1 és a Bcl-2 expresszióját az MDA-MB-231 sejtekben, csökkenti a mitokondriális membránpotenciált, gátolja a sejtproliferációt és elősegíti a sejtek apoptózisát.
Összefoglalva, ez a tanulmány tisztázta a kaempferol rákellenes hatását a tripla negatív emlőráksejtekre in vitro, és bizonyos biztonsággal rendelkezik, és tisztázta a KA mechanizmusát, amely az MDA-MB-231 sejtek apoptózisát indukálja a mitokondriális apoptózis jelútján keresztül. Később a KA TNBC-re gyakorolt gátló hatása in vivo kísérletekkel tovább tanulmányozható, ami kísérleti alapot biztosít a KA fejlesztéséhez és klinikai alkalmazásához.
