Előzetes tanulmány a fehérrépa semleges poliszacharidok védőmechanizmusáról a PC12 sejtek oxidatív károsodásával szemben
A répa (Brassica rapa L.), más néven Chagu vagy Manjing, a Brassicaceae családba és a Brassica nemzetségbe tartozik. Gyökerét gyógynövényként használják, és tápanyagokban gazdag. Hosszú ideig fogyasztható, és "hosszú életű gyümölcsként" ismert. Étvágyjavító és emésztést elősegítő, a qi keringését elősegítő, köhögést és asztmát enyhítő, vizelethajtást és méregtelenítést elősegítő hatása van. A modern farmakológiai kutatások megállapították, hogy a fehérrépa olyan farmakológiai tevékenységekkel rendelkezik, mint a vércukorszint csökkentése, antioxidáció, öregedésgátlás, daganatellenes, immunitásszabályozó és gyulladáscsökkentő. Az előzetes kutatás során a kutatócsoport mérése szerint a fehérrépa poliszacharid tartalma körülbelül 11,53% volt. Zsírtalanítás és színtelenítő tisztítás után a vízben oldódó fehérrépa poliszacharid BRP-t nyerték. Ezt tovább izolálták és tisztították, hogy semleges poliszacharidokat nyerjenek a Brassica rapa L.-ből (BRNP) és savas poliszacharidokat a Brassica rapa L.-ből (BRAP), és szerkezetüket azonosították. Az előzetes kísérletek azt mutatták, hogy a répa poliszacharidok jó antioxidáns aktivitással rendelkeznek, ami megalapozza a répa poliszacharidok antioxidáns és öregedésgátló kutatásokban való alkalmazását. Ezért ez a tanulmány H2O2 által indukált PC12 sejtek korai öregedési modelljét hozta létre, hogy megvizsgálja a Bax, Bcl-2 és Caspase-3 fehérjék expressziós szintjét PC12 sejtekben a H2O2 által indukált sérülést követően BRNP-vel, és tovább tisztázza a BRNP öregedésgátló mechanizmusát.
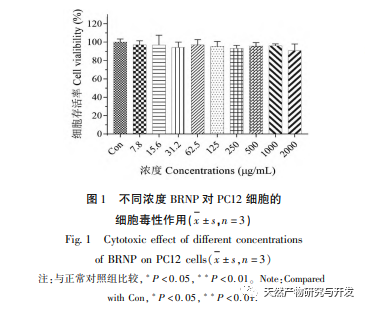


A H2O2 egy reaktív oxigénfajok molekula, amely növelheti az intracelluláris reaktív oxigénfajok tartalmát és károsíthatja a sejteket. Széles körben használják a sejtek öregedési modelljeinek rövid időn belüli előállítására. A sejtproliferációs aktivitás fontos indikátor annak meghatározására, hogy a tenyésztett sejtek képesek-e normálisan szaporodni bizonyos körülmények között. A CCK-8 kísérlet eredményei azt mutatták, hogy a PC12 sejtek túlélési aránya jelentősen csökkent a H2O2 koncentráció növekedésével, és dózisfüggő hatást mutatott. Amikor 300 μ mol/L H2O2-vel kezelték 4 órán keresztül, a sejtek túlélési aránya 60,64% volt. Ekkor a PC12 sejtek bizonyos mértékben károsodtak, de még nem érték el a visszafordíthatatlan állapotot. Ezért a 300 μ mol/L-t választottuk a PC12 sejtek oxidatív károsodásának optimális koncentrációjaként és idejeként 4 órán keresztül a későbbi kísérletek során.
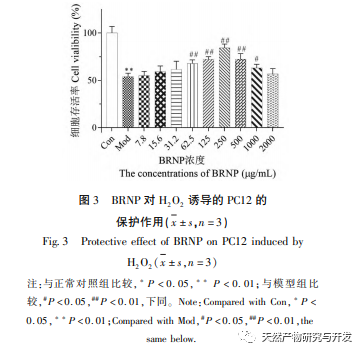
Annak ellenőrzésére, hogy a BRNP-nek van-e citotoxikus hatása a PC12 sejtekre, a BRNP-t önmagában használták a PC12 sejtek H2O2-károsodás nélküli kezelésére. A kísérleti eredmények azt mutatták, hogy a PC12 sejtek túlélési aránya nem változott jelentősen a BRNP különböző koncentrációival (7,8-2000 μ g/ml) történő kezelés után (P>0,05), ami azt jelzi, hogy a BRNP-nek nincs jelentős citotoxicitása a PC12 sejtek életképességére. A BRNP hatásának vizsgálatakor a H2O2 által kiváltott károsodásra a PC12 sejtekben az eredmények azt mutatták, hogy a modellcsoporttal összehasonlítva a sejtek túlélési aránya fokozatosan nőtt a BRNP koncentrációjának növekedésével (P<0,05), és a sejtek túlélési aránya jelentősen nőtt, amikor a BRNP koncentrációja elérte a 250 μ g/mL-t. A kísérleti eredmények alapján a BRNP bizonyos védőhatással rendelkezik a H2O2 által kiváltott károsodásra a PC12 sejtekben.
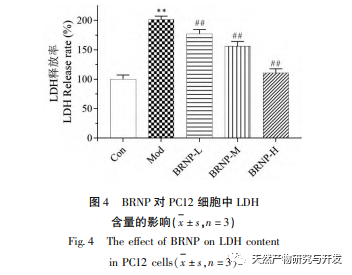
A laktát-dehidrogenáz (LDH) a sejtek belsejében létezik, és képes katalizálni a laktát előállítását a piruvátból. A sejtek károsodásakor az LDH nagy mennyiségben szabadul fel, ami az extracelluláris LDH-szint jelentős emelkedéséhez vezet. A felszabaduló LDH mennyisége arányos a károsodás mértékével, így az LDH-szivárgás mértéke tükrözheti a sejtkárosodás mértékét. A kísérlet eredményei arra utalnak, hogy a BRNP megakadályozhatja vagy lelassíthatja a sejtmembrán károsodásának mértékét és megakadályozhatja az intracelluláris LDH szivárgását.
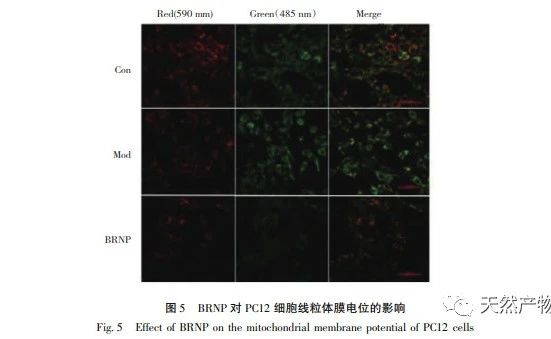
A sejtben a mitokondriumok belső membránjának mindkét oldalán nem egyenletes a protoneloszlás, ami egy elektrokémiai gradienst, az úgynevezett mitokondriális membránpotenciált képez. Számos tanulmány kimutatta, hogy amikor bármely apoptózist indukáló faktor serkenti a sejt apoptózisát, a mitokondriális membránpotenciál csökkenése következik be, és ez a membránpotenciál-csökkenés hamarabb bekövetkezik, mint a sejtmorfológiai változások. A mitokondriális membránpotenciál jelentős csökkenése a sejtek irreverzibilis apoptózisához vezet, ezért a mitokondriális membránpotenciál csökkenése a sejt apoptózis korai szakaszának klasszikus jelenségének tekinthető. Jelenleg a kutatások megerősítették a mitokondriális diszfunkció és az öregedési folyamat közötti szoros kapcsolatot. Például a mitokondriális energia (MMP és ATP) elégtelen ellátása csökkentheti a szervezet anyagcsere-kapacitását, ami egy sor öregedési elváltozáshoz vezet. Ezek közül a mitokondriális membránpotenciál csökkenése a sejt apoptózis egyik specifikus markere. A kutatási eredmények azt mutatták, hogy a PC12 sejtek mitokondriális membránpotenciálja jelentősen csökkent H2O2 kezelés után, és a BRNP előkezeléssel meg lehetett előzni a H2O2 által okozott membránpotenciál csökkenést.
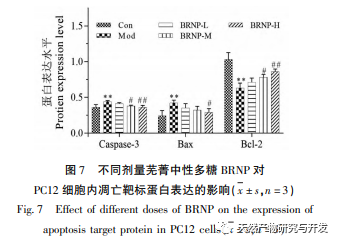
Az apoptózis egy programozott sejthalál folyamat, amely magában foglalja az exogén Fas/FasL közvetítette halálreceptor útvonalakat, valamint az endogén mitokondriális és endoplazmatikus retikulum útvonalakat. Ezek közül a mitokondriális közvetítésű endogén apoptózis útvonal a programozott sejthalál fő útvonala az emlőssejtekben. A pro-apoptotikus fehérjék által képviselt Bax és az antiapoptotikus fehérjék által képviselt Bcl-2 a mitokondriális apoptózisfaktorok felszabadulását szabályozó fő fehérjék. A kaszpáz-proteáz az emlősökben az apoptózis egyik kulcsfontosságú effektorja, amelyek közül a kaszpáz-3 a kaszpáz család egyik legfontosabb proteáza, amely aktiválja a különböző apoptózist serkentő faktorokat, és a sejtek apoptózisának fontos végrehajtójaként ismert. A BRNP bizonyos mértékben csökkenti a kaszpáz-3 expresszióját a H2O2 oxidációval károsodott PC12 sejtekben. Feltételezhető, hogy a BRNP csökkentheti a kaszpáz-3 expresszióját, csökkentheti a sejt apoptózist, és így késleltetheti a szervezet öregedését. A BRNP-vel történő beavatkozás után a Bcl-2 expressziós szintje nőtt az oxidatív károsodással járó PC12 sejtekben, míg a Bax és a BRNP expressziós szintje különböző mértékben csökkent. Ezek a kutatási eredmények arra utalhatnak, hogy a BRNP segíti a sejteket abban, hogy ellenálljanak a mitokondriumokat és a DNS-t érő oxidatív stressz okozta károsodásnak, csökkenti a sejtek oxidatív károsodását, és fokozza a szervezet antioxidáns stressz szabályozására való képességét.
