A Jolkinolid B mechanizmusa a vastagbéldaganatok kezelésében a hálózati farmakológia és a kísérleti kutatás alapján
A vastagbélrák (CRC) a harmadik leggyakoribb rosszindulatú daganat a világon, amely komoly veszélyt jelent az emberi egészségre. A vastagbélrák okozta halálesetek száma 2015-ben elérte a 774000-et. Az emberek életmódjának és táplálkozási szerkezetének óriási változásai miatt a vastagbélrák előfordulási aránya és halálozási aránya évről évre nő. A vastagbélrák megelőzésére és kezelésére irányuló kutatás megerősítése a rák elleni küzdelem egyik fontos tartalma Kínában. Egyre fontosabbá válik a természetes erőforrásokból származó olyan vezető vegyületek keresése, amelyek képesek a vastagbéldaganatokat megcélozni és elősegíteni a tumorsejtek apoptózisát. A hagyományos kínai gyógyászatban a "farkasbogyó" hosszú múltra tekint vissza, és a népi gyógyászatban gyakran használják a vastagbélrák kezelésére. Ez a gyógyszer szerepel a Kínai Gyógyszerkönyv 2020-as kiadásában, és az Euphorbia fis cheriana Steud és az Euphorbia ebracteolata Hayata növényeknek az Euphorbiaceae családba tartozó szárított gyökere. Először a "Shennong Materia Medica"-ban jegyezték fel, és főleg köhögésre, felhalmozódások feloldására, sebek, egérelhalás és mérgezés esetén használják. Az északkeleti népek a főzetét vastagbélrák kezelésére használják. Kutatások kimutatták, hogy a hagyományos kínai gyógyászatban használt "farkasbogyó" 47%-vel meghosszabbíthatja a vastagbélrákban szenvedő állatok túlélési arányát.
A farkasméreg aktív másodlagos anyagcseretermékei főként terpenoidok, amelyek tartalma bőséges. Kísérleti csoportunk a farkasméreg gyógynövényforrásának, az Euphorbia lanceolata szárított gyökeréből a korai szakaszban szerkezetileg változatos diterpéneket izolált, mint például ent abietán, rosán és diterpenoid dimerek. Közülük az ent abietán diterpén Jolkinolite B (szerkezetét az 1. ábra mutatja) hatékonyan gátolja az SW480 vastagbél tumorsejt proliferációját (IC50=9,5 μ mpl/L), ami anyagi alapot nyújt a CRC kezeléséhez, de a hatásmechanizmus még nem világos. A korábbi kutatások alapjait figyelembe véve tervezzük, hogy a Jolkinolid B hatóanyag hatásmechanizmusát a CRC kezelésében in vitro sejtkísérletekkel kombinált hálózati farmakológiai módszerekkel feltárjuk, kísérleti bizonyítékot szolgáltatva a későbbi gyógyszerfejlesztéshez és klinikai alkalmazásokhoz.
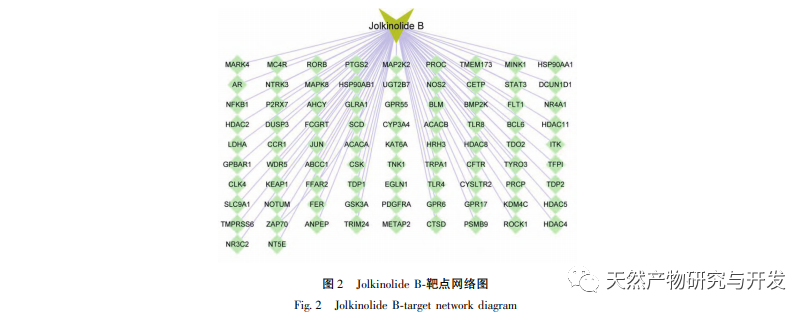
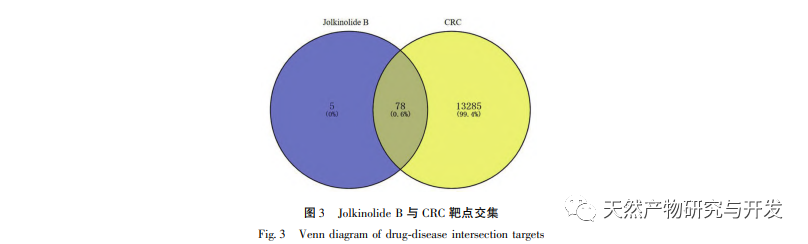

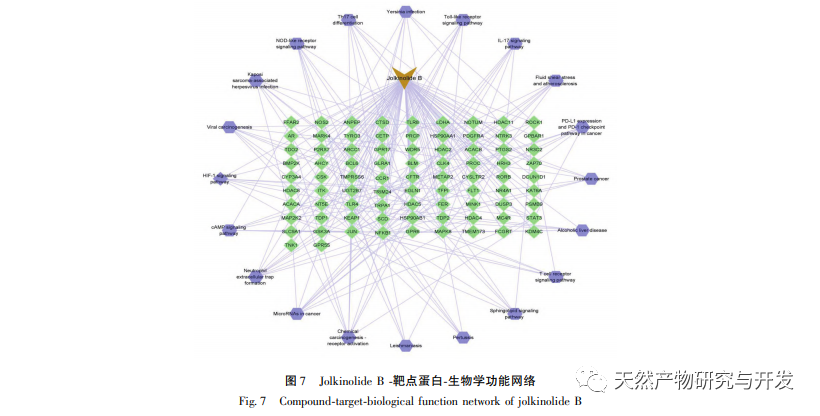



A hálózati farmakológia nagymértékben tükrözheti a biomolekulák és a kémiai komponensek közötti összetett kölcsönhatásokat. A hatás célpontjának hálózati farmakológián keresztül történő szűrésével alapot teremthet a hagyományos kínai orvoslás célzottabb kutatásához, tisztázhatja a hagyományos kínai orvoslás optimális vegyületeit és hatásmechanizmusait. A hagyományos kínai gyógyászat farkasbogyó az Euphorbiaceae családba tartozó Euphorbiaceae nemzetséghez tartozó növény. Hatása a víz és a váladék eloszlatása, a felhalmozódás lebontása és a rovarok elpusztítása. A kutatási eredmények azt mutatják, hogy a diterpenoidok a hagyományos kínai gyógyászat farkasbogyó hatóanyagának alapját képezik, különböző biológiai aktivitásokkal, például daganatellenes, gyulladáscsökkentő, antibakteriális és a multidrog-rezisztencia megfordításával. A hagyományos kínai gyógyászatban a farkasbogyó hosszú múltra tekint vissza, és a népi gyógyászatban gyakran használják a vastagbélrák kezelésére. Ennek alapján farmakológiai mechanizmus előrejelzést végeznek. A hagyományos kínai gyógyászat farkasbogyó kémiai összetevőinek korábbi kutatásai alapján a farkasbogyóban található kiváló vegyületet, a Jolkinolid B-t in vitro citotoxikus aktivitás szűrésen és in vivo biológiai kísérleteken keresztül vizsgálták. A farkasbogyóban található kiváló vegyület, a Jolkinolid B célpontjai közötti kapcsolat feltárására egy Jolkinolid B-célpont hálózatot építettünk, és a célpontok funkcionális annotációját génszinten végeztük el. Ez kutatási alapot biztosít a Jolkinolid B több célpontot és több útvonalat érintő farmakológiai mechanizmusaihoz.
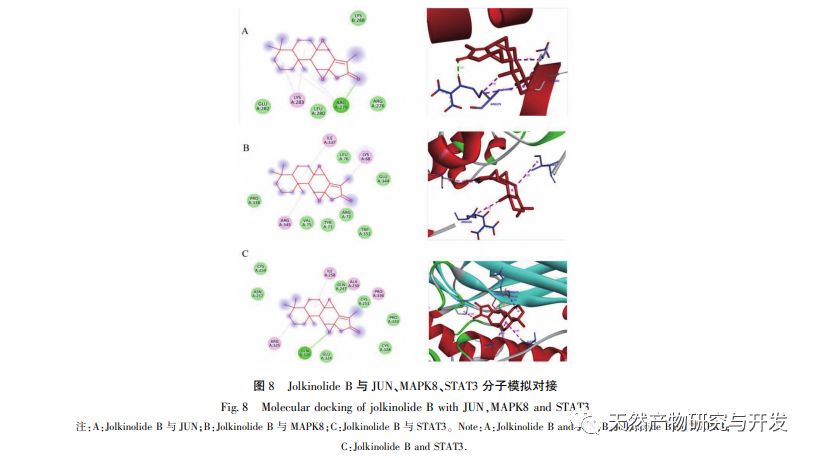
A Jolkinolide B-PPI kölcsönhatási hálózat elemzése azt mutatja, hogy a fő célpontok a STAT3, a MAPK8 és a JUN, amelyeket a vonatkozó irodalmi kutatások megerősítettek; Ezek a célpontok jeleket továbbítanak a sejtfelszíni receptoroktól a sejtmagban lévő DNS-hez, részt vesznek olyan biológiai folyamatokban, mint a sejthalál és a sejtciklus, valamint szabályozzák a patológiai folyamatokat, mint a gyulladás és a stresszválasz. A MAPK1 és a MAPK3 a MAPK tagja. A STAT3 a MAPK által aktiválható transzkripciós faktor, amely kulcsszerepet játszik számos sejtfolyamatban, például a sejtnövekedésben és az apoptózisban, részt vesz a daganatok kialakulásában és fejlődésében. Ezenkívül a STAT3 döntő fontosságú a TH17 segítő T-sejtek differenciálódásában, és összefüggésbe hozható az autoimmun betegségekkel, a visszatérő fertőzésekkel és más betegségekkel.
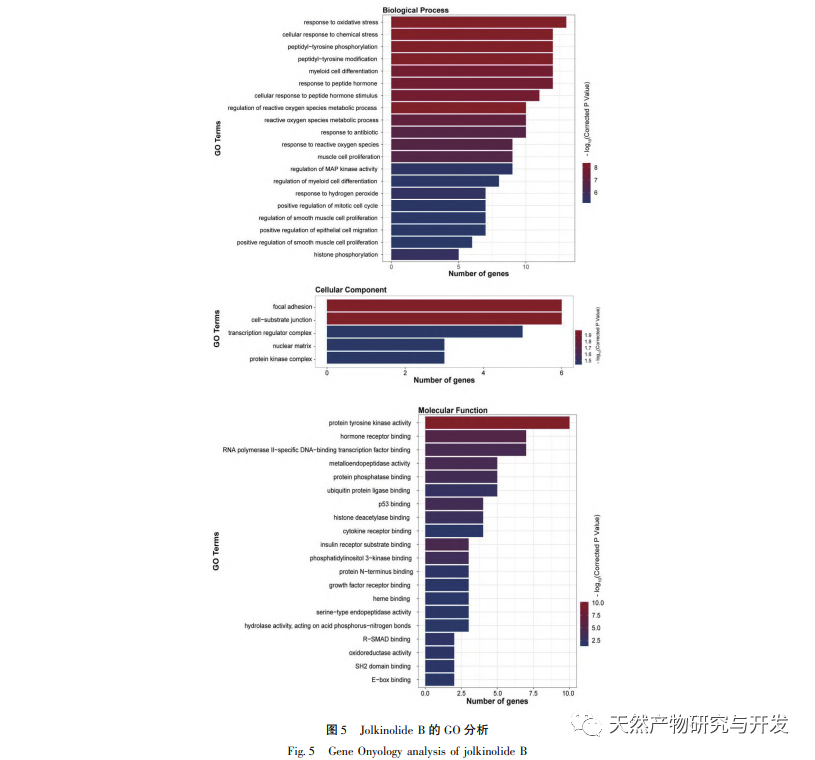
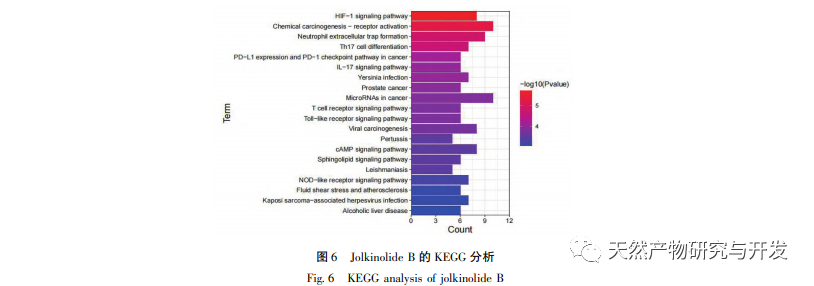
A GO annotációs eredmények azt mutatják, hogy a Jolkinolite B legtöbb célpontja a sejtmátrixban és a transzkripciós komplexekben található, és részt vesz a különböző stresszválaszokban és biológiai folyamatokban a sejtekben. Ez az eredmény arra utal, hogy a Jolkinolite B részt vehet a legtöbb sejtes élettevékenység szabályozásában. A KEGG dúsítási elemzés eredményei azt mutatják, hogy a Jolkinolite B farmakológiai hatásai több útvonal kölcsönhatását foglalják magukban, beleértve az IL-17 jelátviteli útvonalat, a PD-1 / PD-L1 jelátviteli útvonalat és a HIF-1 jelátviteli útvonalat. A molekuláris dokkolási eredmények azt mutatják, hogy a Jolkinolid B hidrogén- és hidrofób kölcsönhatásokat alakít ki a STAT3, MAPK8 és JUN központi fehérjékkel, stabil szerkezettel és potenciális kutatási értékkel, ami bizonyítja a Jolkinolid B több célpontot és több útvonalat érintő jellemzőit a CRC kezelésében.
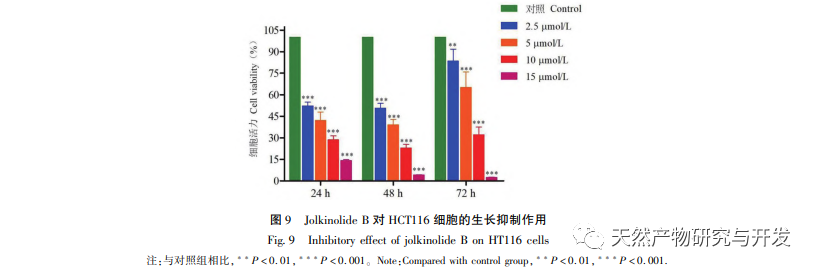
A daganatellenes gyógyszerek fő hatásmechanizmusa a tumorsejtek apoptózisának kiváltása, a sejtciklus gátlása és a migráció elnyomása. A kísérleti eredmények sejtszinten azt mutatták, hogy a Jolkinolite B jelentősen gátolta a HCT116 sejtek proliferációját, elősegítette a sejtek apoptózisát és gátolta a sejtvándorlást. Amikor a Bax nagymértékben kifejeződött a sejtekben, a sejtek érzékenyek voltak a haláljelekre és elősegítették az apoptózist. Amikor a Bcl-2 nagymértékben kifejeződött, a Bcl-2 heterodimert tudott képezni a Bax-szal, gátolva a sejtek apoptózisát. Tehát a Bax/Bcl-2 aránya a sejtekben fontos szerepet játszik a sejtek apoptózis érzékenységének meghatározásában. Ezért a Western blot validációs kísérletek sejtszinten azt mutatták, hogy a Jolkinolite B jelentősen felszabályozta a Bax/Bcl-2 arányát, elősegítve az apoptózist a HCT116 sejtekben. A hálózati farmakológiai elemzés eredményei alapján a Jolkinolid B több célponton és útvonalon keresztül avatkozhat be a CRC-ben, és daganatellenes aktivitása összefügghet a Bax és Bcl-2 apoptotikus gének expressziójára gyakorolt hatásával.
A daganatok inváziója és metasztázisának kialakulása összetett folyamat, amely magában foglalja a sejtek közötti kölcsönhatásokat és az extracelluláris mátrix lebomlását. Az extracelluláris mátrix lebontása a mátrixkomponenseket lebontó enzimek szintézisétől és aktiválásától függ. A mátrix metalloproteinázok (MMP-k) a cinkfüggő proteolitikus enzimek egy osztálya, amelyek szerkezeti homológiával rendelkeznek. Fő fiziológiai funkciójuk az extracelluláris mátrixkomponensek, például a kollagén, a zselatin, az elasztin, a fibronectin és a proteoglikánok lebontása. Kutatások kimutatták, hogy a mátrix metalloproteináz-3 (MMP-3) és a mátrix metalloproteináz-12 (MMP-12) döntő szerepet játszik a tumorsejtek által közvetített extracelluláris mátrix lebontásában, és szorosan összefügg a különböző rosszindulatú daganatok lehetséges inváziójával, metasztázisával és prognózisával az emberben. Ezért a sejtek szintjén végzett Western blot validációs kísérletek azt mutatták, hogy a Jolkinolid B jelentősen csökkenti az MMP-2 és az MMP-12 expresszióját a tumor invázió és metasztázis gátlása érdekében. A hálózati farmakológiai elemzés eredményei alapján a Jolkinolid B több célponton és útvonalon keresztül avatkozhat be a CRC-ben, és a tumorinvázió és metasztázis gátlása összefügghet az MMP-2 és az MMP-12 expressziójára gyakorolt hatásával.
Összefoglalva, ez a tanulmány aktivitásszűrést, bioinformatikai és molekuláris dokkolási technikákat alkalmazott a Jolkinolid B mechanizmusának elemzésére a kolorektális rák (CRC) megelőzésében és kezelésében a hagyományos kínai gyógyászatban lévő farkasbogyó Jolkinolid B hatóanyaga és a kapcsolódó célfehérjék, jelátviteli útvonalak és biológiai funkciók közötti hálózati korreláció alapján. Az eredmények azt mutatták, hogy ez a vegyület a CRC-t több célpont, útvonal és biológiai funkció segítségével kezeli, irányt adva a Jolkinolid B mechanizmusának további kutatásához a CRC megelőzésében és kezelésében. Ennek fényében ez a projekt a jövőben is folytatja a mechanizmus kutatását a molekuláris biológiai és a patofiziológiai módszerek kombinálásával.
