Molekuláris dokkoláson alapuló vizsgálat az acacetin J8 endotélsejtek proliferációs célpontjaira és az apoptózissal kapcsolatos sejtjelátviteli útvonalakra gyakorolt gátló hatásáról
Az akáckéreg az Albizia julibrissin Durazz hüvelyes szárított kérge. Édes és enyhe íze van, és a gyógyszerkönyvek a depresszió enyhítésére, az elme megnyugtatására, a vérkeringés elősegítésére és a duzzanat csökkentésére alkalmas hatásként tartják számon. Elsősorban olyan tünetek kezelésére használják, mint a nyugtalanság, depresszió, álmatlanság, tüdőtályog, sebek és esések okozta fájdalom. A modern farmakológiai vizsgálatok kimutatták, hogy az akáckéreg nyers kivonata és összes szaponinja in vivo és in vitro gátolja a tumorsejtek proliferációját. Híres orvosok, mint például Zhu Liangchun, jó klinikai eredményeket értek el a tüdőrák kezelésében olyan gyógyszerekkel, mint az akáckéreg. A daganatos angiogenezis elleni aktivitás irányítása alatt a projekt előzetes munkája során izolálták és tisztították az akác kéregből a tumor angiogenezist gátló hatékony komponenseket és hatóanyagokat, és azonosították hatóanyagukat, mint juliozid J8 (J8). A kutatási eredmények azt mutatták, hogy a J8 jelentős gátló hatással van az endotélsejtek proliferációjára. És képes a sejtek apoptózisát előidézni. Azonban még mindig nem világos, hogyan szabályozza a jelátvitelt a sejten kívülről és a sejtmembránon, citoplazmán keresztül a sejtmagba, hogy kifejtse hatását, és nincsenek kutatási jelentések itthon és külföldön. Ebben a tanulmányban molekuláris dokkolást alkalmaztunk in vitro sejtkísérletekkel kombinálva, hogy elemezzük a J8 endotélsejt-proliferációra gyakorolt gátló hatásának célpontjait és az apoptózissal kapcsolatos sejtjelátviteli útvonalakat.
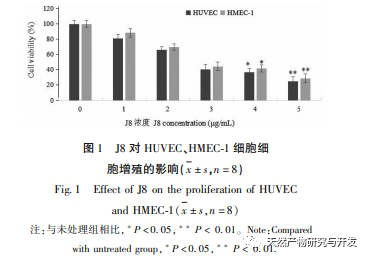
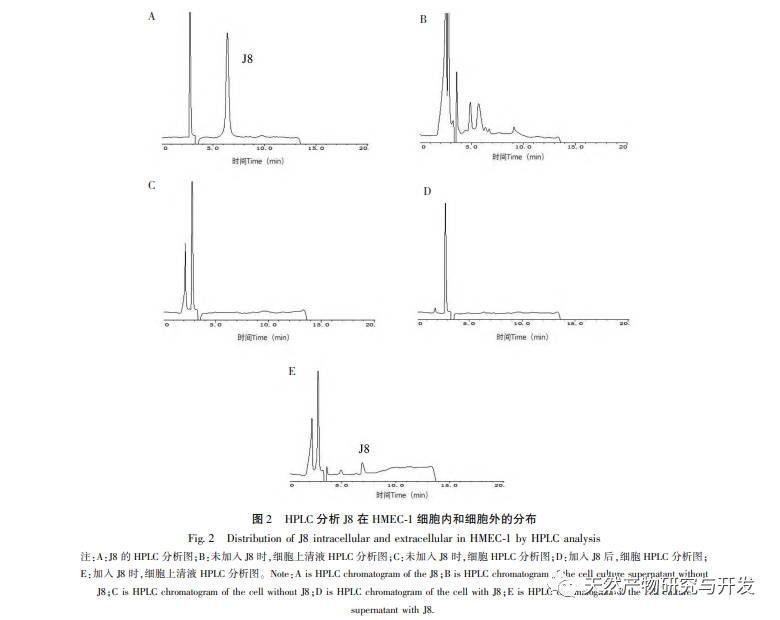
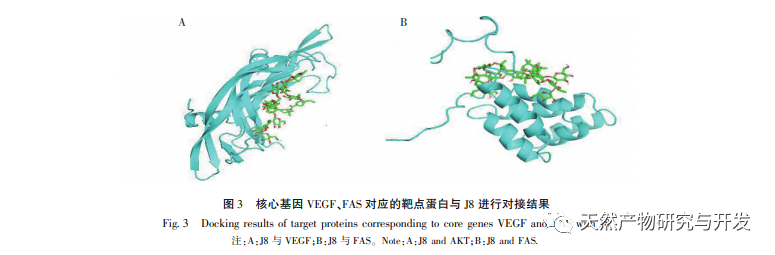
 A J8 egy szaponin, amelyet az akác kéregből izoláltak. Korábbi tanulmányok szerint mind in vitro, mind in vivo gátló hatással van a tumor angiogenezisére, és endotélsejt apoptózist indukálhat. Azonban az útvonal, amelyen keresztül a sejtek apoptózisát kiváltja, nem teljesen világos. A J8 által indukált endotélsejt-apoptózis mechanizmusának vizsgálata érdekében az irodalomban ismertetett extrakciós, izolálási és azonosítási módszerek alkalmazásával új mintatételeket állítottunk elő, és kimutattuk aktivitásukat. A J8 sejtekre gyakorolt hatásmechanizmusának vizsgálatához, hogy a J8 a sejtek belsejébe jut-e, vagy a sejtmembránon lévő felszíni fehérjékkel lép-e kölcsönhatásba, HPLC-t használtunk a J8 sejteken belüli és kívüli koncentrációjának kimutatására. Az eredmények azt mutatták, hogy a J8 nem jut be az endotélsejtek belsejébe, és csak a sejtmembránon lévő felszíni fehérjékkel lép kölcsönhatásba. Annak érdekében, hogy tovább vizsgáljuk a kölcsönhatását bizonyos fehérjékkel, a kísérletben először molekuláris dokkolást alkalmaztak a membránfehérjék FAS, FAS és FAS, amelyek az apoptózissal kapcsolatosak DR3、DR4、DR5、TFR-1, És azt találták, hogy a J8 csak a FAS-hoz és a VEGF-hez kötődik jól, amelyek a sejtproliferációval kapcsolatos fehérjék.
A J8 egy szaponin, amelyet az akác kéregből izoláltak. Korábbi tanulmányok szerint mind in vitro, mind in vivo gátló hatással van a tumor angiogenezisére, és endotélsejt apoptózist indukálhat. Azonban az útvonal, amelyen keresztül a sejtek apoptózisát kiváltja, nem teljesen világos. A J8 által indukált endotélsejt-apoptózis mechanizmusának vizsgálata érdekében az irodalomban ismertetett extrakciós, izolálási és azonosítási módszerek alkalmazásával új mintatételeket állítottunk elő, és kimutattuk aktivitásukat. A J8 sejtekre gyakorolt hatásmechanizmusának vizsgálatához, hogy a J8 a sejtek belsejébe jut-e, vagy a sejtmembránon lévő felszíni fehérjékkel lép-e kölcsönhatásba, HPLC-t használtunk a J8 sejteken belüli és kívüli koncentrációjának kimutatására. Az eredmények azt mutatták, hogy a J8 nem jut be az endotélsejtek belsejébe, és csak a sejtmembránon lévő felszíni fehérjékkel lép kölcsönhatásba. Annak érdekében, hogy tovább vizsgáljuk a kölcsönhatását bizonyos fehérjékkel, a kísérletben először molekuláris dokkolást alkalmaztak a membránfehérjék FAS, FAS és FAS, amelyek az apoptózissal kapcsolatosak DR3、DR4、DR5、TFR-1, És azt találták, hogy a J8 csak a FAS-hoz és a VEGF-hez kötődik jól, amelyek a sejtproliferációval kapcsolatos fehérjék.
A vaszkuláris endotél növekedési faktor A VEGF egy rendkívül specifikus pro-endotél növekedési faktor, amely elősegítheti az endotélsejtek proliferációját, migrációját, az érrendszeri permeabilitás növekedését és az angiogenezist. A VEGF aktivitásának gátlása jelentősen gátolhatja a daganatos erek kialakulását, ezáltal elérve a daganatellenes kezelés terápiás célját. A szakirodalom arról számol be, hogy az akáckéregből származó összes szaponinok jelentősen gátolhatják a tumoros erek kialakulását és elnyomhatják a VEGF aktivitását. A J8 az egyik szaponin, és a molekuláris dokkolás és az in vitro molekuláris kimutatás kimutatta, hogy a J8 képes kötődni a VEGF-hez, ezáltal gátolja az endotélsejtek proliferációját.
A modern molekuláris és sejtfarmakológiai kutatások szerint a sejtek apoptózisának jelátvitelét két útvonalra lehet osztani: exogén és endogén (mitokondriális) útvonalakra. Az exogén apoptotikus útvonalat az apoptózisreceptorok közvetítik, mint például a TNF-a, TRAIL, FAS-L. A Fas-L a FAS-hoz kötődve rekrutálja és összekapcsolja a FADD-t a sejt apoptózisának elindításához. A mitokondriumok az endogén sejt apoptózis szabályozó központja, amely a különböző jelátviteli útvonalak alapján kaszpázfüggő és nem kaszpázfüggő apoptotikus jelátviteli útvonalakra osztható. A FADD kötődése a kaszpáz-8-hoz a kaszpáz-8 dimerizációjához, azaz aktivációjához vezethet. Az aktivált kaszpáz-8 reaktiválja a kaszpáz-3/9-et, ami a sejtek apoptózisát indukálja. A nem kaszpázfüggő apoptotikus jelátviteli útvonal elsősorban az AIF és az EnDOG felszabadulásával valósul meg, mindkettő nagy mennyiségű DNS-fragmentációt és sejtapoptózist indukálhat. Kísérleti ellenőrzéssel megállapították, hogy a J8 (2,5 μ g/ml) HUVEC sejtekhez történő hozzáadása után a VEGF, a JNK és más fehérjék expressziója jelentősen lecsökkent, míg az apoptózissal kapcsolatos p-JNK, Bax és EnDOG fehérjék expressziója jelentősen felfelé szabályozódott. A J8 nem volt jelentős hatással a kaszpáz-3, kaszpáz-8 és kaszpáz-9 expressziós szintjére, és elősegíthette a JNK, egy stressz aktivált fehérje kináz foszforilációját. Az aktivált JNK útvonal szabályozhatja az apoptózissal kapcsolatos célgének kifejeződését, ezáltal sejt apoptózist indukálva. A Bax és az EnDOG a JNK útvonal downstream célgénjei. J8-mal történő kezelés után az expressziós szintjük is megnő, ami arra utal, hogy a J8 a VEGF/JNK útvonal aktivitásának gyengítésével okozhat sejthalált. E tanulmány eredményei azt sugallják, hogy a J8 elősegítheti az érrendszeri endotélsejtek apoptózisát a JNK jelátviteli útvonal szabályozásával, ötleteket adva más tudósok jövőbeli kutatásaihoz, és új kutatási gyógyszereket kínálva a tumor angiogenezis terápiájának gátlására. Ennek a tanulmánynak azonban vannak bizonyos hiányosságai is, és a JNK jelátviteli útvonal előtt és után lévő fehérjék átfogó kimutatására van szükség a jövőbeli kutatásokban. Az in vitro sejtkísérletek bizonyos eltéréseket mutathatnak, és a kísérleti eredményeket klinikai és állatkísérletekben kell validálni.
Összefoglalva, a J8 a VEGF-re hatva gátolja a sejtproliferációt, míg a JNK jelátviteli útvonal szabályozása elősegíti az érrendszeri endotélsejtek apoptózisát, és az apoptózis mértéke jelentősen nő a koncentráció növekedésével.
