Az emodin hatásmechanizmusának feltárása a szepszissel összefüggő akut vesekárosodás kezelésében adatbányászat és kísérleti ellenőrzés alapján
A szepszis olyan életveszélyes szervi működési zavar, amelyet a gazdaszervezet fertőzésre adott válaszának egyensúlyzavara okoz. A szepszisben a vesék az egyik leggyakrabban érintett szerv, és a szepszishez társuló akut vesekárosodás (SA-AKI) gyakran válik a szepszisben szenvedő betegek halálának közvetlen okává, magas halálozási aránnyal, ami példátlan kihívások elé állítja a klinikai orvosokat. Az AKI tartósan fennáll, és növeli a krónikus vesebetegség (CKD) potenciális kockázatát. A túlélő betegek gyakran elkerülhetetlenül végstádiumú vesebetegséggé (ESRD) fejlődnek, ami komoly veszélyt jelent életminőségükre és biztonságukra.
Sajnos a SA-AKI megelőzésére és kezelésére jelenleg nagyon korlátozottak a lehetőségek. Az aktív folyadék alapú terápia nem feltétlenül rendelkezik megbízható, bizonyítékokon alapuló orvoslással, és akár káros is lehet. A vérnyomás fenntartására szolgáló vazoaktív gyógyszerek alkalmazása egyensúlyt igényel a nagy keringés és a mikrocirkuláció között, és nincs konszenzus arról, hogy mekkora célértéket kell fenntartani a vérnyomásnak, hogy segítsen megelőzni az AKI kialakulását. Ha a veseprevenció nem sikerül, a kezeléshez vesepótló terápiát (RRT) kell alkalmazni, de az RRT-beavatkozás optimális időzítése és módja nem egyértelmű. Ha az SA-AKI betegek túlélik, bár a legtöbb beteg vesefunkciója helyreáll, a vese helyreállításának mechanizmusairól vagy a vesefunkció helyreállításának kudarcáról keveset tudunk, és a CKD és az ESRD kialakulásának élethosszig tartó kockázata magasabb. Eddig nincs határozott és megbízható gyógyszer az AKI kezelésére. A hagyományos klinikai kezelési intézkedések elsősorban a vesepótlás és a tüneti átfogó kezelés. A vesefunkció helyreállítása magának a vesének a szervezet egészének megbízható támogatásától függ. Ezért az olyan gyógyszerek vagy intézkedések feltárása, amelyek hatékonyan megelőzhetik vagy kezelhetik az SA-AKI-t korai és időben, elkerülhetik a krónikus vesebetegség kialakulását vagy elősegíthetik a vese helyreállítását, fontos klinikai értékkel bír a szepszisben szenvedő betegek halálozási arányának csökkentése és a túlélő betegek életminőségének javítása szempontjából.
Az emodin egy természetes vegyület, amelyet kínai gyógynövényekből, például rebarbarából és Polygonum cuspidatumból vonnak ki, és amely különböző farmakológiai hatásokkal rendelkezik, például gyulladáscsökkentő, vírusellenes és daganatellenes. Korábbi tanulmányok megerősítették, hogy az emodin védő hatással van a szepszisben szenvedő betegekre; A legújabb tanulmányok kimutatták, hogy az emodin védő hatással rendelkezik az oxidatív stressz, a gyulladás és a sejt apoptózis okozta károsodással szemben. Azonban még mindig nem világos, hogy az emodin javíthatja-e a SA-AKI betegek prognózisát. Ez a tanulmány feltárja az SA-AKI patogenezisében szerepet játszó kulcsfontosságú géneket az élettudományokkal kapcsolatos adatbázisokon keresztül, és elemzi az ezekben a kulcsfontosságú génekben részt vevő gyulladásos jelátviteli utakat; Továbbá állatkísérleteket végeztek annak vizsgálatára, hogy az emodin befolyásolja-e az SA-AKI gyulladásos útját, valamint védőhatását és mechanizmusát SA-AKI patkányokon, új ötleteket nyújtva a megelőzéshez és kezeléshez.
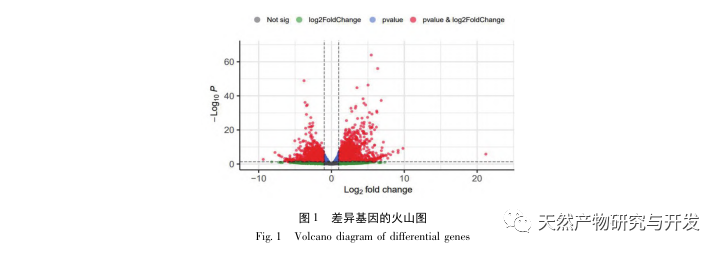
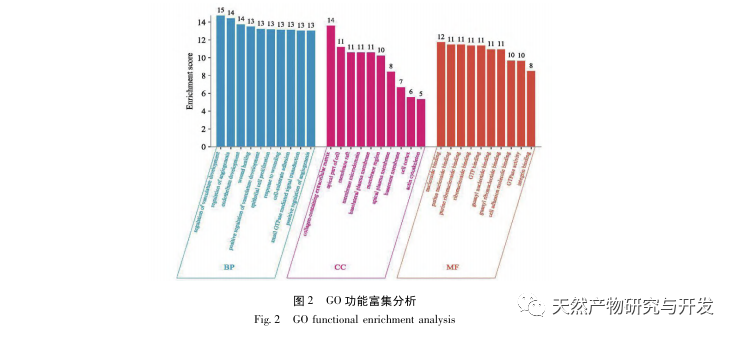
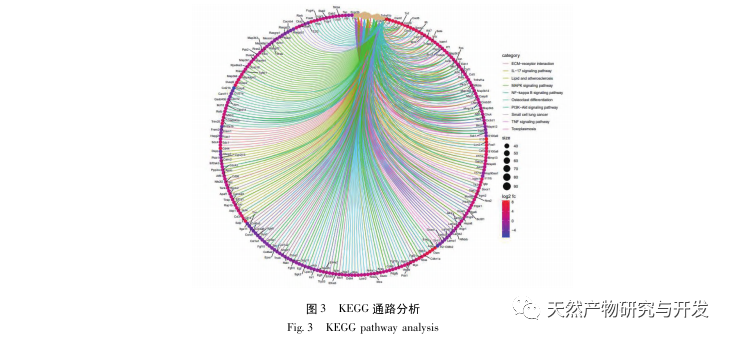

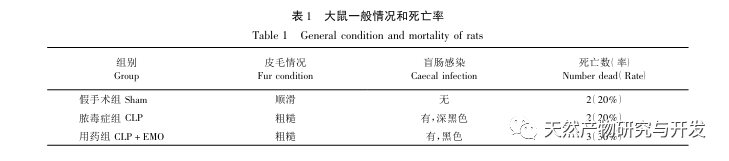
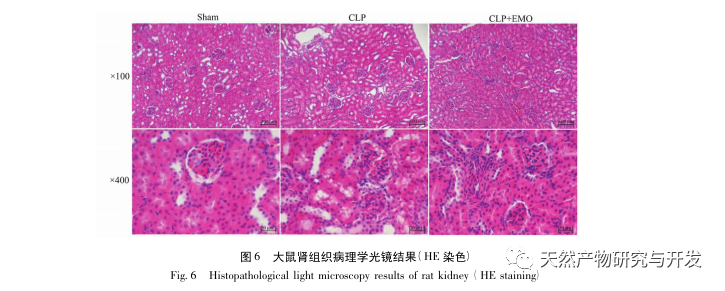
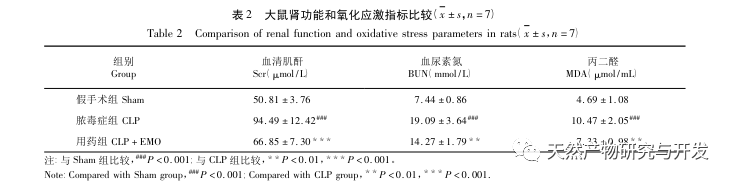


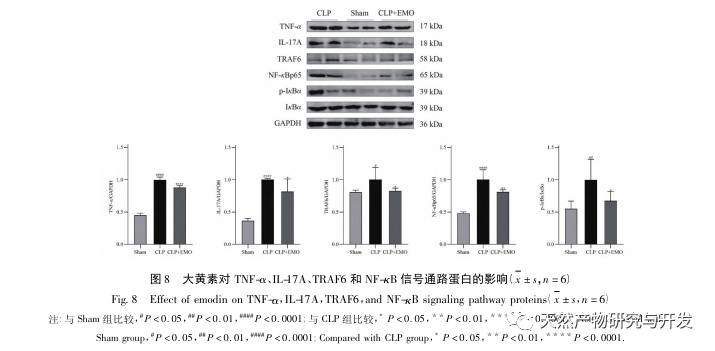
A kutatások kimutatták, hogy az SA-AKI patogenezise többtényezős és összetett, és magában foglalja a gyulladás, a mikrokeringési zavar és a metabolikus átprogramozás kölcsönhatását. Patofiziológiája több sejttípus károsodását és diszfunkcióját foglalja magában. A szepszis során a baktériumok endotoxinokat vagy endotoxinszerű anyagokat bocsátanak ki, amelyek a szervezetben lévő gyulladásos sejteket, például neutrofileket, monocitákat és endotélsejteket aktiválják, és nagy mennyiségű endogén gyulladásos mediátort bocsátanak ki a véráramba. Ez egyrészt több szervet, köztük a vesét is károsítja, másrészt még több gyulladásos sejtet aktivál a betegségben való részvételre, rosszindulatú immunhálózati választ képezve. A lipopoliszacharid (LPS) - indukálta SA-AKI SD patkány modelljében a nerolidol az NF - κ B és a Toll like receptor 4 (TLR4) jelátviteli útvonalak gátlásával enyhíti a SA-AKI-t. A TLR4/NF - κ B jelátviteli útvonal bizonyítottan részt vesz a vese gyulladásos válaszának folyamatában, és a TLR4/NF - κ B által közvetített gyulladásos válasz gátlása védő hatású az LPS-indukált AKI-ra. Látható, hogy a gyulladásos válasz fontos mechanizmus a SA-AKI patogenezisében, és a gyulladásos válasz útvonalának gátlása fontos kezelési lehetőség a szepszisben, ami új ötleteket nyújt a SA-AKI betegek klinikai kezeléséhez.
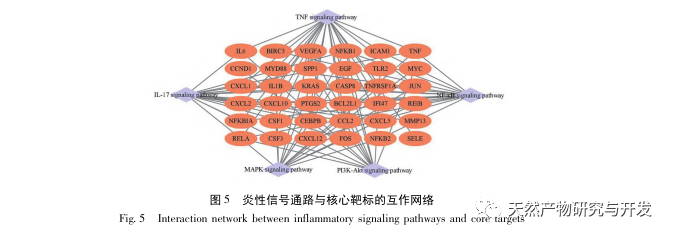
Ez a tanulmány egy biológiai adatbázist használt fel az SA-AKI patogenezisében szerepet játszó 2801 kulcsfontosságú célpont elemzésére. E célpontok KEGG-elemzése összesen 5 kulcsfontosságú gyulladásos válasz jelátviteli útvonalat tárt fel, amelyek közül a TNF jelátviteli útvonal és az IL-17 jelátviteli útvonal magasan rangsorolt, és az NF - κ B jelátviteli útvonal mindkét útvonal számára hubként szolgált a SA-AKI patogenezisében való részvételhez. A TNF jelátviteli útvonalban a TNF - α nemcsak az NF - κ B jelátviteli útvonal kulcsfontosságú upstream aktivátora, hanem az NF - κ B jelátviteli útvonal downstream reagáló molekulájaként is szolgál, ami arra utal, hogy pozitív visszacsatolással elősegíti az NF - κ B jelátviteli útvonalat, és a kettő kiegészíti egymást. Az IL-17 jelátviteli útvonalban az IL-17A az IL-17 család fő iniciáló faktorának számít, és a Th17 sejtek a fő szekretáló sejtjei. A CLP indukált modellben azt találták, hogy az IL-17A nagymértékben expresszálódik a hasüregben, és kulcsszerepet játszik a súlyos szepszist követő gyulladásos válaszban. Az IL-17A semlegesítése a hasüregben csökkentheti a pro-inflammatorikus citokinek termelődését. Eközben vizsgálatok kimutatták, hogy a dendritikus sejtekben (DC-k) lévő Toll-like receptor 9 (TLR9) kulcsszerepet játszhat a SA-AKI kialakulásában azáltal, hogy közvetíti a gamma delta T-sejtek IL-17A termelését; Más vizsgálatok kimutatták, hogy az IL-17A kiütése megakadályozhatja a SA-AKI kialakulását. A fentiek arra utalnak, hogy a TNF - α és az IL-17A pro-inflammatorikus faktorok a szepszisben, és a TNF jelátviteli útvonal és az IL-17 jelátviteli útvonal széles körben részt vesz a szepszis kialakulásában és fejlődésében, ami összhangban van az adatelemzés eredményeivel.
A szepszis emodinnal történő kezeléséről számos tanulmány készült, elsősorban az agy, a vér, a szív, a bél és a tüdő szöveteire összpontosítva. A szepszishez társuló enkefalopátiában (SAE) az emodin javíthatja a kognitív károsodást és a kóros károsodást, és gátolhatja a CLP által kiváltott gyulladást egerekben a BDNF/TrkB jelátvitel felszabályozásával. A vérrendszerben az emodin lefelé szabályozza a P-szelektint, javítja a vérlemezkék számát és aggregációs képességét a szepszis késői szakaszában, valamint fokozza az endogén véralvadási faktorok aktivitását és a fibrinogén funkcióját, gyulladáscsökkentő hatást fejt ki. Szeptikus kardiomiopátiában azt találták, hogy az emodin visszafordíthatja a szívműködési zavarokat és javíthatja a szívizom állapotát szeptikus patkányoknál, ami összefüggésben lehet az inflammaszóma aktivációjának gátlásával. A szepszis okozta bélsérülésben az emodin javíthatja a bélnyálkahártya károsodását a gyulladásos faktorok és az oxidatív stressz markerek szintjének csökkentésével, és hatásmechanizmusa a VDR/Nrf2/HO-1 útvonalhoz kapcsolódhat; és a szoros kötés (TJ) fehérje expressziós szintjének növelésével védi a bélgát integritását és gátolja a bélgát permeabilitását. A gyulladásos válasz és a bél barrier funkciójának javítása mellett az emodin megakadályozhatja az Escherichia coli kiszorulását, megakadályozhatja a baktériumok terjedését és átvitelét, és csökkentheti a baktériumok által okozott másodlagos károkat. A szepszishez kapcsolódó akut tüdőkárosodásban az emodin gátolhatja az NF - κ B és a nagy mobilitású csoportbox 1 (HMGB1) útvonalakat, ezáltal csökkentve a tüdő oxidatív stresszét és a gyulladásos választ. Egy másik, a tüdőre vonatkozó tanulmány az autofágia útvonalán alapul, és az emodin beavatkozása hatékonyan megakadályozhatja az akut tüdőkárosodás progresszióját. Ezenkívül más tanulmányok kimutatták, hogy az emodin hatékonyan enyhítheti a tüdőszöveti ödémát a szepszis által kiváltott akut tüdősérülésben az aquaporin (AQP), a TJ, a gyulladásos faktorok és a tüdősejt apoptózis szabályozásával. Az emodin SA-AKI-ra vonatkozó vizsgálatáról még nem számoltak be. E vizsgálat révén megállapították, hogy az emodinnal kezelt CLP modell patkányoknál az ELISA eredmények alapján csökkent a TNF - α, IL-17 és IFN - γ expressziója, ami összhangban van az emodin szepszis gyulladásra gyakorolt gátló hatásával.
Az emodin ugyanilyen hatását a Th17/Treg gyulladásos tengelyre is megvizsgálták. Az akut pancreatitis vizsgálatában azt találták, hogy az emodin gátolja az immunválaszt súlyos akut pancreatitisben az IFN - γ/IL-17 arányának szabályozásával, ezáltal enyhítve a bélgát diszfunkcióját. Ez a tanulmány pedig azt találta, hogy SA-AKI-ban az emodin szintén csökkentheti az IL-17A expresszióját és javíthatja a gyulladásos választ.
Összefoglalva, ez a tanulmány adatbányászattal 2801 kulcsfontosságú gént azonosított, amelyek részt vesznek az emodin patogenezisében. A GO biológiai folyamatok elemzése arra utal, hogy e célpontok biológiai funkciói főként a membrán jelátvitelt, az érrendszeri szabályozást és a sebgyógyulást érintik. A KEGG útvonalak gazdagodási elemzése azt mutatta, hogy a TNF, IL-17, PI3K Akt, NF - κ B és MAPK jelátviteli útvonalak a gyulladással kapcsolatos jelátviteli útvonalakban gazdagodtak. A kísérleti ellenőrzés azt mutatta, hogy az emodin kezelés javította a vesefunkciót SA-AKI-ban, és csökkent az oxidatív stressz (MDA) és a gyulladásos citokinek (TNF - α, IL-17 és IFN - γ) szintje. Az IL-17A, TNF - α, TRAF6, NF - κ Bp65 fehérjeexpressziója és az I κ B α foszforilációs szintje szignifikánsan csökkent a CLP csoporthoz képest, ami összhangban van az adatelemzés eredményeivel. Ez azt sugallja, hogy az emodin javíthatja az SA-AKI-t patkányokban, ami összefügghet az IL-17/NF - κ B és a TNF/NF - κ B jelátviteli útvonalakkal.
