Estudio sobre el efecto terapéutico y el mecanismo del glucósido feniletanoide de Cistanche deserticola en ratas modelo de mal crónico de altura
El mal de altura es un término general que designa diversas manifestaciones clínicas causadas por la incapacidad del organismo para adaptarse a la hipoxia de baja presión a grandes altitudes, lo que provoca una serie de cambios patológicos y fisiológicos en el organismo. Esta enfermedad se divide generalmente en dos categorías: aguda y crónica. El mal de montaña crónico (MMC) se refiere a una afección en la que los síntomas originales del mal de montaña agudo persisten o aparecen más de seis meses después de llegar a gran altitud. Los investigadores han descubierto que los genes Egl9 homólogo 1 (EGLN1) y del receptor alfa activado por el proliferador de peroxisomas (PPAR - α) en la población tibetana son diferentes de los de las zonas de baja altitud, y pueden inhibir la hemoglobina en la sangre tibetana, manteniéndola en una concentración baja. Esta es también parte de la razón por la que los tibetanos pueden sobrevivir a grandes altitudes. Este estudio sugiere que los dos genes mencionados anteriormente son genes candidatos en la vía de respuesta a la hipoxia, ejerciendo en última instancia sus efectos a través de la vía del factor 1 alfa inducible por hipoxia (HIF-1 alfa). EGLN1 es el gen ascendente de HIF-1 α, mientras que PPAR - α es la diana descendente de HIF-1 α.
El oxígeno bajo puede bloquear la hidroxilación y acetilación de HIF-1 α, aumentar su estabilidad e inducir la transmisión de información de transcripción de genes mediante la regulación de la transcripción y expresión de genes descendentes como el factor de crecimiento endotelial vascular (VEGF), la endotelina-1 (ET-1), etc., provocando así la remodelación vascular pulmonar y conduciendo además al edema pulmonar y la cardiopatía de gran altitud. Contrariamente a la acción de la ET-1, el óxido nítrico (NO) es una molécula de señalización gaseosa que cataliza la producción de L-arginina por la óxido nítrico sintasa (NOS) y tiene una amplia gama de efectos.
En este estudio se utilizó una cabina experimental artificial de ambiente especial en el noroeste para simular el entorno de bajo oxígeno de la meseta. Teniendo en cuenta las principales diferencias entre la meseta y las zonas de llanura, se estableció un modelo animal del mal de altura para investigar el papel y la relación intrínseca de la vía HIF-1 α en la patogénesis del mal de altura. Sobre esta base, se observaron los efectos preventivos y terapéuticos de los glucósidos feniletanoides de Cistanche (PhGCs) en el mal de altura y sus mecanismos, proporcionando una base teórica para estudiar la patogénesis del mal de altura y desarrollar nuevos fármacos contra el mal de altura.

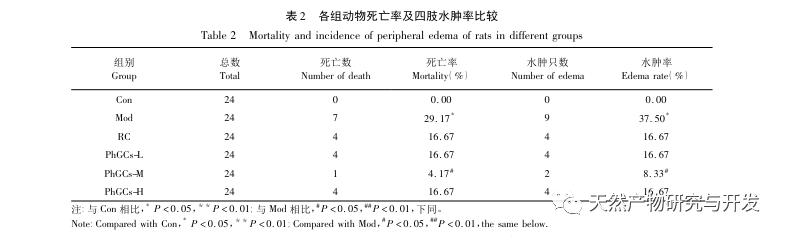
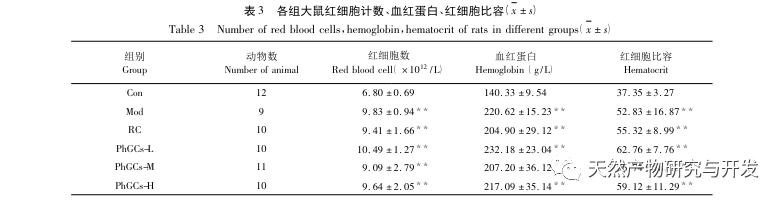


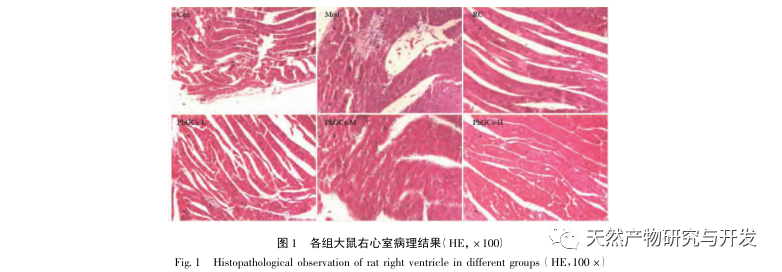


 Los PhGC se extrajeron de la Cistanche deserticola en el sur de Xinjiang, y se aislaron con éxito varios glucósidos feniletanólicos mediante investigaciones relacionadas, como el equinacósido, el verbascósido, el isoverbascósido, el 2'- acetil verbascósido, el glucósido A de la Cistanche deserticola y el salidrósido. Durante muchos años, se han llevado a cabo investigaciones exhaustivas sobre los efectos farmacológicos de los PhGC, como antioxidante, eliminación de radicales libres y antienvejecimiento. En este experimento, el grupo PhGCs-M fue capaz de reducir significativamente el índice de hipertrofia ventricular derecha en ratas, lo que indica que el ácido feniletanólico de Cistanche deserticola puede mejorar la hemodinámica y el grado de hipertrofia ventricular derecha en ratas CMS, y tiene un cierto efecto terapéutico en CMS. Este estudio especula a partir de indicadores relacionados con la saturación de oxígeno en sangre que los PhGCs aumentan la saturación de oxígeno en sangre, reducen el daño de la hipoxia en el organismo y aumentan la tolerancia del organismo al daño de la hipoxia bajo el mismo recuento de glóbulos rojos y contenido de hemoglobina, logrando así el objetivo de tratar el mal de altura. Tras el tratamiento con PhGCs, la tasa de mortalidad y la incidencia de edema de las extremidades en ratas CMS disminuyeron significativamente, lo que demuestra aún más su eficacia en el tratamiento del CMS.
Los PhGC se extrajeron de la Cistanche deserticola en el sur de Xinjiang, y se aislaron con éxito varios glucósidos feniletanólicos mediante investigaciones relacionadas, como el equinacósido, el verbascósido, el isoverbascósido, el 2'- acetil verbascósido, el glucósido A de la Cistanche deserticola y el salidrósido. Durante muchos años, se han llevado a cabo investigaciones exhaustivas sobre los efectos farmacológicos de los PhGC, como antioxidante, eliminación de radicales libres y antienvejecimiento. En este experimento, el grupo PhGCs-M fue capaz de reducir significativamente el índice de hipertrofia ventricular derecha en ratas, lo que indica que el ácido feniletanólico de Cistanche deserticola puede mejorar la hemodinámica y el grado de hipertrofia ventricular derecha en ratas CMS, y tiene un cierto efecto terapéutico en CMS. Este estudio especula a partir de indicadores relacionados con la saturación de oxígeno en sangre que los PhGCs aumentan la saturación de oxígeno en sangre, reducen el daño de la hipoxia en el organismo y aumentan la tolerancia del organismo al daño de la hipoxia bajo el mismo recuento de glóbulos rojos y contenido de hemoglobina, logrando así el objetivo de tratar el mal de altura. Tras el tratamiento con PhGCs, la tasa de mortalidad y la incidencia de edema de las extremidades en ratas CMS disminuyeron significativamente, lo que demuestra aún más su eficacia en el tratamiento del CMS.
El NO, como vasodilatador dependiente del endotelio, desempeña un papel importante en la vasodilatación endotelial porque relaja directamente el músculo liso vascular pulmonar, lo que produce una vasodilatación pulmonar significativa. También tiene la capacidad de inhibir la proliferación y migración de las células musculares lisas vasculares pulmonares, suprimir la agregación plaquetaria y desempeñar un papel importante en el mantenimiento de la estabilidad de la circulación pulmonar. En este estudio se observó que el contenido de NO en el homogeneizado de tejido pulmonar de Mod disminuía, así como las actividades de T-NOS, iNOS y eNOS. PhGCs puede aumentar el contenido de NO en el tejido pulmonar mediante la mejora de las actividades de TNOS, iNOS, y eNOS, desempeñando un papel en la lucha contra la proliferación y miometrización del músculo liso de la arteria pulmonar y el tratamiento de la CMS.
La ET-1 es el vasoconstrictor más potente descubierto hasta ahora, y la hipoxia puede aumentar significativamente el nivel de ET-1 en la sangre. Rajput et al. compararon las diferencias en los alelos de ET-1 entre los residentes de altitud elevada y los de llanura y descubrieron que ciertos alelos de ET-1 se sobreexpresaban en los residentes de altitud elevada, y la expresión del alelo ET-l se correlacionaba significativamente con los niveles de ET-1 en plasma. En este artículo, el contenido de ET-1 en el tejido pulmonar de las ratas Mod aumentó significativamente, lo que indica que la hipoxia indujo un aumento de la secreción de ET-1 en el tejido pulmonar, en consonancia con otros estudios. La administración de PhGCs puede disminuir el contenido de ET-1 en el tejido pulmonar de ratas CMS, lo que indica que PhGCs puede inhibir la constricción vascular inducida por ET-1, reducir la presión arterial pulmonar, y ejercer efectos terapéuticos en CMS.
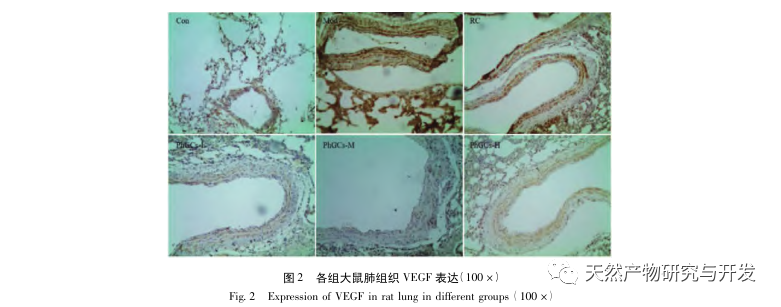
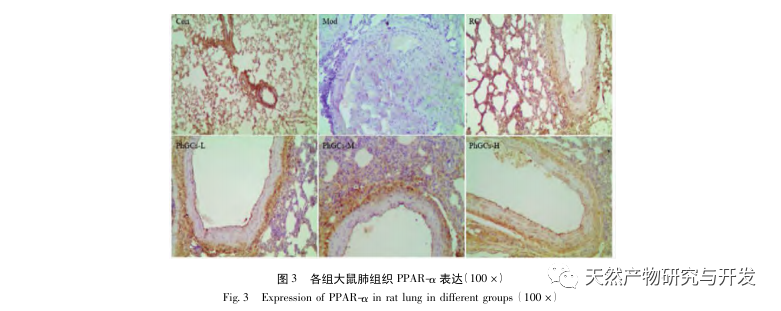
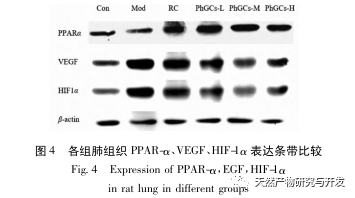
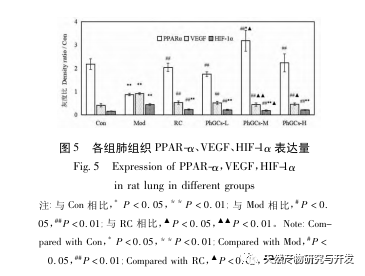
Posteriormente, nos centramos en la observación de los efectos de PhGCs en HIF-1 α, VEGF, y PPAR - α en la vía inducida por la hipoxia. La expresión de ARNm y proteínas en los tejidos pulmonares de las ratas de cada grupo se detectó mediante métodos de inmunohistoquímica, PCR cuantitativa por fluorescencia y Western blot. Los resultados inmunohistoquímicos mostraron que el nivel de expresión de VEGF en las arterias pulmonares de las ratas Mod era superior al de las ratas Con, mientras que el nivel de expresión de PPAR-α era inferior al de las ratas Con. Los niveles de expresión de VEGF en las arterias pulmonares de PhGCs baja, media, PhGCs-H, y los grupos de RC fueron inferiores a los de Mod, mientras que el nivel de expresión de PPAR - α aumentó. Esto indica que PhGCs y Rhodiola rosea puede inhibir la expresión de VEGF inducida por la hipoxia, promover PPAR - α expresión, y aliviar la proliferación vascular pulmonar y la miogénesis, desempeñando así un papel terapéutico en la CMS. A través de la medición experimental de la expresión de HIF-1 α proteína y ARNm en el tejido pulmonar, se encontró que la expresión de HIF-1 α proteína en el tejido pulmonar de ratas modelo CMS aumentó significativamente, mientras que la expresión de ARNm y Con no mostró diferencias. Esto concuerda con los resultados de las investigaciones pertinentes que muestran que la hipoxia regula principalmente la expresión de la proteína HIF-1 α. PhGCs puede reducir significativamente los niveles de expresión de HIF-1 α proteína y ARNm, lo que indica que pueden tener un impacto en la transcripción y traducción de HIF-1 α. Sin embargo, Rhodiola rosea no tuvo ningún efecto significativo sobre la expresión de HIF-1 α ARNm, lo que indica que afecta principalmente a la expresión de proteínas como la hipoxia.
En general, entre las tres dosis de PhGCs, el grupo PhGCs-M mostró el mejor efecto sobre la CMS, mientras que el tratamiento PhGCs-H no mostró una mejora significativa, lo que puede estar relacionado con la disminución de la tasa de absorción intestinal de PhGCs-H. En comparación con Rhodiola rosea, PhGCs-M tiene un mejor efecto terapéutico sobre los indicadores HIF-1 α mRNA y VEGF mRNA. Junto con las ventajas de los recursos, los PhGCs tienen ciertas perspectivas de desarrollo.
