Evaluación por simulación informática de péptidos inhibidores de la lipasa pancreática en la proteína de la sangre de camello
En los últimos años, con la mejora del nivel de vida de la población y los cambios en los hábitos alimentarios, la hiperlipidemia (HLP) se ha convertido gradualmente en el "asesino número uno" que pone en peligro la salud humana. Esta enfermedad está causada por una desregulación del metabolismo de los lípidos en el organismo. Dada la estrecha relación entre la absorción del colesterol y el metabolismo de los lípidos, la vía de absorción del colesterol se ha convertido en un importante objetivo de intervención para el tratamiento de la hiperlipidemia, que puede prevenir eficazmente la hiperlipidemia reduciendo la absorción del colesterol en el intestino. Los lípidos ingeridos de la dieta son hidrolizados primero por la lipasa pancreática, descompuestos en ácidos grasos y monoglicéridos, formando micelas con colesterol, sales biliares, etc., y finalmente absorbidos por las células del intestino. Por lo tanto, inhibir eficazmente la actividad de la lipasa pancreática (PL) puede reducir la absorción de lípidos por el organismo, aliviar la afección desde su origen y prevenir enfermedades. Algunos fármacos comercializados tienen ciertos efectos secundarios que pueden causar molestias a los pacientes. Por lo tanto, es urgente desarrollar sustancias bioactivas de origen natural para ayudar en el tratamiento de la hiperlipidemia.
Los péptidos bioactivos se han convertido en los últimos años en un punto caliente de la investigación debido a sus amplias fuentes y a su alto factor de seguridad. La sangre de camello tiene un alto contenido proteínico, con un contenido proteínico total de 6,80g/dL y un contenido de hemoglobina de 141,11g/L, superior al de otros ganados. También tiene una rica variedad de aminoácidos, que cumplen los valores recomendados por la OMS/FAO/UNU, y es una fuente potencial de péptidos bioactivos de alta calidad. Y las investigaciones han demostrado que los hidrolizados de proteasa de sangre de camello tienen efectos antifatiga, antioxidantes y reductores de la presión arterial. Por lo tanto, la preparación de péptidos inhibidores de la lipasa pancreática a partir de proteínas de sangre de camello tiene cierto valor para la investigación.
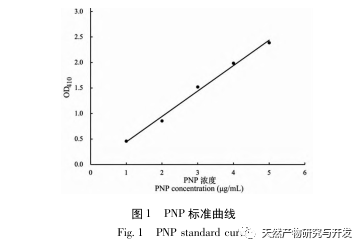
En este estudio se utilizó proteasa neutra para hidrolizar la proteína de sangre de camello, y la tasa de inhibición de la lipasa pancreática como índice de evaluación para optimizar el proceso de hidrólisis enzimática. Para determinar la distribución del peso molecular de los péptidos de sangre de camello se utilizó la espectrometría de masas por tiempo de vuelo de desorción/ionización láser asistida por matriz (MALDI-TOF-MS), y para identificar y analizar los péptidos de sangre de camello se empleó la cromatografía líquida-espectrometría de masas (LC-MS). Se utilizó PepSite2 para modelizar y predecir los sitios de unión, y se empleó la simulación de dinámica molecular para evaluar los sitios de unión y los modos de acción de los péptidos estudiados, proporcionando una base para la identificación y el análisis de los péptidos de sangre de camello en el futuro. El estudio de los péptidos inhibidores de la lipasa proporciona referencias y nuevas ideas para el desarrollo y la utilización de la sangre de camello.
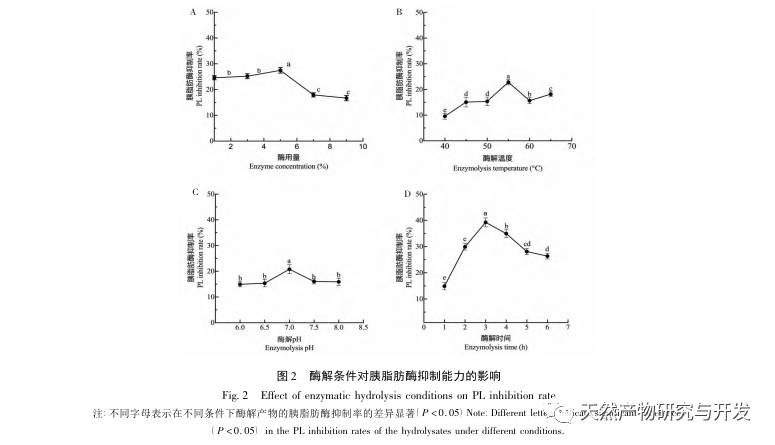
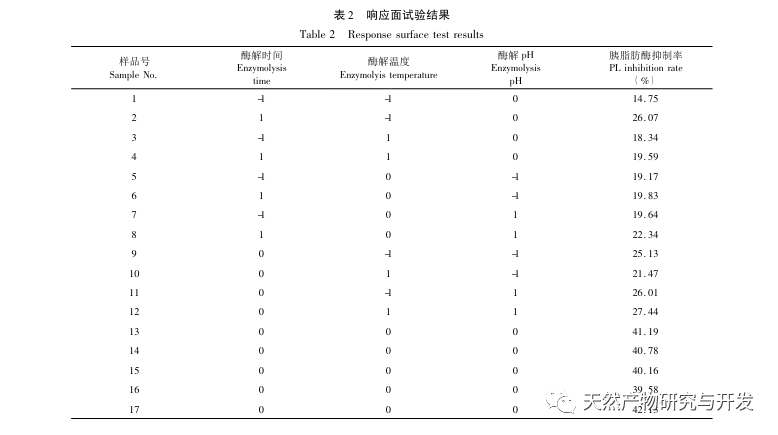
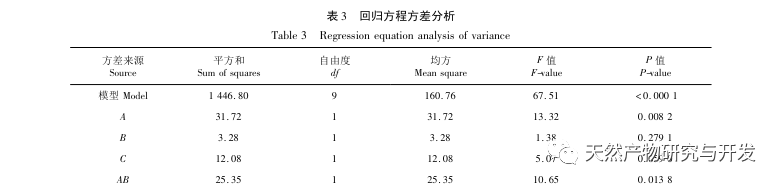
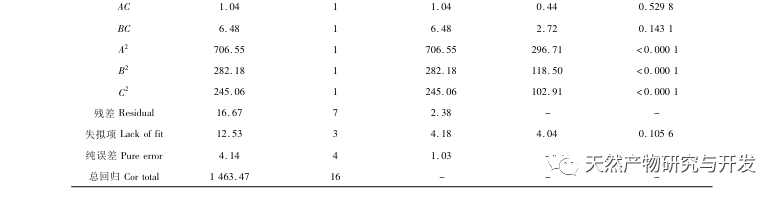
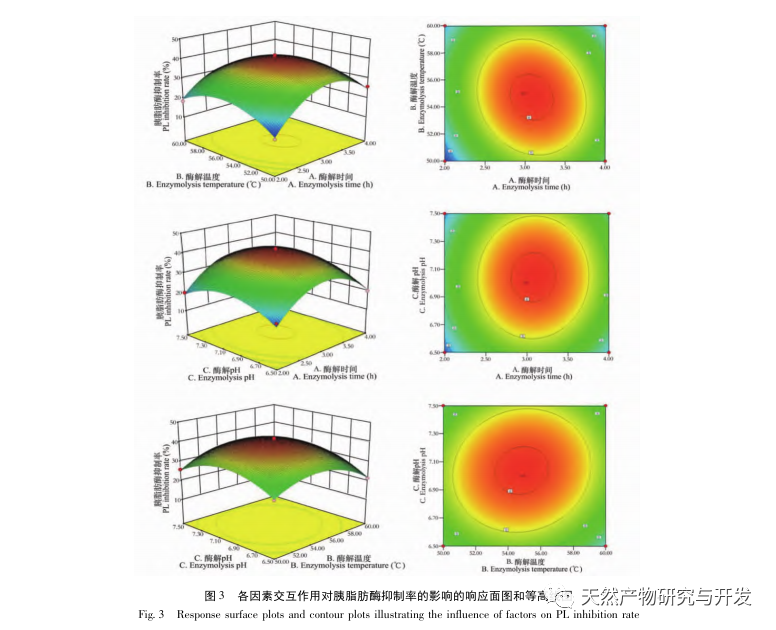
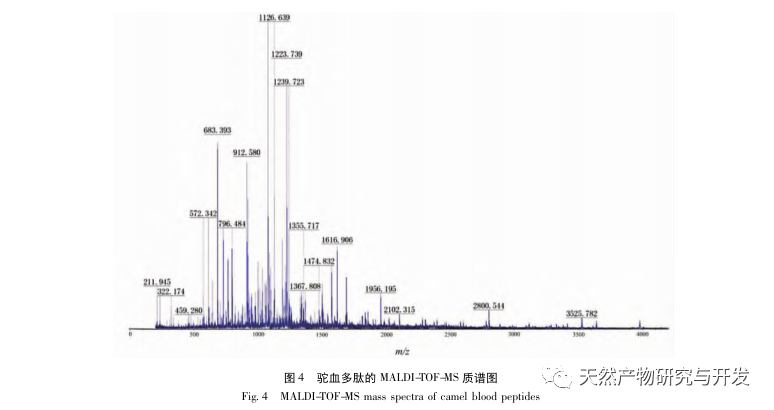


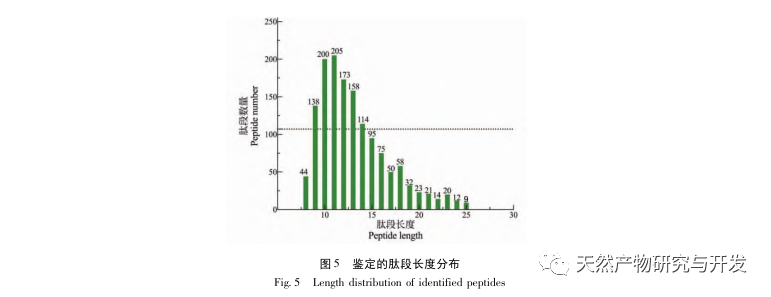
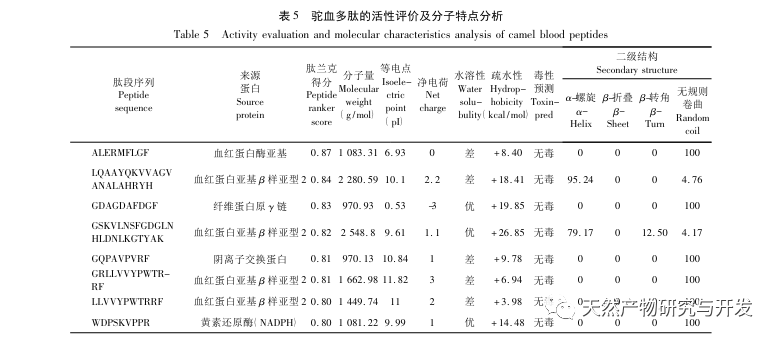

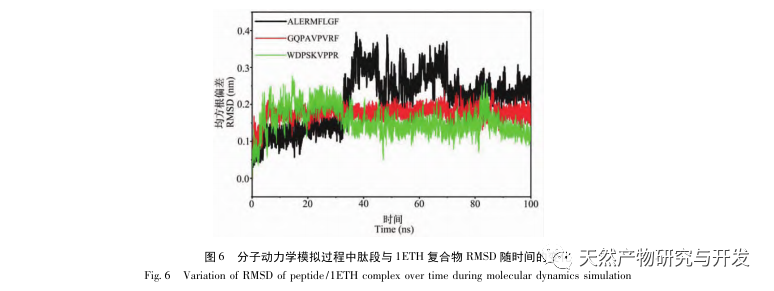
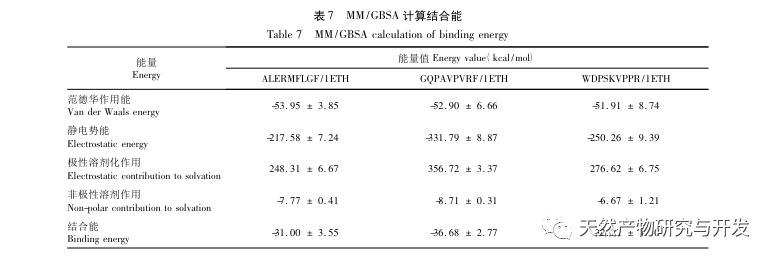
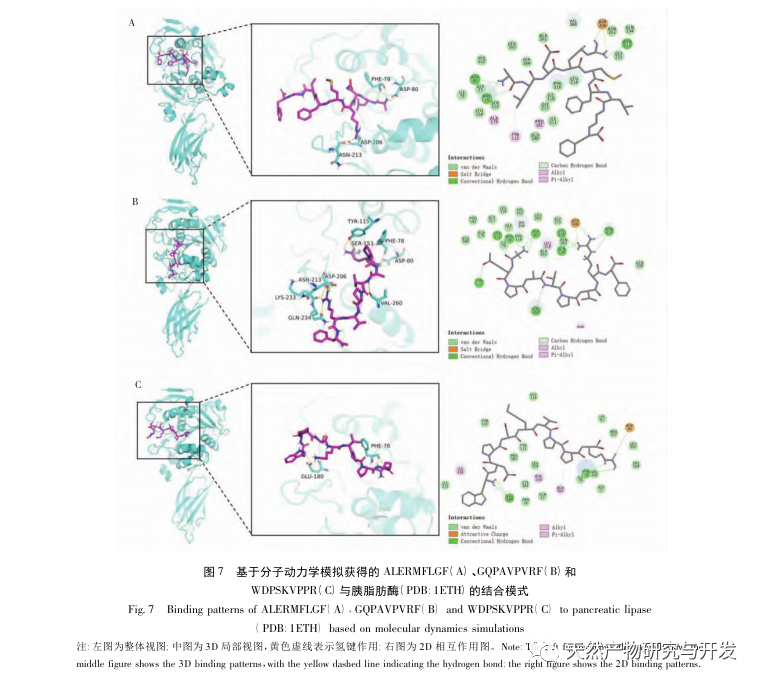
La inhibición de la lipasa pancreática se considera una de las intervenciones terapéuticas importantes para la hiperlipidemia y la obesidad. Este estudio optimizó el proceso de preparación de péptidos inhibidores de la lipasa pancreática de sangre de camello por hidrólisis de proteasa neutra basándose en la actividad inhibidora de la lipasa pancreática mediante experimentos de factor único y superficie de respuesta. En condiciones óptimas, la tasa de inhibición de la lipasa pancreática del péptido de sangre de camello fue de 42,13%. Analizando los productos de la hidrólisis enzimática mediante MALDI-TOF-MS, LC-MS y tecnología bioinformática, se identificaron tres segmentos peptídicos, ALERMFLGF, GQPAVPVRF y WDPSKVPPR, que se unían significativamente a la lipasa pancreática. Mediante simulaciones de dinámica molecular, se descubrió que los tres segmentos peptídicos se unen principalmente a los residuos de aminoácidos del sitio activo de la PL a través de enlaces de hidrógeno e interacciones hidrofóbicas, perturbando la función de la válvula del dominio N-terminal de la lipasa pancreática e inhibiendo su actividad. Entre ellos, GQPAVPVRF tiene una alta energía libre de unión y un gran número de enlaces de hidrógeno en 100ns, lo que significa que puede unirse fuertemente a 1ETH y se espera que se convierta en un componente de los inhibidores de la lipasa pancreática. Los resultados de la investigación indican que la proteína de la sangre de camello puede servir como fuente de péptidos inhibidores de la lipasa pancreática. Sin embargo, los resultados del cribado virtual presentan ciertas limitaciones y, en el futuro, será necesario optimizar la solubilidad en agua y la estabilidad digestiva de los segmentos peptídicos. Tras la síntesis artificial, deberá verificarse el efecto antihiperlipidémico mediante experimentos in vitro e in vivo.
