Estudio basado en acoplamiento molecular sobre el efecto inhibidor de la acacetina J8 en dianas de proliferación de células endoteliales y vías de señalización celular relacionadas con la apoptosis.
La corteza de acacia es la corteza desecada de la leguminosa Albizia julibrissin Durazz. Tiene un sabor dulce y suave, y en la farmacopea se le atribuyen los efectos de aliviar la depresión, calmar la mente, favorecer la circulación sanguínea y reducir la hinchazón. Se utiliza principalmente para tratar síntomas como la inquietud, la depresión, el insomnio, los abscesos pulmonares, las llagas y el dolor causado por las caídas. Estudios farmacológicos modernos han demostrado que los extractos crudos y las saponinas totales de la corteza de Acacia tienen la actividad de inhibir la proliferación de células tumorales in vivo e in vitro. Médicos famosos como Zhu Liangchun han logrado buenos resultados clínicos en el tratamiento del cáncer de pulmón con medicamentos como la corteza de acacia. Bajo la dirección de la actividad antiangiogénesis tumoral, el trabajo preliminar de este proyecto aisló y purificó componentes eficaces e ingredientes activos que inhiben la angiogénesis tumoral a partir de la corteza de acacia, e identificó su ingrediente activo como juliósido J8 (J8). Los resultados de la investigación mostraron que el J8 tiene una actividad inhibidora significativa sobre la proliferación de células endoteliales. Además, puede provocar la apoptosis celular. Sin embargo, todavía no está claro cómo regula la transducción de señales desde el exterior de la célula y a través de la membrana celular, el citoplasma hasta el núcleo para ejercer sus efectos, y no hay informes de investigación en el país y en el extranjero. En este estudio se utilizó el acoplamiento molecular combinado con experimentos celulares in vitro para analizar las dianas del efecto inhibidor de J8 sobre la proliferación de células endoteliales y sus vías de señalización celular relacionadas con la apoptosis.
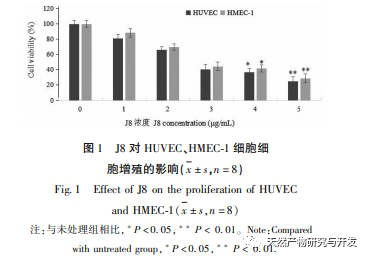
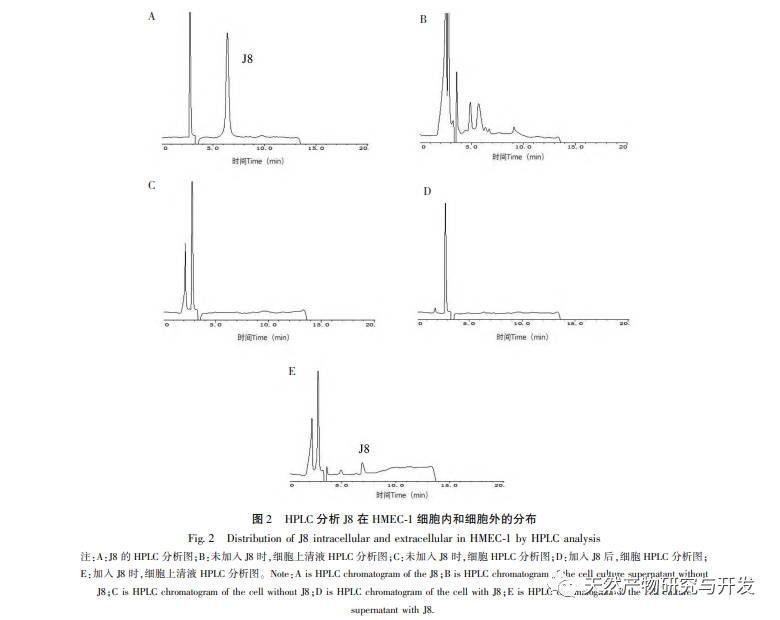
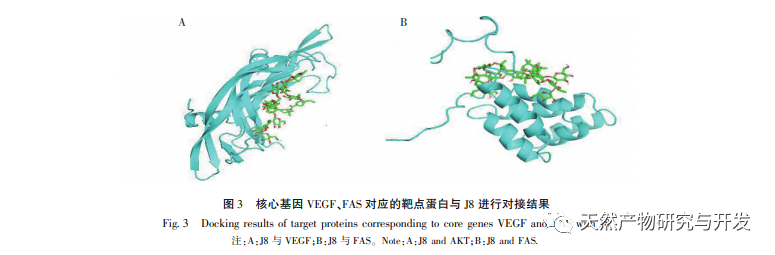
 J8 es una saponina aislada de la corteza de Acacia. Estudios anteriores han sugerido que tiene efectos inhibidores sobre la angiogénesis tumoral tanto in vitro como in vivo, y que puede inducir la apoptosis de las células endoteliales. Sin embargo, la vía a través de la cual induce la apoptosis celular no está muy clara. Para investigar el mecanismo de la apoptosis de células endoteliales inducida por J8, se preparó un nuevo lote de muestras utilizando los métodos de extracción, aislamiento e identificación descritos en la bibliografía, y se detectó su actividad. Para investigar el mecanismo de acción de J8 en las células, si J8 entra en el interior de las células o interactúa con proteínas de superficie en la membrana celular, se utilizó HPLC para detectar la concentración de J8 dentro y fuera de la célula. Los resultados mostraron que el J8 no entraba en el interior de las células endoteliales y sólo interactuaba con las proteínas superficiales de la membrana celular. Con el fin de investigar más a fondo su interacción con ciertas proteínas, el experimento utilizó primero acoplamiento molecular para acoplar las proteínas de membrana FAS, FAS y FAS, que están asociadas con la apoptosis DR3、DR4、DR5、TFR-1, Y se encontró que J8 sólo se une bien a FAS y VEGF, que son proteínas relacionadas con la proliferación celular.
J8 es una saponina aislada de la corteza de Acacia. Estudios anteriores han sugerido que tiene efectos inhibidores sobre la angiogénesis tumoral tanto in vitro como in vivo, y que puede inducir la apoptosis de las células endoteliales. Sin embargo, la vía a través de la cual induce la apoptosis celular no está muy clara. Para investigar el mecanismo de la apoptosis de células endoteliales inducida por J8, se preparó un nuevo lote de muestras utilizando los métodos de extracción, aislamiento e identificación descritos en la bibliografía, y se detectó su actividad. Para investigar el mecanismo de acción de J8 en las células, si J8 entra en el interior de las células o interactúa con proteínas de superficie en la membrana celular, se utilizó HPLC para detectar la concentración de J8 dentro y fuera de la célula. Los resultados mostraron que el J8 no entraba en el interior de las células endoteliales y sólo interactuaba con las proteínas superficiales de la membrana celular. Con el fin de investigar más a fondo su interacción con ciertas proteínas, el experimento utilizó primero acoplamiento molecular para acoplar las proteínas de membrana FAS, FAS y FAS, que están asociadas con la apoptosis DR3、DR4、DR5、TFR-1, Y se encontró que J8 sólo se une bien a FAS y VEGF, que son proteínas relacionadas con la proliferación celular.
El factor de crecimiento endotelial vascular VEGF es un factor de crecimiento proendotelial altamente específico que puede promover la proliferación de células endoteliales, la migración, el aumento de la permeabilidad vascular y la angiogénesis. La inhibición de la actividad del VEGF puede inhibir significativamente la formación de vasos sanguíneos tumorales, alcanzando así el objetivo terapéutico del tratamiento antitumoral. La literatura informa de que las saponinas totales de la corteza de Acacia pueden inhibir significativamente la formación de vasos sanguíneos tumorales y suprimir la actividad del VEGF. J8 es una de las saponinas, y el acoplamiento molecular y la detección molecular in vitro han demostrado que J8 puede unirse a VEGF, inhibiendo así la proliferación de células endoteliales.
La investigación moderna en farmacología molecular y celular sugiere que la transducción de señales de la apoptosis celular puede dividirse en dos vías: exógena y endógena (mitocondrial). La vía apoptótica exógena está mediada por receptores de apoptosis como TNF-a, TRAIL, FAS-L. Fas-L se une a FAS reclutando y conectando a FADD para iniciar la apoptosis celular. Las mitocondrias son el centro regulador de la apoptosis celular endógena, que puede dividirse en vías de señalización apoptótica dependientes y no dependientes de Caspasa en función de las diferentes vías de señalización. La unión de FADD a la Caspasa-8 puede conducir a la dimerización de la Caspasa-8, es decir, a su activación. La Caspasa-8 activada reactiva la Caspasa-3/9, induciendo la apoptosis celular. La vía de señalización apoptótica no dependiente de Caspasa se consigue principalmente a través de la liberación de AIF y EnDOG, que pueden inducir grandes cantidades de fragmentación del ADN e inducir la apoptosis celular. A través de la verificación experimental, se encontró que después de añadir J8 (2,5 μ g / ml) a las células HUVEC, la expresión de VEGF, JNK y otras proteínas fue significativamente regulada a la baja, mientras que la expresión de proteínas relacionadas con la apoptosis p-JNK, Bax y EnDOG fue significativamente regulada al alza. J8 no tuvo un efecto significativo en los niveles de expresión de Caspasa-3, Caspasa-8 y Caspasa-9, y podría promover la fosforilación de JNK, una proteína quinasa activada por estrés. La vía JNK activada puede regular la expresión de genes diana relacionados con la apoptosis, induciendo así la apoptosis celular. Bax y EnDOG son genes diana de la vía JNK. Tras ser tratados con J8, sus niveles de expresión también aumentan, lo que sugiere que J8 puede causar la muerte celular debilitando la actividad de la vía VEGF/JNK. Los resultados de este estudio sugieren que J8 puede promover la apoptosis de las células endoteliales vasculares mediante la regulación de la vía de señalización JNK, proporcionando ideas para futuras investigaciones de otros estudiosos y ofreciendo nuevos fármacos de investigación para la terapia de inhibición de la angiogénesis tumoral. Sin embargo, este estudio también tiene ciertas deficiencias, y la detección completa de proteínas aguas arriba y aguas abajo de la vía de señalización JNK es necesaria en futuras investigaciones. Los experimentos con células in vitro pueden presentar ciertas desviaciones, y los resultados experimentales deben validarse en experimentos clínicos y con animales.
En resumen, J8 puede inhibir la proliferación celular actuando sobre VEGF, mientras que la regulación de la vía de señalización JNK promueve la apoptosis de las células endoteliales vasculares, y la tasa de apoptosis aumenta significativamente con el incremento de la concentración.
