Estudio del efecto de mejora de la saponina VI de Chuanxuduan sobre la neurogénesis y la función cognitiva en ratones privados de sueño
La privación del sueño (DS) se refiere a un estado de pérdida parcial o completa del sueño normal causado por diversas razones, que está ampliamente presente en la sociedad actual. La privación de sueño a largo plazo puede provocar trastornos funcionales en el organismo, causando disfunción neurocognitiva. Las investigaciones han confirmado que la privación de sueño activa la microglía en el sistema nervioso central y la induce a liberar moléculas neurotóxicas. La microglía activada afecta a la función cognitiva a través de mecanismos como la neurogénesis hipocampal y la plasticidad sináptica. La falta de sueño afecta gravemente a la salud física y mental de las personas y es un problema social de salud pública que no puede ignorarse. El desarrollo de fármacos de intervención eficaces tiene un gran potencial.
La Asprosaponina VI (ASA VI) es una saponina triterpenoide aislada de la medicina tradicional china Dipsaci Radix, que tiene buenos efectos antiosteoporosis, antiinflamatorios y neuroprotectores. En estudios anteriores se descubrió que el ASAVI puede penetrar eficazmente la barrera hematoencefálica, regular la función de la microglía, promover la proliferación y diferenciación de las células madre neurales y mostrar una buena actividad farmacológica en estudios contra la depresión y la demencia. Este estudio investigó el efecto de mejora del ASA VI sobre la función cognitiva en ratones privados de sueño y exploró más a fondo su mecanismo de acción, proporcionando una base para el desarrollo de fármacos de intervención relacionados.
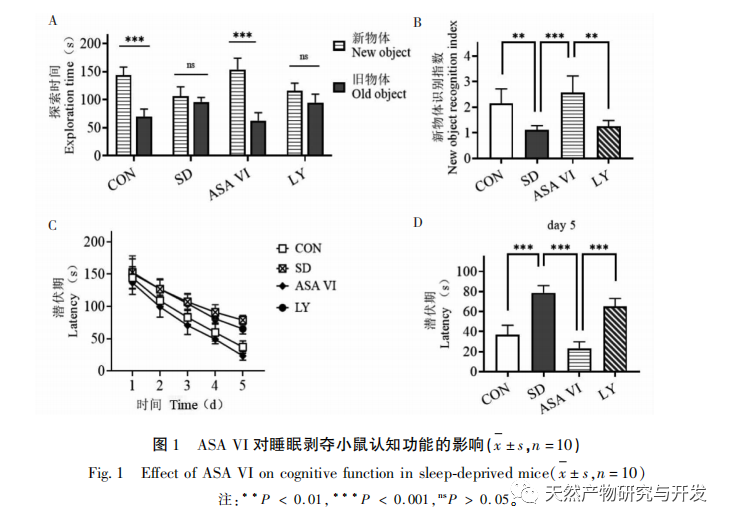
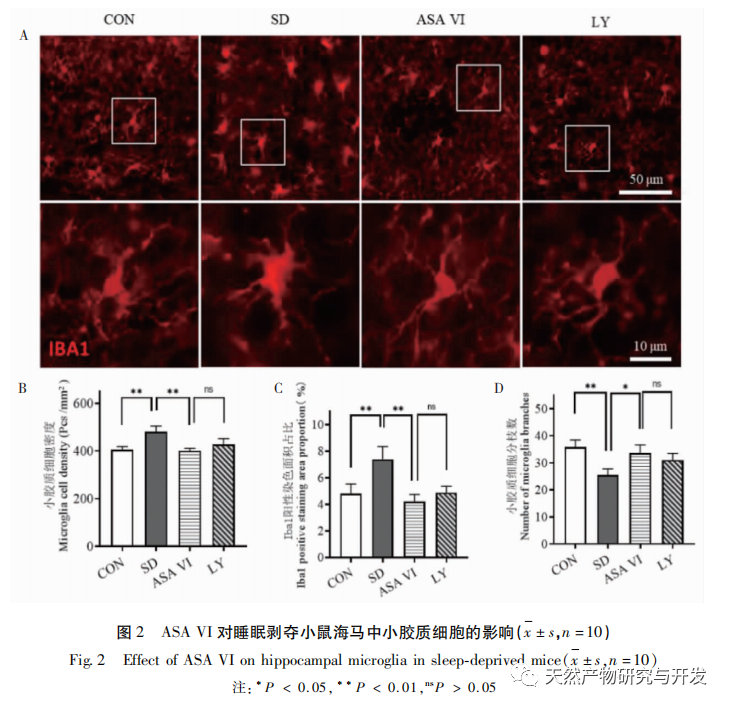
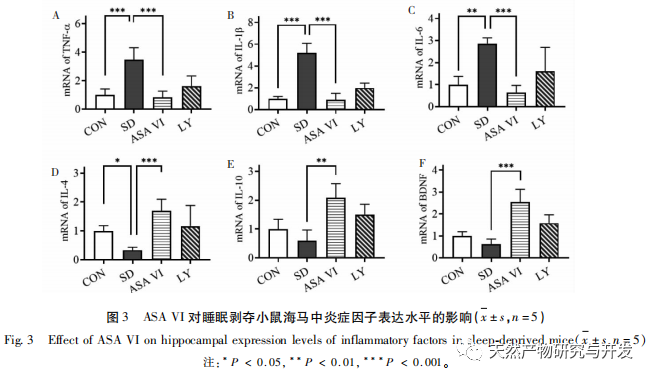
La privación de sueño puede tener efectos amplios y profundos en el comportamiento cognitivo, y está estrechamente asociada a la aparición de diversas enfermedades. Este estudio descubrió que la privación de sueño afecta significativamente a la memoria a corto plazo y a las capacidades de aprendizaje y memoria espacial de los ratones, aumenta el número de microglía, incrementa el nivel de expresión de factores inflamatorios e inhibe la neurogénesis del hipocampo adulto. La intervención del ingrediente activo natural ASA VI mejoró significativamente la función cognitiva de los ratones privados de sueño, al tiempo que inhibió la expresión de las citocinas proinflamatorias IL-1 β, TNF - α, e IL-6 en el hipocampo, aumentó los niveles de expresión de las citocinas antiinflamatorias IL-4, IL-10, y del factor neurotrófico BDNF, y promovió la neurogénesis en el hipocampo. Esto indica que el AAS VI, como fármaco antiinflamatorio y neuroprotector, tiene el efecto de mejorar el aprendizaje y la memoria en ratones privados de sueño.
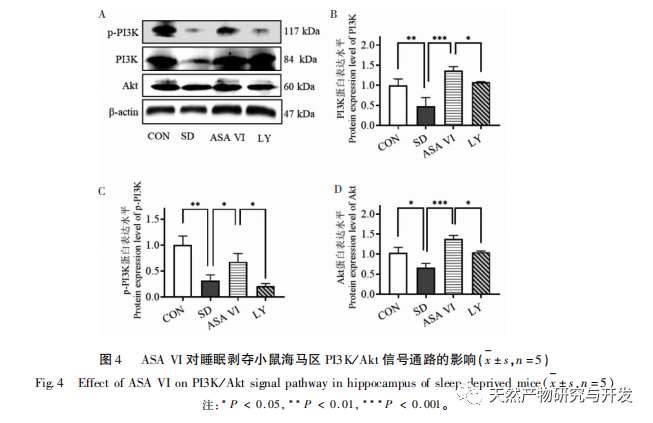
La microglía es un tipo de célula inmunitaria muy heterogénea que no se origina en el sistema nervioso central. Desempeñan un papel importante en la vigilancia inmunitaria y el mantenimiento de la homeostasis en el medio interno. Cuando son estimuladas, las microglías acortan sus ramas, expanden sus cuerpos celulares y entran en un estado de defensa inmunitaria, liberando una gran cantidad de citoquinas proinflamatorias. Este estudio encontró que la privación del sueño puede inducir la activación excesiva de la microglía en el hipocampo, aumentando así la sobreexpresión de citoquinas pro-inflamatorias IL-1 β, TNF - α, y la IL-6. Como la privación del sueño continúa, estos factores inflamatorios pueden conducir a la neuroinflamación crónica y causar daño crónico a las neuronas, astrocitos, oligodendrocitos, y otras células cerebrales, en última instancia conduce a la disfunción cognitiva en ratones. La intervención de ASA VI puede mejorar el aumento del número y la superficie de la microglía en el hipocampo de ratones causado por la privación de sueño, y aumentar el número de ramificaciones. Al tiempo que reduce la secreción de moléculas proinflamatorias, también aumenta la expresión de moléculas antiinflamatorias y factores neurotróficos. Estos resultados sugieren que el posible mecanismo por el que el AAS VI mejora la función cognitiva en ratones privados de sueño es transformando el fenotipo proinflamatorio de la microglía en un fenotipo neuroprotector. Este fenotipo neuroprotector de la microglía no sólo segrega citocinas antiinflamatorias para suprimir la neuroinflamación, sino que también segrega factores neurotróficos para reparar los tejidos dañados y ejercer funciones neuroprotectoras. Los resultados de este estudio revelaron que, en comparación con el grupo de intervención con ASA VI, el tratamiento con el inhibidor LY294002 no afectó significativamente a la morfología y cantidad de microglía, ni a la expresión de factores inflamatorios y factores neurotróficos, lo que indica que, en el hipocampo de ratones privados de sueño, el ASA VI regula el fenotipo microglial independientemente de la vía de señalización PI3K/Akt. Aunque no hubo diferencias significativas en la expresión de los factores inflamatorios del hipocampo entre el grupo LY294002 y el grupo ASA VI, el tratamiento con LY294002 redujo en cierta medida los niveles de expresión de las citocinas antiinflamatorias IL-4, IL-10 y el factor neurotrófico BDNF, mientras que aumentó en cierta medida los niveles de expresión de las citocinas proinflamatorias IL-1 β, TNF - α e IL-6. Lin Jianan et al. informaron de que el ginsenósido CK inhibe la inflamación mediada por la microglía a través de la vía de señalización PI3K/AKT. Estos resultados sugieren que la vía de señalización PI3K/Akt puede estar implicada en la regulación de la neuroinflamación mediada por la microglía, y su papel en la inflamación del hipocampo mediada por ASA VI en ratones privados de sueño requiere más investigación.
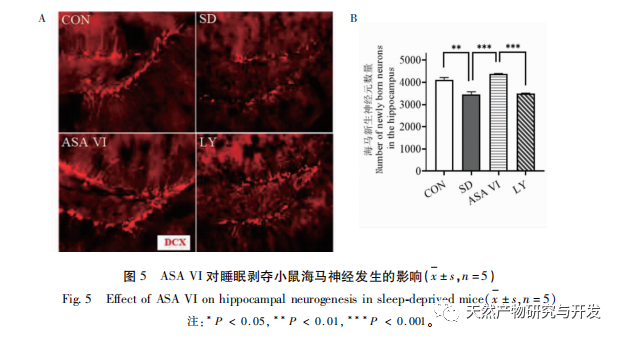
La neurogénesis del hipocampo adulto desempeña un papel importante en la plasticidad cerebral y el mantenimiento de la red neuronal, y sus trastornos funcionales pueden provocar diversas enfermedades humanas, como depresión, ansiedad, deterioro cognitivo y enfermedades neurodegenerativas. Cuando se produce una inflamación en el cerebro, las principales células neuroinmunes del cerebro -la microglía- se sobreactivan, liberando mediadores inflamatorios y moléculas neurotóxicas que inhiben significativamente los niveles de neurogénesis en el hipocampo adulto, lo que conduce a un mayor riesgo de trastornos emocionales y disfunción cognitiva. Las neuronas recién formadas en el hipocampo de los roedores proceden principalmente de la zona subgranular (SGZ) del giro dentado, que desempeña un papel importante en la formación y consolidación de la memoria. Las investigaciones han demostrado que las moléculas neuroinflamatorias liberadas por la microglía pueden afectar a la neurogénesis en el hipocampo adulto mediante la inhibición de la vía de señalización PI3K/Akt. Este estudio descubrió que la vía de señalización PI3K/Akt y el número de neuronas nuevas en el hipocampo de ratones privados de sueño estaban significativamente inhibidos. La intervención de ASA VI activó la vía de señalización PI3K/Akt en el hipocampo de ratones privados de sueño y promovió la neurogénesis en el hipocampo adulto. Tras bloquear la vía de señalización PI3K/Akt con LY294002, el número de neuronas de nueva generación en el hipocampo disminuyó significativamente, y el efecto de mejora del ASA VI sobre la función cognitiva en ratones privados de sueño fue abolido por el LY294002. Liu et al. informaron de que el ASA VI puede promover la proliferación y la supervivencia de las células madre neurales mediante la activación de la vía PI3K/AKT, y promover su diferenciación en neuronas, protegiendo a las células madre neurales de los efectos de la neuroinflamación, mejorando así la neurogénesis hipocampal, el comportamiento similar a la depresión, el comportamiento similar a la ansiedad y la disfunción cognitiva en ratones modelo de neuroinflamación crónica. Estos resultados indican que el efecto de mejora del ASA VI sobre la función cognitiva en ratones privados de sueño depende de la vía neurogénica mediada por la señalización PI3K/Akt.
En resumen, este estudio descubrió que el ASA VI promueve la neurogénesis en el hipocampo adulto mediante la regulación del fenotipo de la microglía en el hipocampo, el aumento de la expresión de BDNF y la activación de la vía de señalización PI3K/Akt, mejorando así la función cognitiva en ratones privados de sueño. El ASA VI tiene perspectivas potenciales de desarrollo como fármaco antiinflamatorio y neuroprotector.
