Exploración del mecanismo de acción de la emodina en el tratamiento de la lesión renal aguda relacionada con la sepsis a partir de la minería de datos y la verificación experimental
La sepsis es una disfunción orgánica potencialmente mortal causada por un desequilibrio en la respuesta del huésped a la infección. Los riñones son uno de los órganos más comúnmente afectados en la sepsis, y la lesión renal aguda asociada a sepsis (LRA-AS) se convierte a menudo en la causa directa de muerte en pacientes con sepsis, con una elevada tasa de mortalidad, lo que plantea retos sin precedentes para los médicos clínicos. La LRA persiste y aumenta el riesgo potencial de enfermedad renal crónica (ERC). Los pacientes que sobreviven a menudo evolucionan inevitablemente hacia una enfermedad renal terminal (ERT), lo que supone una grave amenaza para su calidad de vida y su seguridad.
Por desgracia, la capacidad actual para prevenir y tratar la SA-AKI es muy limitada. Es posible que la terapia basada en líquidos activos no cuente con pruebas médicas fiables, e incluso puede ser perjudicial. El uso de fármacos vasoactivos para mantener la presión arterial requiere un equilibrio entre la gran circulación y la microcirculación, y no hay consenso sobre cuánto debe mantenerse el objetivo de presión arterial para ayudar a prevenir la aparición de IRA. Si fracasa la prevención renal, debe utilizarse la terapia renal sustitutiva (TRS) para el tratamiento, pero el momento y el método óptimos de intervención de la TRS no están claros. Si los pacientes con IRA-SA sobreviven, aunque la función renal de la mayoría de ellos se recuperará, se sabe poco sobre los mecanismos de reparación renal o el fracaso de la reparación de la función renal, y el riesgo de por vida de progresión a ERC y ERT es mayor. Hasta el momento, no existe ningún fármaco definitivo y fiable para tratar la LRA. Las medidas de tratamiento clínico convencionales son principalmente la sustitución renal y el tratamiento integral sintomático. La reparación de la función renal depende del apoyo fiable del propio riñón en el conjunto del organismo. Por lo tanto, la exploración de fármacos o medidas que puedan prevenir o tratar eficazmente la LRA-AS de forma precoz y oportuna, evitar la aparición de enfermedad renal crónica o promover la reparación renal, tiene un importante valor clínico para reducir la tasa de mortalidad de los pacientes con sepsis y mejorar la calidad de vida de los pacientes supervivientes.
La emodina es un compuesto natural extraído de hierbas chinas como el ruibarbo y el Polygonum cuspidatum, que tiene diversos efectos farmacológicos como antiinflamatorio, antiviral y antitumoral. Estudios anteriores han confirmado que la emodina tiene un efecto protector en pacientes con sepsis; Estudios recientes han demostrado que la emodina tiene un efecto protector contra el daño causado por el estrés oxidativo, la inflamación y la apoptosis celular. Sin embargo, aún no está claro si la emodina puede mejorar el pronóstico de los pacientes con SA-AKI. Este estudio explorará los genes clave implicados en la patogénesis de la SA-AKI a través de bases de datos relacionadas con las ciencias de la vida, y analizará las vías de señalización inflamatoria implicadas en estos genes clave; además, se realizaron experimentos con animales para investigar si la emodina afecta a la vía inflamatoria de la SA-AKI y su efecto y mecanismo protectores en ratas con SA-AKI, proporcionando nuevas ideas para su prevención y tratamiento.
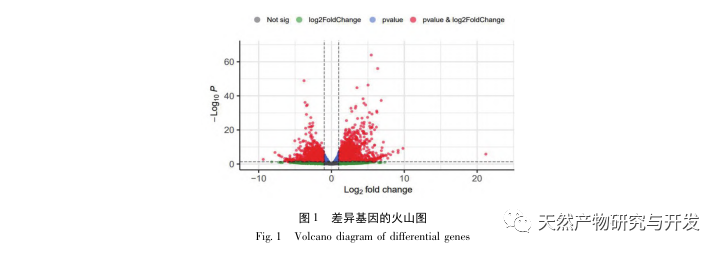
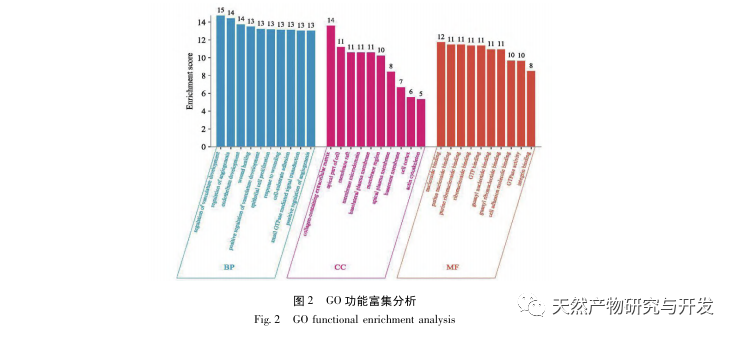
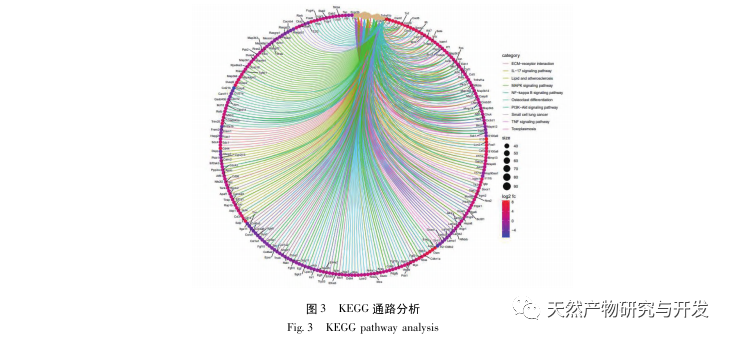



La investigación ha demostrado que la patogénesis de la SA-AKI es multifactorial y compleja, e implica la interacción entre inflamación, disfunción microcirculatoria y reprogramación metabólica. Su fisiopatología implica el daño y la disfunción de múltiples tipos de células. En el proceso de sepsis, las bacterias liberan endotoxinas o sustancias similares a las endotoxinas, que activan células inflamatorias como neutrófilos, monocitos y células endoteliales del organismo, liberando una gran cantidad de mediadores inflamatorios endógenos en el torrente sanguíneo. Por un lado, esto provoca daños en múltiples órganos, incluidos los riñones, y por otro, activa más células inflamatorias para que participen en la enfermedad, formando una respuesta de red inmunitaria maligna. En el modelo de rata SD de SA-AKI inducida por lipopolisacáridos (LPS), el nerolidol alivia la SA-AKI mediante la inhibición de las vías de señalización NF - κ B y Toll like receptor 4 (TLR4). Se ha confirmado que la vía TLR4/NF - κ B interviene en el proceso de respuesta inflamatoria renal, y que la inhibición de la respuesta inflamatoria mediada por TLR4/NF - κ B tiene un efecto protector sobre la LKI inducida por LPS. Se puede observar que la respuesta inflamatoria es un mecanismo importante en la patogénesis de la LRA-AS, y la inhibición de la vía de respuesta inflamatoria es una opción de tratamiento importante para la sepsis, proporcionando nuevas ideas para el tratamiento clínico de los pacientes con LRA-AS.
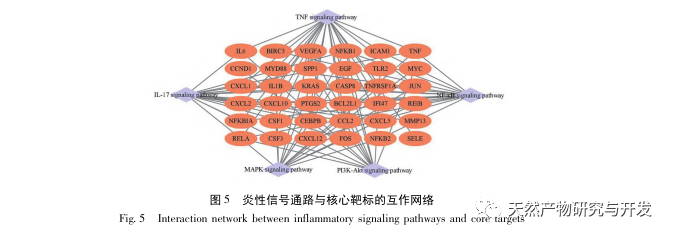
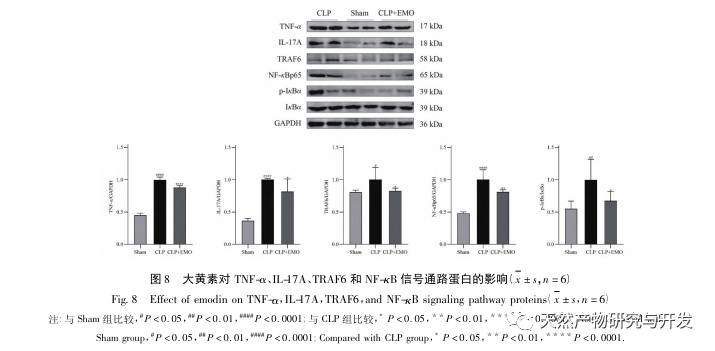
Este estudio utilizó una base de datos biológicos para analizar 2801 dianas clave implicadas en la patogénesis de la SA-AKI. El análisis KEGG de estas dianas reveló un total de 5 vías clave de señalización de la respuesta inflamatoria, entre las cuales la vía de señalización del TNF y la vía de señalización de la IL-17 ocupaban un lugar destacado, y la vía de señalización NF - κ B servía de eje para que ambas vías participaran en la patogénesis de la SA-AKI. En la vía de señalización del TNF, el TNF-α no sólo es el activador ascendente clave de la señalización NF-κ B, sino que también sirve como molécula de respuesta descendente de la vía de señalización NF-κ B, lo que sugiere que promueve la vía de señalización NF-κ B mediante retroalimentación positiva, y que ambas se complementan. En la vía de señalización de la IL-17, la IL-17A es el principal factor iniciador de la familia IL-17, y las células Th17 son sus principales células secretoras. En el modelo inducido por CLP, se descubrió que la IL-17A está altamente expresada en la cavidad abdominal y desempeña un papel clave en la respuesta inflamatoria tras una sepsis grave. La neutralización de la IL-17A en la cavidad abdominal puede reducir la producción de citocinas proinflamatorias. Mientras tanto, los estudios han demostrado que el receptor tipo Toll 9 (TLR9) en las células dendríticas (DC) puede desempeñar un papel clave en el desarrollo de SA-AKI mediando la producción de IL-17A por las células T gamma delta; otros estudios han demostrado que la eliminación de IL-17A puede prevenir SA-AKI. Lo anterior indica que el TNF - α y la IL-17A son factores proinflamatorios en la sepsis, y que la vía de señalización del TNF y la vía de señalización de la IL-17 están ampliamente implicadas en la aparición y el desarrollo de la sepsis, lo que concuerda con los resultados del análisis de datos.
Se han realizado numerosos estudios sobre el tratamiento de la sepsis con emodina, centrados principalmente en los tejidos cerebral, sanguíneo, cardíaco, intestinal y pulmonar. En la encefalopatía asociada a la sepsis (SAE), la emodina puede mejorar el deterioro cognitivo y el daño patológico, e inhibir la inflamación inducida por CLP en ratones mediante la regulación al alza de la señalización BDNF/TrkB. En el sistema sanguíneo, la emodina regula a la baja la P-selectina, mejora el recuento de plaquetas y la capacidad de agregación en la fase tardía de la sepsis, y mejora la actividad del factor de coagulación endógeno y la función del fibrinógeno, ejerciendo efectos antiinflamatorios. En la cardiomiopatía séptica, se ha descubierto que la emodina puede revertir la disfunción cardiaca y mejorar el estado del miocardio en ratas sépticas, lo que puede estar relacionado con su inhibición de la activación del inflamasoma. En la lesión intestinal inducida por sepsis, la emodina puede mejorar el daño de la mucosa intestinal reduciendo los niveles de factores inflamatorios y marcadores de estrés oxidativo, y su mecanismo de acción puede estar relacionado con la vía VDR/Nrf2/HO-1; y al aumentar el nivel de expresión de la proteína de la unión estrecha (TJ), protege la integridad de la barrera intestinal e inhibe la permeabilidad de la barrera intestinal. Además de mejorar la respuesta inflamatoria y la función de barrera del intestino, la emodina también puede prevenir el desplazamiento de Escherichia coli, evitar la propagación y transferencia de bacterias y reducir el daño secundario causado por las bacterias. En la lesión pulmonar aguda relacionada con la sepsis, la emodina puede inhibir las vías NF - κ B y de la caja 1 del grupo de alta movilidad (HMGB1), reduciendo así el estrés oxidativo pulmonar y la respuesta inflamatoria. Otro estudio sobre los pulmones se basa en la vía de la autofagia, y la intervención de la emodina puede prevenir eficazmente la progresión de la lesión pulmonar aguda. Además, otros estudios han demostrado que la emodina puede aliviar eficazmente el edema tisular pulmonar en la lesión pulmonar aguda inducida por sepsis mediante la regulación de la acuaporina (AQP), la TJ, los factores inflamatorios y la apoptosis de las células pulmonares. Aún no se ha informado del estudio de la emodina en SA-AKI. A través de este estudio, se encontró que las ratas modelo CLP tratadas con emodina mostraron una disminución de la expresión de TNF - α, IL-17, y IFN - γ en los resultados de ELISA, que es consistente con el efecto inhibidor de la emodina en la inflamación de la sepsis.
También se ha dilucidado el mismo efecto de la emodina sobre el eje inflamatorio Th17/Treg. En el estudio de la pancreatitis aguda, se encontró que la emodina inhibe la respuesta inmune en la pancreatitis aguda grave mediante la regulación de la relación de IFN - γ/IL-17, aliviando así la disfunción de la barrera intestinal. Y este estudio encontró que en SA-AKI, emodina también puede reducir la expresión de IL-17A y mejorar su respuesta inflamatoria.
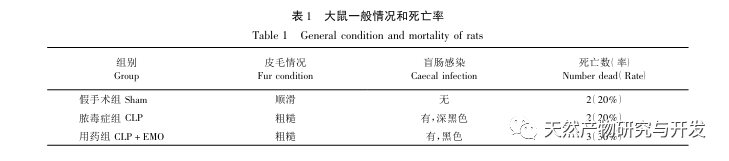
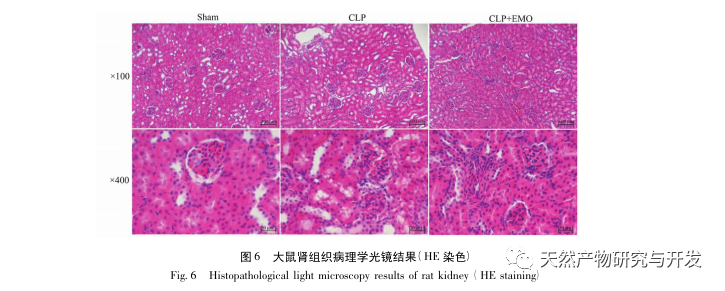
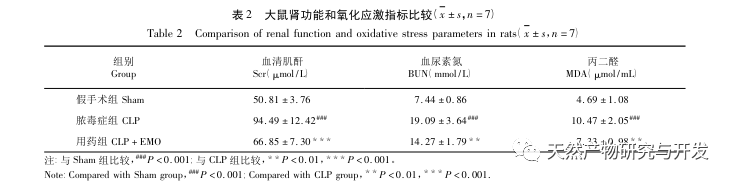
En resumen, este estudio identificó 2801 genes clave implicados en la patogénesis de la emodina a través de la minería de datos. El análisis de procesos biológicos GO sugiere que las funciones biológicas de estos objetivos implican principalmente la transducción de señales de membrana, la regulación vascular y la cicatrización de heridas. El análisis de enriquecimiento de vías KEGG mostró que las vías de señalización TNF, IL-17, PI3K Akt, NF - κ B y MAPK estaban enriquecidas en vías de señalización relacionadas con la inflamación. La verificación experimental mostró que el tratamiento con emodina mejoró la función renal en SA-AKI, y los niveles de estrés oxidativo (MDA) y citoquinas inflamatorias (TNF - α, IL-17, y IFN - γ) disminuyeron. La expresión proteica de IL-17A, TNF - α, TRAF6, NF - κ Bp65, y el nivel de fosforilación de I κ B α se redujeron significativamente en comparación con el grupo CLP, que es coherente con los resultados del análisis de datos. Se sugiere que la emodina puede mejorar SA-AKI en ratas, que puede estar relacionado con la IL-17/NF - κ B y TNF/NF - κ B vías de señalización.
