Los extractos de plantas se utilizan ampliamente en productos farmacéuticos, alimentos, cosméticos, aditivos, productos sanitarios y otros campos, por lo que las empresas de transformación necesitan gestionar la correspondiente cualificación de licencia según su uso o la gestión de la industria o las normativas nacionales, etc., que se dividen a grandes rasgos en las siguientes categorías:
1, como materias primas para medicamentos deben archivarse;
2, procesados como alimentos necesitan solicitar licencia de producción de alimentos (SC), categorías de alimentos: bebidas sólidas, alimentos saludables, aditivos alimentarios;
3, utilizados como aditivos para piensos, deben solicitar una licencia de producción de aditivos para piensos;
4, las ventas de exportación de productos, las empresas de producción de exportación deben ser archivados.
En segundo lugar, existen más de 30 certificaciones voluntarias en la industria de extractos vegetales, entre las que se incluyen la certificación de sistemas (ISO), la certificación de productos (Kosher, HALAL, etc.), la certificación de especificaciones de producción (GMP), la certificación ecológica (China Organic Certification) y la certificación de laboratorios (CNAS, CMA).
A continuación se describen las licencias necesarias para los extractos de plantas utilizados en productos farmacéuticos, alimentarios, cosméticos, sanitarios y otros ámbitos.
Como extractos de la medicina china
El organismo principal de la presentación de extractos de medicina china es el fabricante de extractos, que debe obtener la Licencia de Fabricación de Medicamentos que contiene el alcance de la producción de extractos de medicina china, cumplir con los requisitos de GMP y proporcionar los productos de extractos al fabricante de pCm.
La información de presentación del fabricante del extracto de medicina china deberá incluir:
1. Información básica de la empresa e información técnica del extracto;
2, "Licencia de producción de medicamentos", "Licencia comercial" y otros documentos acreditativos;
3, producción de extractos con hierbas medicinales chinas, información sobre comprimidos de medicina china, incluido el origen, la base, la fuente, la aplicación de
Normas, especificaciones de los brebajes e informes de auditoría sobre las cualificaciones de los proveedores y el sistema de garantía de calidad de la producción;
4、Proceso de producción detallado de los extractos, incluida la hoja de ruta del proceso, los parámetros clave, los principales equipos, etc;
5, normas de calidad de control interno de extractos o normas farmacéuticas nacionales de extractos.
El 29 de julio de 2014, la Oficina Estatal emitió la Administración de Alimentos y Medicamentos de Supervisión Farmacéutica y Química [2014] N º 135 "Aviso de la Administración de Alimentos y Medicamentos sobre el fortalecimiento de la supervisión y gestión de extractos y extractos en la producción de medicamentos tradicionales chinos", que requiere que "los extractos de la medicina china que figuran en la prescripción de la norma nacional de medicamentos para pCms y con una norma nacional de medicamentos por separado deben ser implementadas para la gestión de registros. "Registrar el éxito de las empresas de extractos de plantas deben estar de acuerdo con los requisitos de GMP para organizar la producción, para garantizar la calidad de sus productos, y su supervisión diaria por la ubicación de la provincial (regiones autónomas y municipios) de Alimentos y Medicamentos es responsable.
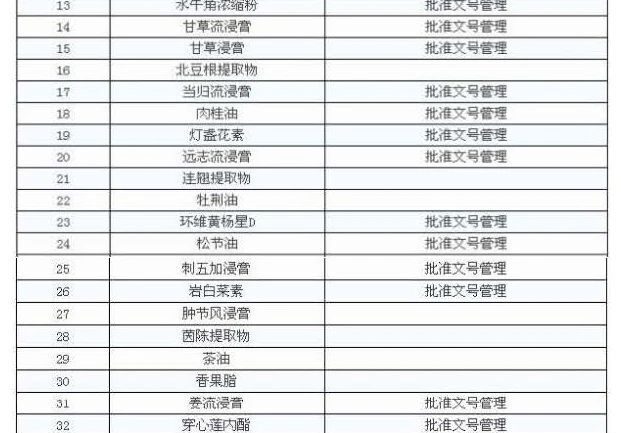
De acuerdo con los requisitos de la notificación hay 47 extractos de la medicina china puede ser presentada para la gestión, es decir, la empresa puede producir su propia, también puede ser comprado, el otro debe ser extraído por la propia empresa.
Como materia prima para la preparación de instituciones médicas
Las instituciones médicas para preparar los preparados deben ser una "licencia de práctica de la institución médica", y de acuerdo con la "norma de gestión de calidad de la preparación de la institución médica" para obtener la "licencia de preparación de la institución médica", pueden configurar sus propios preparados.
Las Medidas Administrativas para el Registro de Preparados para Instituciones Médicas (para la Realización de Ensayos) estipulan que las instituciones médicas que soliciten preparados deben llevar a cabo los estudios preclínicos correspondientes, incluyendo la selección de recetas, el proceso de preparación, los indicadores de calidad, la farmacología, los estudios toxicológicos, etc. Las medicinas herbales chinas utilizadas en la solicitud de preparaciones deben tener una licencia para ejercer en instituciones médicas. Las hierbas medicinales chinas y las tabletas de medicina tradicional china utilizadas en la solicitud de preparación deben tener números de aprobación de medicamentos y cumplir con las normas legales de medicamentos. El método también especifica una de las siguientes circunstancias no se declarará como una preparación para las instituciones médicas:
1, el mercado se ha abastecido de variedades;
2、Variedades que contienen ingredientes activos no aprobados por la Administración Estatal de Alimentos y Medicamentos;
3, además de los alérgenos, además de los productos biológicos;
4, inyección de medicina china;
5, Medicina china, composición química del preparado compuesto;
6, estupefacientes, drogas psicotrópicas, drogas tóxicas para uso médico, drogas radiactivas.
El Anuncio sobre la Implementación de la Gestión de Registros sobre la Aplicación de Técnicas Tradicionales para la Preparación de Preparados Medicinales Chinos por Instituciones Médicas estipula que los preparados medicinales chinos tradicionales incluyen:
1, formas de dosificación tradicionales sólidas (píldoras, dispersiones, dans, lingotes, etc.), semisólidas (pomada, pasta, etc.) y líquidas (tónicos, etc.) elaboradas a partir de hierbas medicinales chinas mediante pulverización o sólo mediante extracción de agua o aceite;
2, gránulos de hierbas medicinales chinas extraídos con agua y cápsulas de hierbas medicinales chinas trituradas;
3, licores y tinturas a base de hierbas medicinales chinas extraídas por métodos tradicionales.
Los preparados de medicina tradicional china presentados por la institución médica deberán ser coherentes con el ámbito de diagnóstico y tratamiento establecido en su "licencia para ejercer en una institución médica". No se presentará ninguna de las siguientes circunstancias:
1, "Preparativos para las medidas de gestión del registro de instituciones médicas (para la aplicación de prueba)" en las disposiciones de las circunstancias no se declarará como una institución médica preparativos;
2, y el mercado se ha abastecido de variedades de formas farmacéuticas diferentes de la misma receta;
3, partículas de fórmula de medicina china;
En resumen, las materias primas para los preparados de las instituciones médicas deben ser medicamentos chinos a base de plantas o comprimidos de medicina china, no extractos de medicina china, y las instituciones médicas sólo pueden adquirir preparados caseros que hayan sido aprobados para el registro de materias primas.
Como materia prima para alimentos saludables
Las Medidas para la Administración del Registro y Presentación de Alimentos para la Salud promulgadas en 2015 estipulan claramente que la CFDA prohíbe el procesamiento por encargo de extractos de medicina china, y la presentación de extractos de plantas se ha convertido en una nueva tendencia en el desarrollo de la industria.
A finales de 2016, la CFDA publicó las Normas de revisión para la licencia de producción de alimentos saludables, que estandarizaron aún más las normas específicas para la inclusión de extractos de plantas en la producción de alimentos saludables. Los solicitantes que proporcionan extractos de plantas y animales para otras empresas como materias primas para la producción de alimentos para la salud deben solicitar licencias de producción de extractos de materias primas de acuerdo con los requisitos de estas normas; los que sólo se dedican a la extracción de materias primas para alimentos para la salud producidos por la empresa solicitan licencias de producción de productos alimenticios para la salud, y no necesitan solicitar licencias de producción de extractos de materias primas por separado. Indica que, si la empresa produce sus propios alimentos para la salud, puede extraer plantas y animales por sí misma. Licencia de producción de extracto de materia prima de alimentos para la salud, se debe marcar en los detalles de las especies del nombre del proyecto del extracto de materia prima, y en la columna de Observaciones contiene el nombre del alimento para la salud, número de registro o número de registro y otra información.
Los solicitantes que soliciten la licencia de producción de extracto de materia prima de alimentos para la salud, se deben presentar a los documentos de registro de alimentos para la salud o certificado de presentación, así como los documentos de registro o certificados de presentación establecidos en el extracto de materia prima del proceso de producción, normas de calidad.
Catálogo de ingredientes de alimentos para la salud, se refiere a la seguridad y la evaluación funcional, se puede utilizar para las sustancias de alimentos para la salud y su correspondiente lista de información pertinente. Cualquier unidad o individuo puede, sobre la base de la investigación pertinente, proponer al Centro de Evaluación de Alimentos Saludables de la Administración Estatal de Alimentos y Medicamentos las materias primas que se incluirán en el catálogo de ingredientes de alimentos saludables.
Las materias primas solicitadas para su inclusión en el catálogo de ingredientes alimentarios saludables deben cumplir los siguientes requisitos:
1, con un amplio historial alimentario nacional y extranjero y suficientes pruebas científicas;
2, con un rango de dosificación claro y las funciones sanitarias correspondientes de acuerdo con los requisitos del catálogo de funciones sanitarias;
3, con calidad y requisitos técnicos estables y controlables;
4、Tiene una base científica que cumple los requisitos de seguridad y eficacia;
5, con eficacia científicamente aplicable, estable y fiable de los ingredientes o ingredientes de firma, gama de contenidos y métodos de ensayo;
6, de acuerdo con la dosis prescrita y el método de consumo, seguro e inocuo para la población aplicable.

Como ingrediente alimentario
Según la Ley de Seguridad Alimentaria, "por alimento se entiende todo tipo de productos acabados y materias primas para el consumo humano o la bebida, así como los artículos que son a la vez alimento y medicina según la tradición, pero no incluye los artículos con fines terapéuticos." No cabe duda de que los extractos vegetales destinados a la alimentación son alimentos y deben autorizarse de acuerdo con los requisitos de la Ley de Seguridad Alimentaria. Los extractos de plantas utilizados para la elaboración de alimentos deben extraerse de materias primas seleccionadas del catálogo de alimentos medicinales y alimenticios o de nuevos recursos alimenticios.
Las sustancias que son a la vez alimento y medicamento se refieren a las partes utilizables de animales y plantas que tienen hábitos alimenticios tradicionales y que figuran en la norma nacional de medicamentos chinos a base de plantas. Las sustancias incluidas en el catálogo de materias primas tanto para alimentos como para medicamentos deben cumplir los siguientes requisitos al mismo tiempo:
1. En cumplimiento de la Ley de Seguridad Alimentaria y la normativa pertinente;
2, en el canon de la medicina china hay registros comestibles, no se han encontrado registros de toxicidad;
3, con los hábitos de consumo tradicionales, no se ha observado que el consumo normal cause ningún efecto agudo o subagudo para la salud humana,
crónicas u otros daños potenciales para la salud humana, en consonancia con los requisitos nutricionales deben tener;
4, en consonancia con las leyes y reglamentos pertinentes para la protección de los recursos fitofarmacéuticos chinos;
5, se ha incluido en las normas nacionales de medicamentos chinos a base de plantas.
Entre los nuevos recursos alimentarios figuran:
Animales, plantas y microorganismos que no se consumen habitualmente en China;
2, de animales, plantas y microorganismos separados de las materias primas alimentarias que no se consumen habitualmente en China;
3, nuevas variedades de microorganismos utilizados en el procesado de alimentos;
4, debido a la utilización de nuevos procesos de producción que han modificado la composición o estructura original de los ingredientes alimentarios.
La producción y la gestión o el uso de nuevos recursos para las unidades de alimentos o individuos, en el producto por primera vez en el mercado deben ser reportados al Ministerio de Salud para su revisión y aprobación. Presentar los siguientes materiales:
1, nuevos recursos para la higiene alimentaria y formulario de solicitud de licencia administrativa;
2, informes de desarrollo e informes de investigación sobre seguridad;
3, breve descripción del proceso de producción y diagrama de flujo;
4, normas de calidad del producto;
5, investigación y utilización nacionales y extranjeras e información de seguridad relacionada;
6, etiquetas e instrucciones del producto;
7, otros datos que ayuden a la evaluación.
Si la empresa elige otras plantas o sus extractos fuera del catálogo de alimentos medicinales y alimentos de nuevos recursos como materias primas para la elaboración de alimentos, existen tres soluciones convencionales:
1, las grandes empresas para evitar el riesgo de declarar nuevos alimentos de recursos;
2, ahora también se puede procesar en los alimentos como materias primas, la preparación de las normas corporativas, a través del registro y obtener la certificación SC, al menos el gobierno local reconoció, pero otras áreas de riesgo de ventas, (por ejemplo: Hainan Ganoderma Lucidum evento).
3, también se puede escribir a la comisión provincial de salud para ver si se puede utilizar el comportamiento del gobierno a la Comisión Nacional de Salud (requiere una red fuerte).
(A) nuevos ingredientes alimentarios, definición y gestión de los alimentos ordinarios
Las nuevas materias primas alimentarias se refieren a los siguientes artículos que no tienen hábitos alimentarios tradicionales en China: animales, plantas y microorganismos; componentes aislados de animales, plantas y microorganismos; componentes alimentarios cuya estructura original ha sido modificada; y otras materias primas alimentarias de nuevo desarrollo. Los artículos que pertenezcan a una de las circunstancias anteriores, si necesitan ser desarrollados para la producción y el funcionamiento de alimentos ordinarios, deben ser declarados para su aprobación de acuerdo con las disposiciones de las "Medidas administrativas para el examen de la seguridad de nuevos ingredientes alimentarios".
Para los productos alimenticios con hábitos alimenticios tradicionales de conformidad con las Medidas Administrativas para el Examen de la Seguridad de Nuevos Ingredientes Alimenticios, la producción y el funcionamiento de las empresas pueden combinarse con las Medidas y aplicarse de conformidad con las disposiciones de la Ley de Seguridad Alimentaria.
En 2002, el antiguo Ministerio de Sanidad publicó la Notificación sobre la Normalización Adicional de la Gestión de Materias Primas para Alimentos Sanitarios, anunciando que los artículos de la Lista de Artículos que son tanto Alimentos como Medicamentos pueden utilizarse para la producción de alimentos ordinarios; y en 2010 se anunciaron las cepas de la Lista de Cepas que Pueden Utilizarse para Alimentos, que pueden utilizarse para la producción de alimentos ordinarios.
En 1998, el antiguo Ministerio de Sanidad publicó la Circular sobre la Disposición del Trabajo de Rectificación del Mercado Nacional de Alimentos Sanitarios de 1998, que enumeraba los nuevos alimentos de recurso de polen de colza, polen de maíz, polen de pino, polen de girasol, polen de Zizyphus, polen de alforfón, polen de sésamo, polen de sorgo, konjac, Spirulina obtususifoliae, Spirulina viridulae, Higo chumbo, Berenjena rosa, Pupa de gusano de seda, como productos alimenticios ordinarios.
(ii) Definición y gestión de las materias primas alimentarias y sanitarias comunes
En 2002, el antiguo Ministerio de Sanidad publicó la Notificación sobre la Normalización de la Gestión de Materias Primas para Alimentos Sanitarios, en la que se publicaba la Lista de Artículos que Pueden Utilizarse para Alimentos Sanitarios y la Lista de Artículos Prohibidos para Alimentos Sanitarios. Consulte la Circular para conocer las normas específicas sobre la gestión de los ingredientes de los alimentos sanitarios.
Los artículos que figuran en la Lista de artículos que pueden utilizarse en la alimentación sana publicada por el antiguo Ministerio de Sanidad en 2002 sólo pueden utilizarse en la alimentación sana. A excepción de los artículos utilizables en la alimentación general, los artículos de la Lista de artículos utilizables en la alimentación sanitaria no podrán producirse ni explotarse como materias primas para la alimentación general. Si existe la necesidad de desarrollar los artículos de la Lista de Artículos Utilizables en la Alimentación Sanitaria para la producción de alimentos ordinarios, se declararán para su aprobación de acuerdo con los procedimientos estipulados en las Medidas para la Administración del Examen de la Seguridad de Nuevas Materias Primas Alimentarias.
Como materias primas cosméticas
Los cosméticos de origen vegetal se clasifican en cosméticos de uso especial y cosméticos de uso no especial, y ambos requieren licencias de producción de cosméticos.
Las materias primas utilizadas en los cosméticos deben estar en el catálogo de materias primas cosméticas, las materias primas no están en el catálogo, debe estar de acuerdo con la cosmética a base de plantas nuevas materias primas para los procedimientos pertinentes, cosmética a base de plantas nuevas materias primas se refiere a la primera vez en el territorio de China para la producción de cosméticos de materias primas naturales de origen vegetal (incluidas las algas). Un solo ingrediente extraído de plantas o ingredientes altamente purificados, no entran en esta definición.
Solicitud de autorización administrativa de las nuevas materias primas cosméticas a base de plantas, debe estar de acuerdo con las "disposiciones de la concesión de licencias administrativas de cosméticos declaración y aceptación" y "nueva declaración de materias primas cosméticas y la revisión de la Guía" y otros requisitos pertinentes, presentar la declaración de concesión de licencias administrativas. Además, como materias primas cosméticas para fines especiales (por ejemplo: se ha utilizado ampliamente en productos antienvejecimiento en una serie de extractos de la medicina china, como el ginseng, el astrágalo, el ácido giberélico, el terciopelo de cuerno, Ganoderma lucidum, espino cerval de mar, Poria cocos, Angelica sinensis, perla, ginkgo biloba y onagra, etc.). También deberá presentarse la información correspondiente a la evaluación toxicológica de la seguridad.
Políticas sobre extractos vegetales en Europa, América y otros países
La gestión de los medicamentos a base de plantas en Estados Unidos está relativamente atrasada. En la Ley de Salud y Educación sobre Suplementos Dietéticos promulgada por Estados Unidos, la definición de "suplemento dietético" incluye "hierbas u otras plantas", así como "cualquier concentrado" de las mismas, lo que sin duda incluye "hierbas u otras plantas". "Esto no deja lugar a dudas en cuanto al estatus legal de los extractos de plantas como suplementos dietéticos.
En Alemania, los extractos de plantas pueden registrarse como medicamentos de prescripción en el procedimiento legislativo. En Alemania hay unos 60.000 tipos de medicamentos registrados que contienen ingredientes vegetales, la mayoría de los cuales son infusiones de hierbas, y existe un estricto procedimiento de aprobación para los medicamentos tradicionales chinos si quieren utilizarse como medicamentos botánicos en Alemania. En general, los medicamentos chinos entran en Alemania en forma de productos sanitarios y solicitan la gestión alimentaria.
En la Unión Europea, los medicamentos se clasifican en 8 tipos: patentados, genéricos, de venta libre, botánicos naturales, vacunas, hemoderivados, productos biológicos y antidepresivos. Además del Reino Unido y los Países Bajos, Alemania, Francia e Italia regulan los productos botánicos naturales como medicamentos de venta con receta o medicamentos de venta libre, y la modificación de la Directiva europea sobre el procedimiento de registro de medicamentos botánicos adoptada en 2003 estipula que los medicamentos botánicos tradicionales que en un principio estaban sujetos a la normativa alimentaria pertinente seguirán estándolo si contienen sustancias botánicas naturales o extractos de productos botánicos naturales en una cantidad inferior a la dosis médica. Reglamentos.
El uso de la medicina tradicional china en Japón está extremadamente restringido. En la actualidad, aparte de las 210 recetas aprobadas, el Ministerio de Salud y Bienestar (MHLW) es excepcionalmente estricto a la hora de aprobar la adición de nuevas medicinas chinas a base de plantas, tratando a las medicinas chinas a base de plantas de la misma manera que a los nuevos medicamentos de compuestos, lo que equivale casi a cerrar la puerta, y también existen bastantes medidas restrictivas a la hora de aprobar las medicinas chinas patentadas importadas. Sin embargo, en los últimos años, el Gobierno japonés ha suavizado aparentemente su control sobre los alimentos saludables, como la eliminación de las restricciones sobre las formas de dosificación y la relajación de las restricciones sobre los tipos de productos botánicos naturales que pueden utilizarse en los alimentos saludables.
