Pflanzenextrakte werden häufig in der Pharmazie, in Lebensmitteln, Kosmetika, Zusatzstoffen, Gesundheitsprodukten und anderen Bereichen verwendet, so dass die verarbeitenden Unternehmen je nach Verwendung, Industriemanagement oder nationalen Vorschriften usw. die entsprechenden Zulassungsvoraussetzungen erfüllen müssen, die sich grob in die folgenden Kategorien einteilen lassen:
1, da Rohstoffe für Medikamente eingereicht werden sollten;
2, die als Lebensmittel verarbeitet werden, müssen eine Lebensmittelherstellungslizenz (SC) beantragen, Lebensmittelkategorien: feste Getränke, gesunde Lebensmittel, Lebensmittelzusatzstoffe;
3, die als Futtermittelzusatzstoffe verwendet werden, sollten eine Lizenz zur Herstellung von Futtermittelzusatzstoffen beantragen;
4, Produkt-Export-Verkäufe, Export Produktion Unternehmen sollten eingereicht werden.
Zweitens gibt es in der Pflanzenextraktbranche mehr als 30 freiwillige Zertifizierungen, darunter die Systemzertifizierung (ISO), die Produktzertifizierung (Kosher, HALAL, usw.), die Zertifizierung der Produktionsspezifikationen (GMP), die Bio-Zertifizierung (China Organic Certification) und die Laborzertifizierung (CNAS, CMA).
Im Folgenden wird beschrieben, welche Genehmigungen für Pflanzenextrakte erforderlich sind, die in Arzneimitteln, Lebensmitteln, Kosmetika, Gesundheitsprodukten und anderen Bereichen verwendet werden.
Als Extrakte der chinesischen Medizin
Die Hauptinstanz für die Einreichung von Extrakten aus chinesischer Medizin ist der Extrakthersteller, der die Lizenz zur Herstellung von Arzneimitteln einholen muss, die den Umfang der Produktion von Extrakten aus chinesischer Medizin enthält, die Anforderungen der GMP erfüllt und die Extraktprodukte an den Hersteller von pCm liefert.
Die Angaben des Herstellers des Extrakts aus chinesischer Medizin in der Anmeldung müssen Folgendes enthalten
1. Grundlegende Informationen über das Unternehmen und technische Informationen über den Extrakt;
2, "Lizenz zur Herstellung von Arzneimitteln", "Geschäftslizenz" und andere Belege;
3, Herstellung von Extrakten mit chinesischen pflanzlichen Arzneimitteln, chinesische Medizin Tabletten Informationen, einschließlich der Herkunft, Basis, Quelle, Umsetzung der
Normen, Rezepturspezifikationen und Auditberichte über die Qualifikation der Lieferanten und das Qualitätssicherungssystem der Produktion;
4、Detaillierter Produktionsprozess der Extrakte, einschließlich Prozessplan, Schlüsselparameter, Hauptausrüstung usw;
5, interne Kontrollqualitätsstandards für Extrakte oder nationale pharmazeutische Standards für Extrakte.
Am 29. Juli 2014 gab das State Bureau die Food and Drug Administration Pharmaceutical and Chemical Supervision [2014] No. 135 "Notice of the Food and Drug Administration on Strengthening the Supervision and Management of Extracts and Extracts in the Production of Traditional Chinese Medicines" heraus, in der gefordert wird, dass "die Extrakte der chinesischen Medizin, die unter der Vorschrift des nationalen Arzneimittelstandards für pCms und mit einem separaten nationalen Arzneimittelstandard aufgeführt sind, für das Record Management umgesetzt werden sollten. "Record den Erfolg der Pflanzenextrakt Unternehmen sollten im Einklang mit den Anforderungen der GMP, um die Produktion zu organisieren, um die Qualität der Produkte zu gewährleisten, und die tägliche Überwachung durch den Standort der Provinz (autonome Regionen und Gemeinden) Food and Drug Administration ist verantwortlich für.
Gemäß den Anforderungen der Bekanntmachung können 47 Extrakte der chinesischen Medizin zur Verwaltung eingereicht werden, d.h. das Unternehmen kann sie selbst herstellen, sie können auch gekauft werden, die anderen müssen vom Unternehmen selbst extrahiert werden.
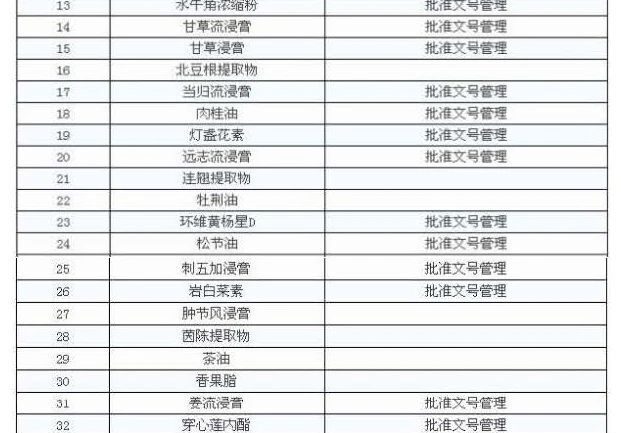
Als Rohmaterial für die Zubereitung von medizinischen Einrichtungen
Medizinische Einrichtungen zur Vorbereitung von Präparaten sollte eine "medizinische Einrichtung Praxis Lizenz", und im Einklang mit der "medizinischen Einrichtung Vorbereitung Vorbereitung Qualitätsmanagement-Standard" zu erhalten "medizinische Einrichtung Vorbereitung Lizenz", können ihre eigenen Vorbereitungen zu konfigurieren.
Die Verwaltungsmaßnahmen für die Registrierung von Zubereitungen für medizinische Einrichtungen (für die Durchführung von Versuchen) schreiben vor, dass medizinische Einrichtungen, die Zubereitungen beantragen, entsprechende präklinische Studien durchführen müssen, einschließlich der Prüfung der Verschreibung, des Zubereitungsprozesses, der Qualitätsindikatoren, der Pharmakologie, der toxikologischen Studien usw. Die chinesischen pflanzlichen Arzneimittel, die bei der Beantragung von Präparaten verwendet werden, müssen eine Zulassung für medizinische Einrichtungen haben. Die chinesischen pflanzlichen Arzneimittel und die Tabletten der traditionellen chinesischen Medizin, die in den Zubereitungsanträgen verwendet werden, müssen eine Zulassungsnummer haben und den gesetzlichen Arzneimittelstandards entsprechen. Die Methode legt auch fest, dass einer der folgenden Umstände nicht als Zubereitung für medizinische Einrichtungen deklariert werden darf:
1, der Markt wurde mit Sorten beliefert;
2、Sorten mit Wirkstoffen, die nicht von der staatlichen Lebensmittel- und Arzneimittelbehörde zugelassen sind;
3, zusätzlich zu den Allergenen auch zu biologischen Produkten;
4, Chinesische Medizin Injektion;
5, Chinesische Medizin, chemische Zusammensetzung der Verbindung Vorbereitung;
6, Betäubungsmittel, Psychopharmaka, toxische Arzneimittel für medizinische Zwecke, radioaktive Arzneimittel.
In der Bekanntmachung über die Umsetzung der Aufzeichnungen über die Anwendung traditioneller Verfahren zur Herstellung chinesischer Arzneimittel durch medizinische Einrichtungen heißt es, dass zu den traditionellen chinesischen Arzneimitteln auch traditionelle Zubereitungen gehören:
1, feste (Pillen, Dispersionen, Dans, Barren usw.), halbfeste (Salbe, Paste usw.) und flüssige (Tonika usw.) traditionelle Darreichungsformen, die aus chinesischen Heilkräutern durch Pulverisierung oder nur durch Wasser- oder Ölextraktion hergestellt werden;
2, Granulat aus mit Wasser extrahierten chinesischen Heilkräutern und Kapseln aus zerkleinerten chinesischen Heilkräutern;
3, Liköre und Tinkturen aus chinesischen Heilkräutern, die nach traditionellen Methoden extrahiert wurden.
Die von der medizinischen Einrichtung eingereichten Präparate der traditionellen chinesischen Medizin müssen mit dem Diagnose- und Behandlungsumfang übereinstimmen, der in ihrer "Lizenz zur Ausübung der Tätigkeit in einer medizinischen Einrichtung" festgelegt ist. Einer der folgenden Fälle darf nicht eingereicht werden:
1, "Vorbereitungen für Verwaltungsmaßnahmen zur Registrierung medizinischer Einrichtungen (zur probeweisen Umsetzung)" in den Bestimmungen der Umstände nicht als Vorbereitungen einer medizinischen Einrichtung deklariert werden;
2, und der Markt wurde mit verschiedenen Darreichungsformen ein und desselben Rezepts beliefert;
3, Chinesische Medizin Formel Teilchen;
Zusammenfassend lässt sich sagen, dass es sich bei den Rohstoffen für die Zubereitungen medizinischer Einrichtungen um chinesische pflanzliche Arzneimittel oder Tabletten der chinesischen Medizin und nicht um Extrakte der chinesischen Medizin handeln sollte, und dass medizinische Einrichtungen nur hausgemachte Zubereitungen kaufen können, die für die Erfassung von Rohstoffen zugelassen wurden.
Als Rohstoffe für gesunde Lebensmittel
Die 2015 erlassenen Maßnahmen für die Verwaltung der Registrierung und Einreichung von Lebensmitteln für den Gesundheitsbereich legen eindeutig fest, dass die CFDA die Auftragsverarbeitung von Extrakten der chinesischen Medizin verbietet, und die Einreichung von Pflanzenextrakten ist zu einem neuen Trend in der Entwicklung der Branche geworden.
Ende 2016 hat die CFDA die Überprüfungsregeln für die Produktionslizenz für gesunde Lebensmittel herausgegeben, die die spezifischen Regeln für die Einbeziehung von Pflanzenextrakten in die Produktion von gesunden Lebensmitteln weiter standardisiert haben. Antragsteller, die Pflanzen- und Tierextrakte für andere Unternehmen als Rohstoffe für die Herstellung von Gesundheitsnahrungsmitteln bereitstellen, sollten Lizenzen für die Herstellung von Rohmaterialextrakten in Übereinstimmung mit den Anforderungen dieser Regeln beantragen; diejenigen, die nur mit der Gewinnung von Rohmaterialien für von dem Unternehmen hergestellte Gesundheitsnahrungsmittel beschäftigt sind, beantragen Lizenzen für die Herstellung von Gesundheitsnahrungsmitteln und müssen keine separaten Lizenzen für die Herstellung von Rohmaterialextrakten beantragen. Das bedeutet, dass ein Unternehmen, das seine eigenen Reformkostprodukte herstellt, selbst Pflanzen und Tiere extrahieren kann. Die Lizenz für die Herstellung von Rohmaterialextrakten für Reformkost sollte in der Spalte "Arten" den Projektnamen des Rohmaterialextrakts und in der Spalte "Bemerkungen" den Namen des Reformkostprodukts, die Registrierungsnummer oder die Eintragungsnummer und andere Informationen enthalten.
Antragsteller, die für die Gesundheit Lebensmittel-Rohstoff-Extrakt Produktionslizenz, sollte auf die Gesundheit Lebensmittel-Registrierung Dokumente oder Einreichung Bescheinigung, sowie die Registrierung Dokumente oder Einreichung Bescheinigungen, die in der Rohstoff-Extrakt des Produktionsprozesses, Qualitätsstandards.
Der Katalog für gesunde Lebensmittelzutaten bezieht sich auf die Sicherheits- und Funktionsbewertung und kann für gesunde Lebensmittelzutaten und die dazugehörigen Listen mit relevanten Informationen verwendet werden. Jede Einheit oder Einzelperson kann auf der Grundlage einschlägiger Forschungsarbeiten dem Zentrum für die Bewertung gesunder Lebensmittel der staatlichen Lebensmittel- und Arzneimittelbehörde vorschlagen, welche Rohstoffe in den Katalog der gesunden Lebensmittelzutaten aufgenommen werden sollen.
Die Rohstoffe, die in den Katalog der gesunden Lebensmittelzutaten aufgenommen werden sollen, müssen die folgenden Anforderungen erfüllen:
1, mit einem breiten Spektrum an in- und ausländischen Lebensmitteln und ausreichenden wissenschaftlichen Nachweisen;
2, mit einem klaren Dosierungsbereich und entsprechenden Versorgungsfunktionen gemäß den Anforderungen des Versorgungsfunktionskatalogs;
3, mit stabiler und kontrollierbarer Qualität und technischen Anforderungen;
4、 Es verfügt über eine wissenschaftliche Grundlage, die die Anforderungen an Sicherheit und Wirksamkeit erfüllt;
5, mit wissenschaftlich anwendbarer, stabiler und verlässlicher Wirksamkeit von Inhaltsstoffen oder charakteristischen Inhaltsstoffen, Inhaltsbereich und Testmethoden;
6, in Übereinstimmung mit der vorgeschriebenen Dosierung und Art der Einnahme, sicher und unschädlich für die betroffene Bevölkerung.

Als Zutat für Lebensmittel
Nach dem Lebensmittelsicherheitsgesetz sind "Lebensmittel alle Arten von Fertigerzeugnissen und Rohstoffen, die für den menschlichen Verzehr oder zum Trinken bestimmt sind, sowie Gegenstände, die nach der Tradition sowohl Lebensmittel als auch Arzneimittel sind, jedoch keine Gegenstände für therapeutische Zwecke". Es besteht kein Zweifel, dass Pflanzenextrakte für Lebensmittel Lebensmittel sind und gemäß den Anforderungen des Lebensmittelsicherheitsgesetzes zugelassen werden sollten. Pflanzenextrakte, die für die Lebensmittelverarbeitung verwendet werden, sollten aus Rohstoffen gewonnen werden, die aus dem Katalog der Arznei- und Lebensmittel oder der neuen Lebensmittelressourcen ausgewählt wurden.
Stoffe, die sowohl Lebensmittel als auch Arzneimittel sind, beziehen sich auf die verwertbaren Teile von Tieren und Pflanzen, die traditionell gegessen werden und im nationalen Standard für chinesische pflanzliche Arzneimittel aufgeführt sind. Stoffe, die in den Katalog der Rohstoffe für Lebensmittel und Arzneimittel aufgenommen werden, sollten gleichzeitig die folgenden Anforderungen erfüllen:
1. In Übereinstimmung mit dem Lebensmittelsicherheitsgesetz und den einschlägigen Vorschriften;
2, im Kanon der chinesischen Medizin gibt es essbare Aufzeichnungen, keine Aufzeichnungen über Toxizität gefunden;
3, bei den traditionellen Verzehrsgewohnheiten hat sich gezeigt, dass der normale Verzehr keine akuten oder subakuten Auswirkungen auf die menschliche Gesundheit hat,
Chronische oder andere potenzielle Schäden für die menschliche Gesundheit, im Einklang mit den ernährungswissenschaftlichen Anforderungen haben sollte;
4, im Einklang mit den einschlägigen Gesetzen und Verordnungen zum Schutz der Ressourcen der chinesischen pflanzlichen Arzneimittel;
5, wurde in die nationalen Normen für chinesische pflanzliche Arzneimittel aufgenommen.
Zu den neuen Ressourcen gehören Lebensmittel:
Tiere, Pflanzen und Mikroorganismen, die in China üblicherweise nicht verzehrt werden;
2, aus Tieren, Pflanzen und Mikroorganismen, die von den in China nicht üblichen Lebensmittelrohstoffen getrennt werden;
3, neue Sorten von Mikroorganismen für die Lebensmittelverarbeitung;
4, durch den Einsatz neuer Produktionsverfahren, die zu einer Veränderung der ursprünglichen Zusammensetzung oder Struktur der Lebensmittelzutaten führen.
Die Herstellung und Verwaltung oder Verwendung neuer Ressourcen für Lebensmitteleinheiten oder Einzelpersonen, die das Produkt zum ersten Mal auf den Markt bringen, sollten dem Gesundheitsministerium zur Überprüfung und Genehmigung gemeldet werden. Reichen Sie die folgenden Materialien ein:
1, neue Mittel für Lebensmittelhygiene und Antragsformular für behördliche Genehmigungen;
2, Entwicklungsberichte und Sicherheitsforschungsberichte;
3, eine kurze Beschreibung des Produktionsprozesses und ein Flussdiagramm;
4, Qualitätsstandards für Produkte;
5, Forschung und Nutzung im In- und Ausland und damit verbundene Sicherheitsinformationen;
6, Produktetiketten und Anweisungen;
7, sonstige Informationen, die die Bewertung erleichtern.
Wählt das Unternehmen andere Pflanzen oder deren Extrakte außerhalb des Katalogs der medizinischen Lebensmittel und der Lebensmittel aus neuen Ressourcen als Rohstoffe für die Lebensmittelverarbeitung, gibt es drei konventionelle Lösungen:
1, große Unternehmen zu vermeiden, das Risiko der Erklärung der neuen Ressource Lebensmittel;
2, kann auch jetzt in Lebensmitteln als Rohstoffe verarbeitet werden, die Vorbereitung der Corporate Standards, durch die Aufzeichnung und erhalten SC-Zertifizierung, zumindest die lokale Regierung anerkannt, aber andere Bereiche des Umsatzes Risiko, (zB: Hainan Ganoderma Lucidum Veranstaltung).
3, kann auch an die Provinzgesundheitskommission geschrieben werden, um zu sehen, ob Sie das Verhalten der Regierung gegenüber der Nationalen Gesundheitskommission nutzen können (erfordert ein starkes Netzwerk).
(A) neue Lebensmittelzutaten, Definition und Verwaltung herkömmlicher Lebensmittel
Neue Lebensmittelrohstoffe beziehen sich auf die folgenden Gegenstände, die in China keine traditionellen Essgewohnheiten haben: Tiere, Pflanzen und Mikroorganismen; aus Tieren, Pflanzen und Mikroorganismen isolierte Bestandteile; Lebensmittelbestandteile, deren ursprüngliche Struktur verändert wurde; und andere neu entwickelte Lebensmittelrohstoffe. Artikel, auf die einer der oben genannten Umstände zutrifft, sollten, wenn sie für die Herstellung und den Betrieb gewöhnlicher Lebensmittel entwickelt werden müssen, gemäß den Bestimmungen der "Verwaltungsmaßnahmen für die Prüfung der Sicherheit neuer Lebensmittelzutaten" zur Zulassung angemeldet werden.
Für Lebensmittel mit traditionellen Essgewohnheiten gemäß den Verwaltungsmaßnahmen zur Prüfung der Sicherheit neuer Lebensmittelzutaten können die Produktion und der Betrieb von Unternehmen mit den Maßnahmen kombiniert und gemäß den Bestimmungen des Lebensmittelsicherheitsgesetzes umgesetzt werden.
Das damalige Gesundheitsministerium gab 2002 die Bekanntmachung über die weitere Standardisierung der Verwaltung von Rohstoffen für gesunde Lebensmittel heraus und verkündete, dass die in der Liste der Artikel, die sowohl Lebensmittel als auch Arzneimittel sind, für die Herstellung gewöhnlicher Lebensmittel verwendet werden können.
Im Jahr 1998 erließ das damalige Gesundheitsministerium den Runderlass über die Durchführung der Arbeiten zur Berichtigung des nationalen Marktes für gesunde Lebensmittel im Jahr 1998, in dem die neuen Ressourcen-Lebensmittel Raps-, Mais-, Kiefern-, Sonnenblumen-, Zizyphus-, Buchweizen-, Sesam- und Sorghum-Pollen, Konjak, Spirulina obtusususifoliae, Spirulina viridulae, Feigenkaktus, Aubergine und Seidenraupenpuppe als gewöhnliche Lebensmittel aufgeführt wurden.
(ii) Definition und Verwaltung von Rohstoffen für herkömmliche Lebensmittel und gesunde Lebensmittel
Das damalige Gesundheitsministerium hat im Jahr 2002 die Bekanntmachung über die weitere Standardisierung der Verwaltung von Rohstoffen für Reformkost herausgegeben, in der die Liste der für Reformkost verwendbaren Artikel und die Liste der für Reformkost verbotenen Artikel veröffentlicht wurden. In diesem Rundschreiben finden Sie die spezifischen Vorschriften für die Verwaltung von Zutaten für gesunde Lebensmittel.
Die Artikel, die in der Liste der Artikel, die in gesunden Lebensmitteln verwendet werden können, aufgeführt sind, die vom früheren Gesundheitsministerium im Jahr 2002 veröffentlicht wurde, können nur in gesunden Lebensmitteln verwendet werden. Mit Ausnahme der Artikel, die in allgemeinen Lebensmitteln verwendet werden können, dürfen die Artikel in der Liste der für gesunde Lebensmittel verwendbaren Artikel nicht als Rohstoffe für allgemeine Lebensmittel hergestellt und verwendet werden. Besteht die Notwendigkeit, die in der Liste der für gesunde Lebensmittel verwendbaren Artikel für die Herstellung gewöhnlicher Lebensmittel weiterzuentwickeln, müssen sie gemäß den in den Maßnahmen für die Verwaltung der Prüfung der Sicherheit neuer Lebensmittelrohstoffe festgelegten Verfahren zur Zulassung angemeldet werden.
Als kosmetische Rohstoffe
Kosmetika auf pflanzlicher Basis werden in Spezialkosmetika und Nicht-Spezialkosmetika eingeteilt, für die jeweils eine Lizenz zur Herstellung von Kosmetika erforderlich ist.
Rohstoffe in Kosmetika verwendet werden, müssen in den Katalog der kosmetischen Rohstoffe, die Rohstoffe nicht in den Katalog, sollte im Einklang mit der pflanzlichen kosmetischen neue Rohstoffe für die einschlägigen Verfahren, pflanzliche kosmetische neue Rohstoffe bezieht sich auf das erste Mal in Chinas Gebiet für die kosmetische Produktion von natürlichen Rohstoffen pflanzlichen Ursprungs (einschließlich Algen). Ein einzelner Bestandteil, der aus Pflanzen extrahiert wurde, oder hoch gereinigte Bestandteile fallen nicht unter diese Definition.
Antrag auf administrative Zulassung von neuen pflanzlichen kosmetischen Rohstoffen, sollte in Übereinstimmung mit den "Bestimmungen der administrativen Zulassung von Kosmetika Erklärung und Akzeptanz" und "neue kosmetische Rohstoffe Erklärung und Überprüfung des Leitfadens" und anderen relevanten Anforderungen, einreichen administrative Lizenzierung Erklärung. Darüber hinaus, wie ein spezieller Zweck kosmetischen Rohstoffen (zB: wurde häufig in Anti-Aging-Produkte in einer Reihe von chinesischen Medizin-Extrakte, wie Ginseng, Astragalus, Gibberellinsäure, Geweih Samt, Ganoderma lucidum, Sanddorn, Poria cocos, Angelica sinensis, Perle, Ginkgo biloba und Nachtkerze, etc.) Entsprechende Informationen zur toxikologischen Unbedenklichkeitsbewertung sollten ebenfalls vorgelegt werden.
Politiken zu Kräuterextrakten in Europa, Amerika und anderen Ländern
Der Umgang mit pflanzlichen Arzneimitteln ist in den Vereinigten Staaten relativ rückständig. In dem von den Vereinigten Staaten erlassenen Gesetz über Nahrungsergänzungsmittel (Dietary Supplement Health and Education Act) schließt die Definition von "Nahrungsergänzungsmittel" sowohl "Kräuter oder andere Pflanzen" als auch "jedes Konzentrat" davon ein, was zweifellos "Kräuter oder andere Pflanzen" einschließt. "Dies lässt keinen Zweifel an der rechtlichen Stellung von Pflanzenextrakten als Nahrungsergänzungsmittel.
In Deutschland dürfen Pflanzenextrakte im Rahmen des Gesetzgebungsverfahrens als verschreibungspflichtige Arzneimittel zugelassen werden. In Deutschland gibt es etwa 60.000 registrierte Arzneimittel, die pflanzliche Bestandteile enthalten, die meisten davon sind Kräutertees, und es gibt ein strenges Zulassungsverfahren für traditionelle chinesische Arzneimittel, wenn sie in Deutschland als pflanzliche Arzneimittel verwendet werden sollen. Im Allgemeinen werden chinesische Arzneimittel in China in Form von Gesundheitsprodukten nach Deutschland eingeführt und für das Lebensmittelmanagement angemeldet.
In der Europäischen Union werden Arzneimittel in acht Kategorien eingeteilt: patentierte Arzneimittel, Generika, rezeptfreie Arzneimittel, natürliche pflanzliche Arzneimittel, Impfstoffe, Blutprodukte, biologische Produkte und Antidepressiva. Neben dem Vereinigten Königreich und den Niederlanden regeln auch Deutschland, Frankreich und Italien natürliche pflanzliche Stoffe als verschreibungspflichtige oder rezeptfreie Arzneimittel, und die 2003 verabschiedete Änderung der europäischen Richtlinie über das Registrierungsverfahren für pflanzliche Arzneimittel sieht vor, dass traditionelle pflanzliche Arzneimittel, die ursprünglich den einschlägigen Lebensmittelvorschriften unterlagen, weiterhin den einschlägigen Lebensmittelvorschriften unterliegen, wenn sie natürliche pflanzliche Stoffe oder Extrakte natürlicher pflanzlicher Stoffe in einer Menge enthalten, die unter der medizinischen Dosierung liegt. Verordnungen.
Die Verwendung traditioneller chinesischer Medizin ist in Japan extrem eingeschränkt. Abgesehen von den 210 genehmigten Verschreibungen ist das Ministerium für Gesundheit und Wohlfahrt (MHLW) derzeit außerordentlich streng bei der Genehmigung neuer chinesischer pflanzlicher Arzneimittel, wobei es chinesische pflanzliche Arzneimittel genauso behandelt wie neue Medikamente, was fast einer Schließung der Tür gleichkommt, und es gibt auch eine ganze Reihe von restriktiven Maßnahmen bei der Genehmigung importierter proprietärer chinesischer Arzneimittel. In den letzten Jahren hat die japanische Regierung jedoch offenbar ihre Kontrolle über Reformkost gelockert, indem sie beispielsweise die Beschränkungen für die Darreichungsformen aufhob und die Beschränkungen für die Arten natürlicher pflanzlicher Stoffe, die in Reformkost verwendet werden dürfen, lockerte.
