Effiziente Abtrennung und Reinigung eines neuen fibrinolytischen Enzyms aus dem Fruchtkörper des Samtgeweihpilzes
Thromboembolische Erkrankungen sind mit einer hohen Behinderungs- und Sterblichkeitsrate verbunden. Fibrin ist der Hauptbestandteil von Blutgerinnseln, daher ist die Förderung des Fibrinabbaus ein gängiges Mittel zur Vorbeugung und Behandlung thrombotischer Erkrankungen. Exogene fibrinolytische Enzyme wie Urokinase (UK) und Streptokinase (SK) werden in der klinischen Behandlung thromboembolischer Erkrankungen häufig eingesetzt, da sie Fibrin indirekt oder direkt hydrolysieren können. Obwohl sie eine beträchtliche thrombolytische Wirksamkeit aufweisen, haben sie auch gewisse Anwendungsbeschränkungen wie eine kurze Halbwertszeit und erhebliche Nebenwirkungen. Daher ist die Suche nach neuen fibrinolytischen Enzymen mit hoher Spezifität, guter Sicherheit und geringen Nebenwirkungen zu einem aktuellen Forschungsschwerpunkt geworden.
Speisepilze sind reich an Proteinen, Polysacchariden, Terpenen, Aminosäuren, Sterolen, Nukleosiden und anderen Stoffen, die verschiedene physiologische Funktionen haben, wie z. B. antioxidative, antitumorale, immunregulatorische und neuronale Funktionen. Gegenwärtig wird der Erforschung von fibrinolytischen Enzymen aus Speisepilzen und ihren funktionellen Eigenschaften große Aufmerksamkeit geschenkt. Es wurde berichtet, dass fibrinolytische Enzyme aus verschiedenen Speisepilzen wie Lentinus edodes, Cordyceps militaris, Agrocybe aegerita, Tricholoma sejunctum, Lepista nuda, Pleurotus ferulae usw. isoliert und extrahiert worden sind.
Der Hirschgeweihpilz ist ein holzverrottender, essbarer und medizinischer Pilz, der in den gemäßigten Regionen der nördlichen Hemisphäre weit verbreitet ist. Er hat physiologische Funktionen wie Antioxidantien, Stärkung des Immunsystems, Tumorbekämpfung und Senkung der Blutfette. In vorläufigen Experimenten wurde festgestellt, dass der Extrakt aus dem Fruchtkörper des Samtgeweihpilzes eine hohe Plasminaktivität aufweist, die deutlich höher ist als die von anderen Speisepilzen gemeldete Plasminaktivität. In diesem Artikel wird die Methode zur Abtrennung und Reinigung des fibrinolytischen Enzyms aus dem Fruchtkörper des Samtfußrüblings vorgestellt und eine vorläufige Identifizierung des Enzyms vorgenommen. Unsere Forschungsgruppe hat bisher keine anderen Berichte über fibrinolytische Enzyme in Samtgeweihpilzen gesehen. Diese Studie kann eine Grundlage für die Durchführung von thrombolytischen und antithrombotischen Funktionstests des fibrinolytischen Enzyms des Samtfußrüblings liefern und auch eine theoretische Grundlage für seine Verwendung bei der Entwicklung von funktionellen Lebensmitteln legen.
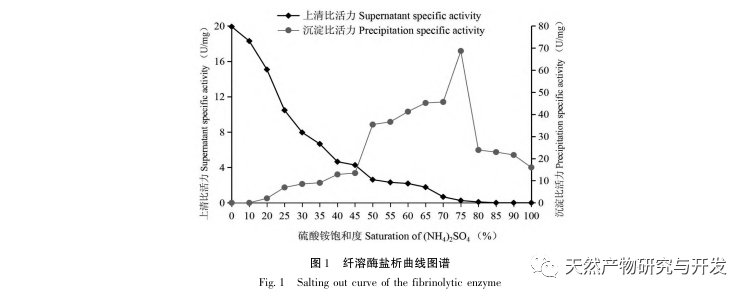
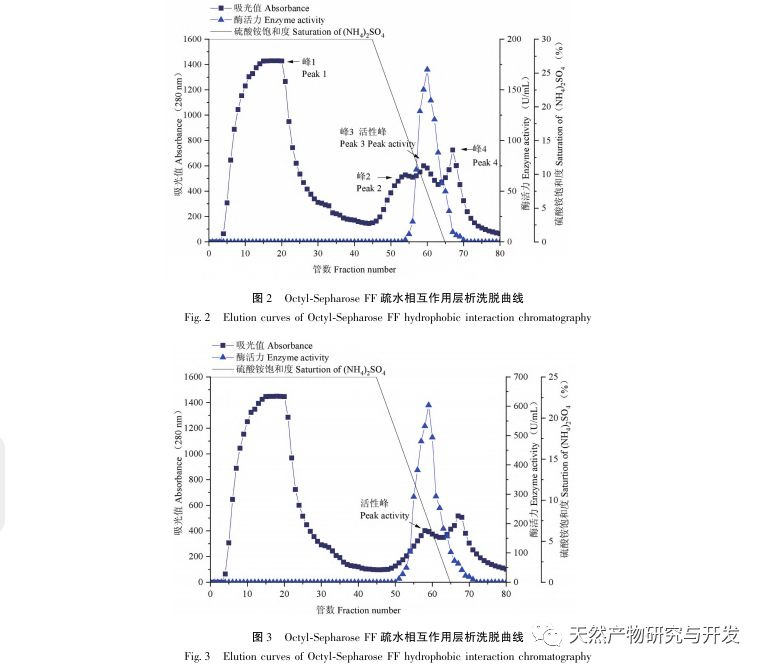
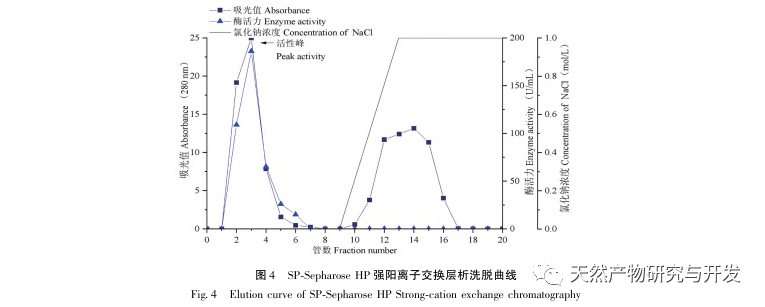
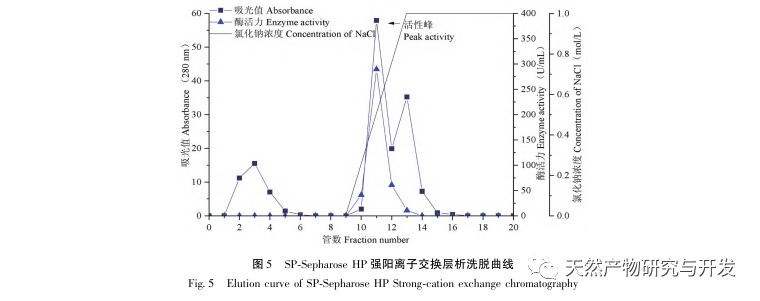
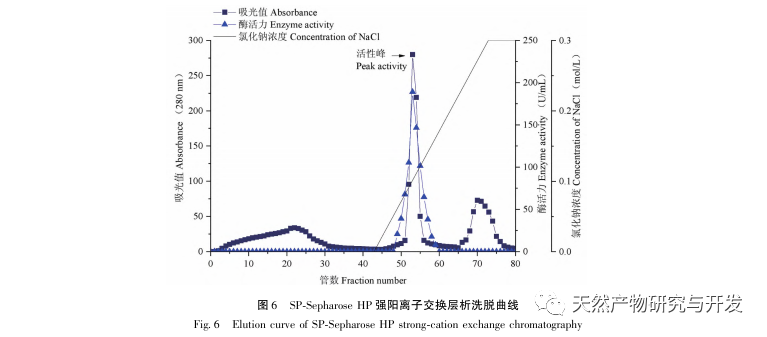
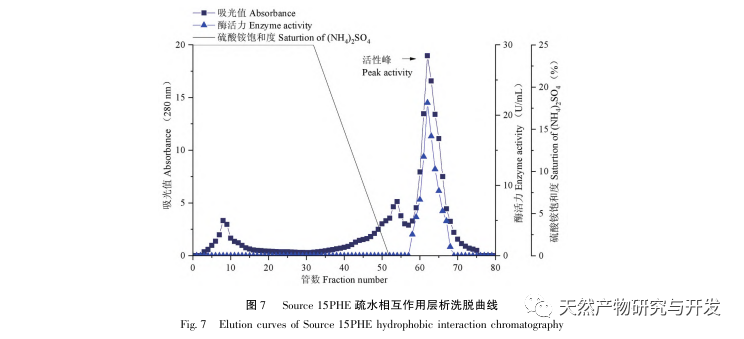
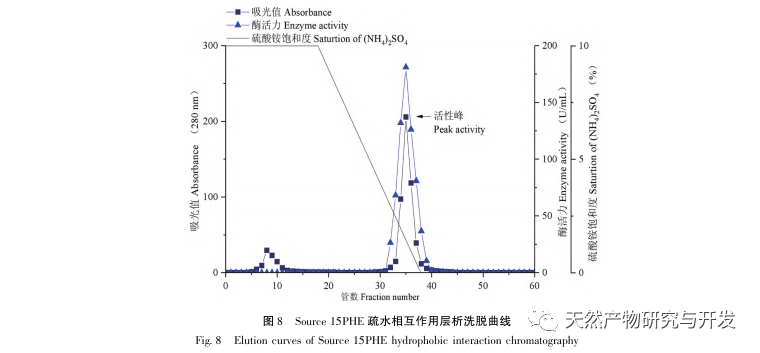
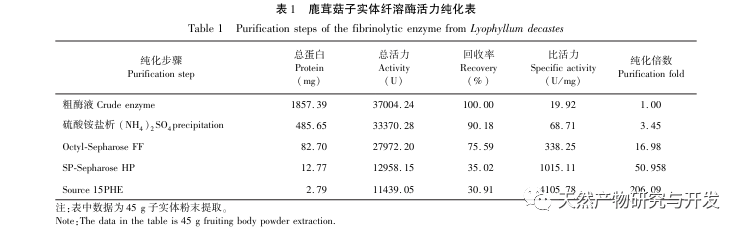
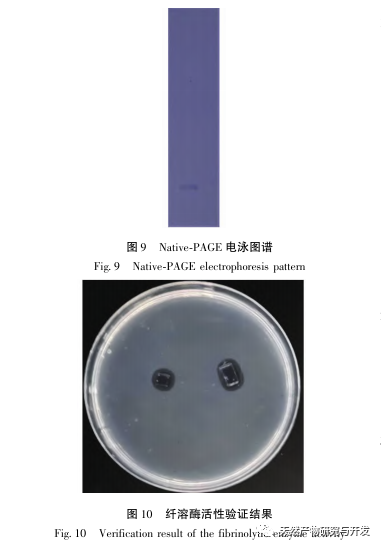
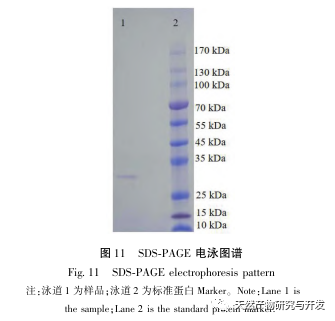
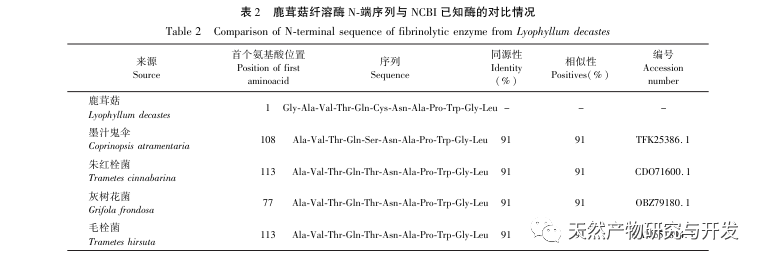 In dieser Studie wurde ein fibrinolytisches Enzym aus dem Fruchtkörper des Samtgeweihpilzes isoliert und mittels moderner chromatographischer Trenntechnik gereinigt. Die N-terminale zwölf Aminosäuresequenz des fibrinolytischen Enzyms ist Gly Ala Val Thr Gln Asn Ala Pro Trp Gly Leu. Nach einem Vergleich mit der NCBI-Datenbank wurde das fibrinolytische Enzym als ein neuartiges fibrinolytisches Enzym identifiziert. Die spezifische Aktivität des fibrinolytischen Enzyms beträgt 4105,78U/mg, der Reinigungsfaktor 206,09 und die Aktivitätsrückgewinnungsrate 30,91%. Durch Native PAGE-Elektrophorese und SDS-PAGE-Elektrophorese wurde festgestellt, dass das relative Molekulargewicht des fibrinolytischen Enzyms 30,9 kDa beträgt. Die obigen Ergebnisse deuten darauf hin, dass das neue fibrinolytische Enzym, das aus dem Fruchtkörper von Samtgeweihpilzen gewonnen wird, ein gutes thrombolytisches Potenzial besitzt und für die Entwicklung von funktionellen Lebensmitteln zur Verringerung der Thrombophilie-Tendenz verwendet werden kann.
In dieser Studie wurde ein fibrinolytisches Enzym aus dem Fruchtkörper des Samtgeweihpilzes isoliert und mittels moderner chromatographischer Trenntechnik gereinigt. Die N-terminale zwölf Aminosäuresequenz des fibrinolytischen Enzyms ist Gly Ala Val Thr Gln Asn Ala Pro Trp Gly Leu. Nach einem Vergleich mit der NCBI-Datenbank wurde das fibrinolytische Enzym als ein neuartiges fibrinolytisches Enzym identifiziert. Die spezifische Aktivität des fibrinolytischen Enzyms beträgt 4105,78U/mg, der Reinigungsfaktor 206,09 und die Aktivitätsrückgewinnungsrate 30,91%. Durch Native PAGE-Elektrophorese und SDS-PAGE-Elektrophorese wurde festgestellt, dass das relative Molekulargewicht des fibrinolytischen Enzyms 30,9 kDa beträgt. Die obigen Ergebnisse deuten darauf hin, dass das neue fibrinolytische Enzym, das aus dem Fruchtkörper von Samtgeweihpilzen gewonnen wird, ein gutes thrombolytisches Potenzial besitzt und für die Entwicklung von funktionellen Lebensmitteln zur Verringerung der Thrombophilie-Tendenz verwendet werden kann.
