Vorläufige Studie über den Schutzmechanismus von neutralen Polysacchariden aus Rüben gegen oxidative Schäden in PC12-Zellen
Die Rübe (Brassica rapa L.), auch bekannt als Chagu oder Manjing, gehört zur Familie der Brassicaceae und zur Gattung Brassica. Sie wird mit ihren Wurzeln als Heilpflanze verwendet und ist reich an Nährstoffen. Sie kann lange Zeit verzehrt werden und ist als "Langlebigkeitsfrucht" bekannt. Sie wirkt appetitanregend und verdauungsfördernd, fördert die Qi-Zirkulation, lindert Husten und Asthma, fördert die Diurese und Entgiftung. Die moderne pharmakologische Forschung hat herausgefunden, dass Rüben pharmakologische Wirkungen haben, wie z. B. Senkung des Blutzuckerspiegels, Antioxidation, Anti-Aging, Anti-Tumor, Regulierung der Immunität und Entzündungshemmung. In den Voruntersuchungen hat das Forschungsteam gemessen, dass der Gehalt an Rübenpolysacchariden bei 11,53% liegt. Nach Entfettung und entfärbender Reinigung wurde das wasserlösliche Rübenpolysaccharid BRP gewonnen. Es wurde weiter isoliert und gereinigt, um neutrale Polysaccharide aus Brassica rapa L. (BRNP) und saure Polysaccharide aus Brassica rapa L. (BRAP) zu erhalten, und ihre Strukturen wurden identifiziert. Vorläufige Experimente haben gezeigt, dass Rübenpolysaccharide eine gute antioxidative Wirkung haben, was die experimentelle Grundlage für die Anwendung von Rübenpolysacchariden in der Antioxidations- und Anti-Aging-Forschung bildet. Daher wurde in dieser Studie ein Modell der vorzeitigen Alterung von PC12-Zellen, die durch H2O2 induziert wurden, erstellt, um die Expressionsniveaus von Bax-, Bcl-2- und Caspase-3-Proteinen in PC12-Zellen nach H2O2-induzierter Schädigung durch BRNP zu untersuchen und den Anti-Aging-Mechanismus von BRNP weiter aufzuklären.

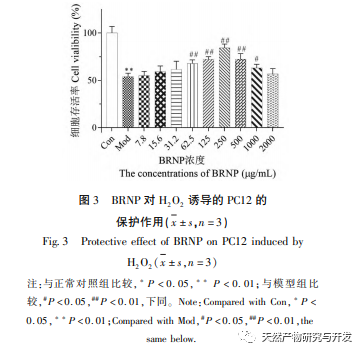

H2O2 ist ein reaktives Sauerstoffspezies-Molekül, das den Gehalt an intrazellulären reaktiven Sauerstoffspezies erhöhen und Zellen schädigen kann. Es wird häufig verwendet, um in kurzer Zeit Modelle der Zellalterung zu erhalten. Die Zellproliferationsaktivität ist ein wichtiger Indikator, um festzustellen, ob sich kultivierte Zellen unter bestimmten Bedingungen normal vermehren können. Die Ergebnisse des CCK-8-Experiments zeigten, dass die Überlebensrate von PC12-Zellen mit zunehmender H2O2-Konzentration deutlich abnahm und eine dosisabhängige Wirkung zeigte. Bei einer Behandlung mit 300 μ mol/L H2O2 für 4 Stunden betrug die Überlebensrate der Zellen 60,64%. Zu diesem Zeitpunkt waren die PC12-Zellen bis zu einem gewissen Grad geschädigt, hatten aber noch keinen irreversiblen Zustand erreicht. Daher wurde in den nachfolgenden Experimenten 300 μ mol/L als optimale Konzentration und Zeit für die oxidative Schädigung von PC12-Zellen für 4 Stunden gewählt.
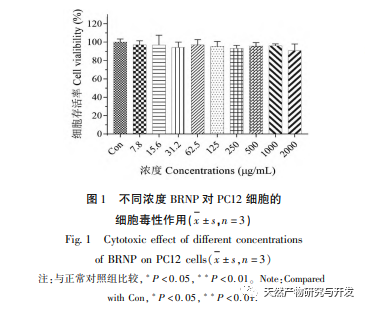
Um zu überprüfen, ob BRNP zytotoxische Wirkungen auf PC12-Zellen hat, wurde BRNP allein zur Behandlung von PC12-Zellen ohne H2O2-Schäden verwendet. Die experimentellen Ergebnisse zeigten, dass es keine signifikante Veränderung in der Überlebensrate von PC12-Zellen nach der Behandlung mit verschiedenen Konzentrationen (7,8-2000 μ g/mL) von BRNP gab (P>0,05), was darauf hindeutet, dass BRNP keine signifikante Zytotoxizität auf die Lebensfähigkeit von PC12-Zellen hatte. Bei der Untersuchung der Wirkung von BRNP auf H2O2-induzierte Schäden in PC12-Zellen zeigten die Ergebnisse, dass im Vergleich zur Modellgruppe die Zellüberlebensrate mit der Erhöhung der BRNP-Konzentration allmählich anstieg (P<0,05), und die Zellüberlebensrate signifikant zunahm, als die BRNP-Konzentration 250 μ g/mL erreichte. Basierend auf den experimentellen Ergebnissen hat BRNP eine gewisse schützende Wirkung auf H2O2-induzierte Schäden in PC12-Zellen.
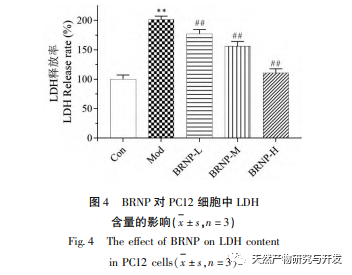
Laktatdehydrogenase (LDH) befindet sich in den Zellen und kann die Produktion von Laktat aus Pyruvat katalysieren. Wenn Zellen geschädigt werden, wird LDH in großen Mengen freigesetzt, was zu einem erheblichen Anstieg der extrazellulären LDH-Spiegel führt. Die Menge der freigesetzten LDH ist proportional zum Grad der Schädigung, so dass die LDH-Austrittsrate den Grad der Zellschädigung widerspiegeln kann. Die Ergebnisse dieses Experiments deuten darauf hin, dass BRNP den Grad der Zellmembranschädigung verhindern oder verlangsamen und die Freisetzung von intrazellulärer LDH verhindern kann.
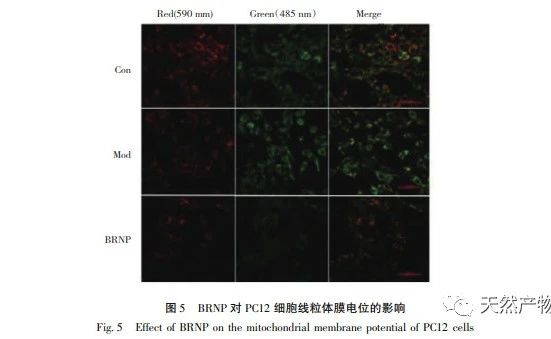
Die Protonenverteilung auf beiden Seiten der inneren Membran der Mitochondrien in der Zelle ist nicht einheitlich und bildet einen elektrochemischen Gradienten, der als mitochondriales Membranpotenzial bekannt ist. Zahlreiche Studien haben gezeigt, dass es zu einer Abnahme des mitochondrialen Membranpotenzials kommt, wenn ein Apoptose-auslösender Faktor die Zellapoptose stimuliert, und dass diese Abnahme des Membranpotenzials früher eintritt als Veränderungen der Zellmorphologie. Die signifikante Abnahme des mitochondrialen Membranpotenzials führt zur irreversiblen Apoptose von Zellen, daher kann die Abnahme des mitochondrialen Membranpotenzials als klassisches Phänomen in der Frühphase der Zellapoptose angesehen werden. Gegenwärtig hat die Forschung eine enge Beziehung zwischen mitochondrialer Dysfunktion und dem Alterungsprozess bestätigt. So kann beispielsweise eine unzureichende Versorgung mit mitochondrialer Energie (MMP und ATP) die Stoffwechselkapazität des Körpers verringern, was zu einer Reihe von Alterungsveränderungen führt. Unter anderem ist die Abnahme des mitochondrialen Membranpotenzials einer der spezifischen Marker für die Zellapoptose. Die Forschungsergebnisse zeigten, dass das mitochondriale Membranpotenzial von PC12-Zellen nach einer H2O2-Behandlung signifikant reduziert war und dass eine BRNP-Vorbehandlung die durch H2O2 verursachte Verringerung des Membranpotenzials verhindern konnte.
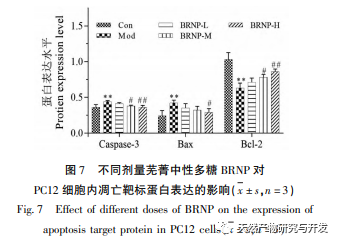
Apoptose ist ein programmierter Zelltodprozess, der sowohl exogene Fas/FasL-vermittelte Todesrezeptorwege als auch endogene mitochondriale und endoplasmatische Retikulum-Wege umfasst. Unter ihnen ist der durch Mitochondrien vermittelte endogene Apoptoseweg der wichtigste Weg für den programmierten Zelltod in Säugetierzellen. Bax, das für pro-apoptotische Proteine steht, und Bcl-2, das für anti-apoptotische Proteine steht, sind die wichtigsten Proteine, die die Freisetzung von mitochondrialen Apoptosefaktoren regulieren. Die Caspase-Protease ist ein Schlüsseleffektor der Apoptose bei Säugetieren, wobei Caspase-3 eine Schlüsselprotease der Caspase-Familie ist, die verschiedene apoptosestimulierende Faktoren aktiviert und als wichtiger Ausführer der Zellapoptose bekannt ist. BRNP reduziert die Expression von Caspase-3 in PC12-Zellen, die durch H2O2-Oxidation geschädigt wurden, bis zu einem gewissen Grad. Es kann vermutet werden, dass BRNP die Expression von Caspase-3 verringert, die Zellapoptose reduziert und somit die Alterung des Körpers verzögert. Nach der Behandlung mit BRNP stieg die Expression von Bcl-2 in PC12-Zellen mit oxidativen Schäden an, während die Expression von Bax und BRNP in unterschiedlichem Maße abnahm. Diese Forschungsergebnisse deuten darauf hin, dass BRNP die Zellen bei der Abwehr von Schäden an Mitochondrien und DNA durch oxidativen Stress unterstützt, zelluläre oxidative Schäden verringert und die Fähigkeit des Körpers zur Regulierung von antioxidativem Stress verbessert.
