Studie über die hemmende Wirkung von Lotusblatt-Alkaloid auf den Akt/mTOR/4EBP1-Glykolyse-Signalweg und seine antiproliferative Wirkung auf Cholangiokarzinomzellen
Das Cholangiokarzinom (CCA) wird je nach anatomischer Lage in das extrahepatische Cholangiokarzinom (extrahepatisches Cholangiokarzinom) und das intrahepatische Cholangiokarzinom (ICC) unterteilt. Obwohl das intrahepatische Cholangiokarzinom nur 10% bis 20% der primären Leberkarzinome ausmacht, ist es in den frühen Stadien sehr heimtückisch, hat eine hohe postoperative Rezidivrate und eine schlechte Prognose. In den letzten Jahrzehnten sind die Inzidenzrate und die Sterblichkeit von ICC in Asien und sogar weltweit stetig gestiegen. Die Erstlinien-Chemotherapie für fortgeschrittene ICC ist anfällig für Arzneimittelresistenz und unerwünschte Arzneimittelwirkungen nach Langzeitanwendung, so dass es notwendig ist, sichere und wirksame therapeutische Mittel zu erforschen.
Das Screening natürlicher medizinischer Wirkstoffe mit Anti-Tumor-Wirkung aus Pflanzen und Tieren ist seit jeher ein Forschungsschwerpunkt sowohl im Inland als auch international. Nuciferin (NUF) wird aus den getrockneten Blättern von Nelumbo nucifera Gaertn, einer Pflanze aus der Familie der Nymphaeaceae, gewonnen. Es hat eine gewisse antitumorale Aktivität, aber über seine Wirkung auf ICC-Zellen wird selten berichtet. In dieser Studie wurden die Auswirkungen des Lotusblatt-Alkaloids auf die Proliferation und den Glykolyseprozess von HuCCT1-Zellen untersucht und sein Wirkmechanismus vorläufig erforscht, was eine theoretische Grundlage für die Entwicklung sicherer und wirksamer therapeutischer Mittel gegen ICC darstellt.
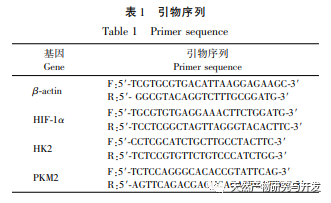
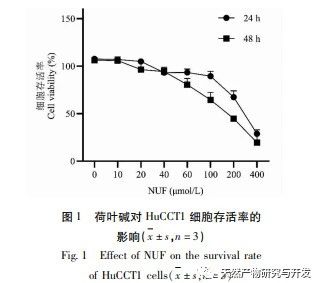
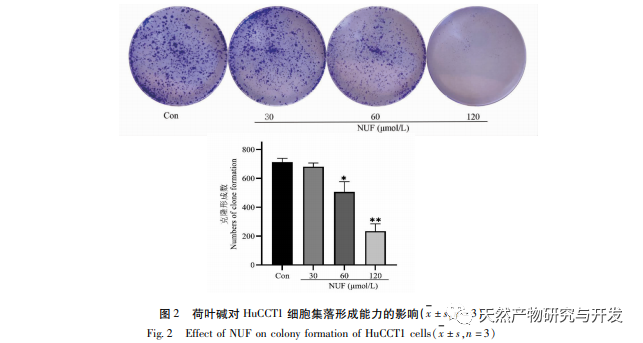
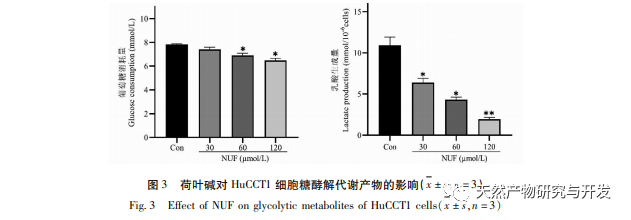
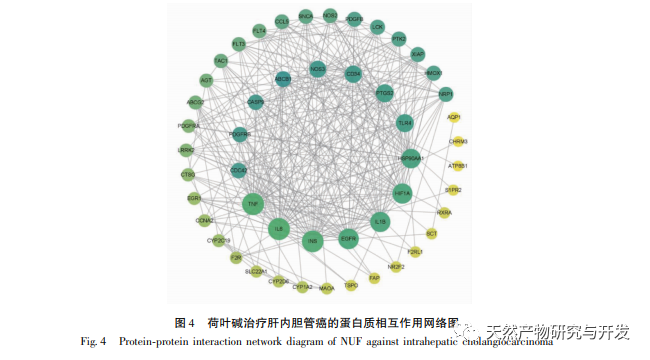
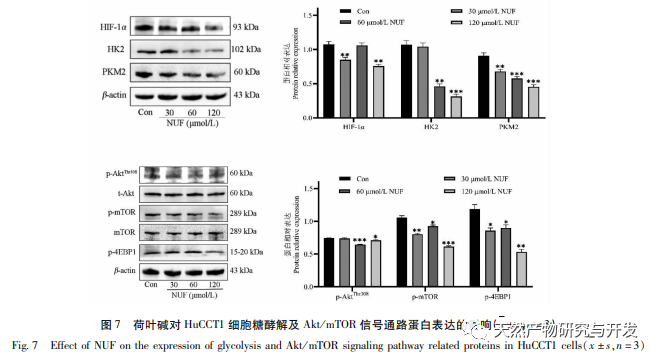
Die moderne pharmakologische Forschung zeigt, dass die aktive Komponente des Lotusblatt-Alkaloids, das aus dem Lotusblatt extrahiert wird, eine gewisse wachstumshemmende Wirkung auf viele Tumorzellen hat, wie z. B. Leber-, Lungen- und Brustkrebs, und ihre Empfindlichkeit gegenüber Chemotherapeutika verbessern kann. In dieser Studie wurde festgestellt, dass eine bestimmte Konzentration von Lotosblattalkaloid die Proliferation von HuCCT1-Zellen in vitro deutlich hemmen kann und positiv mit der Verringerung des Glukoseverbrauchs und der Laktatproduktion korreliert ist. Kohlenhydrate sind wichtige Energiequellen für zelluläre Lebensvorgänge, und der Warburg-Effekt deutet darauf hin, dass Krebszellen selbst unter normalen Sauerstoffbedingungen Energie vorzugsweise über die Glykolyse und nicht über aerobe Stoffwechselwege bereitstellen. Ein hohes Maß an Glykolyse kann schnelle Energie für das Wachstum von Krebszellen liefern, und ihre Produkte wie Brenztraubensäure und Milchsäure liefern auch Rohstoffe für die Synthese von Krebszellstoffen und fördern die Metastasierung und Invasion von Krebszellen. Daher wird spekuliert, dass die Hemmung der HuCCT1-Zellproliferation durch Lotosblattalkaloide mit ihrer Hemmung des zellulären Glykolyse-Stoffwechsels zusammenhängt.
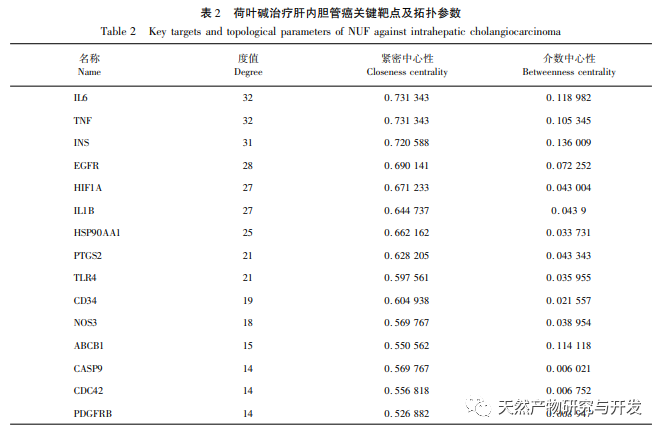
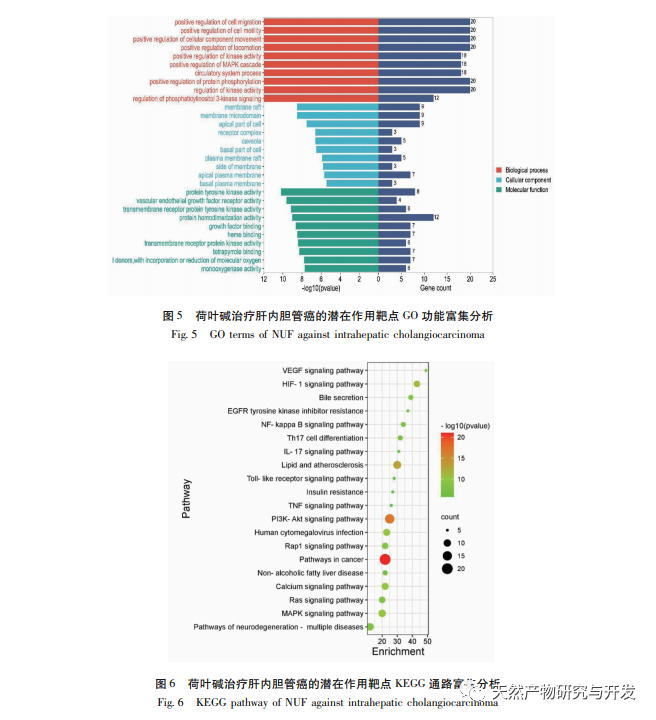
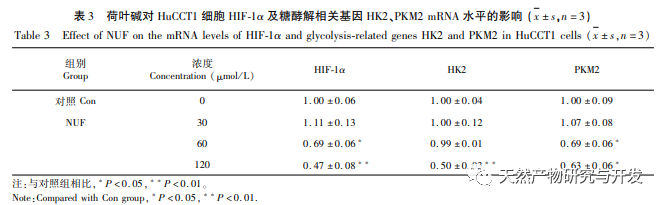
Eine pharmakologische Netzwerkanalyse ergab eine hohe Korrelation zwischen Matrin und HIF-1 α sowie Zielen wie TNF, INS, EGFR usw. HIF-1 α ist an zahlreichen Prozessen wie Glukosestoffwechsel, Zellproliferation, Invasion und Metastasierung sowie Entzündungsreaktion in Tumorzellen beteiligt. Es kann die Aktivität von Glukosetransportern (GLUT) und verschiedenen glykolytischen Enzymen wie HK2, PKM2 und Pyruvat-Dehydrogenase-Kinase 1 (PDK1) aktivieren und ist direkt am Glykolyseprozess beteiligt, was die Tumorprogression erheblich fördert. Hexokinase (HK) und Pyruvatkinase (PK) sind zwei Schlüsselkinasen im Prozess der Glykolyse und regulieren die Anfangs- bzw. Endphase des Prozesses. In dieser Studie wurde festgestellt, dass die mRNA-Spiegel und die Proteinexpression von HIF-1 α und den glykolytischen Schlüsselenzymen HK2 und PKM2 in den Zellen mit der Erhöhung der Lotosblattalkaloidkonzentration allmählich abnahmen. Daher wird spekuliert, dass Lotusblattalkaloid den Glykolyseprozess von HuCCT1-Zellen beeinflussen kann, indem es die Aktivität von HIF-1 α reduziert.
HIF-1 ist eine Art Transkriptionsfaktor, auf den Zellen in sauerstoffarmen oder hypoxischen Umgebungen reagieren und der aus zwei Untereinheiten besteht: HIF-1 α und HIF-1 β. Der Prolin-Rest von HIF-1 α ist unter normoxischen Bedingungen anfällig für Hydroxylierung und bindet an sein Abstimmungsmolekül (von Hippel Lindau, pVHL), das dann durch Ubiquitinierung abgebaut wird. In einer sauerstoffarmen Umgebung nimmt die Aktivität der Prolylhydroxylase-Domäne enthaltenden Proteine (PHD) ab, was zu einer erheblichen Anhäufung von HIF-1 α führt, das dann in den Zellkern wandert, um ein Dimer mit HIF-1 β zu bilden. Das Dimer bindet dann an das Hypoxic Response Element (HRE), um die Transkription von HIF-1 Zielgenen zu fördern. Darüber hinaus kann HIF-1 α auch auf sauerstoffunabhängige Weise aktiviert werden, z. B. kann die PI3K/Akt/mTOR-Signalkaskade die Transkription und Translation von HIF-1 α hochregulieren, indem sie die Integrität des eukaryotischen Translationsinitiationsfaktors 4E (eIF4E)-Bindungsproteins 1 (4EBP1) stört. Einige Wissenschaftler bezeichnen den Aktivierungsmechanismus dieses sauerstoffunabhängigen HIF-1 α-Signals als "Pseudo-Hypoxie". In dieser Studie ergab die KEGG-Analyse, dass Matrin auf die potenziellen Signalwege von ICC einwirkt, wobei der PI3K/Akt-Signalweg signifikant anstieg. Immunoblotting ergab, dass Matrin die Phosphorylierungsniveaus von mTOR- und 4EBP1-Proteinen in HuCCT1-Zellen verringern kann, und das gesamte p-AktTrr308-Protein zeigte eine abnehmende Tendenz, was darauf hindeutet, dass die Herabregulierung der HIF-1 α-Transkriptions- und Translationsniveaus durch Matrin mit der Hemmung des Akt/mTOR/4EBP1-Signalwegs zusammenhängen könnte.
Mehrere Studien haben gezeigt, dass Lotusblattalkaloide nicht nur die Apoptose von Tumorzellen in vitro auslösen, die Invasion und Metastasierung hemmen und sie in verschiedenen Zyklen blockieren, sondern auch das Wachstum von ektopisch transplantierten Tumoren in Nacktmäusen verzögern und signifikante Anti-Tumoreffekte ausüben können. Der Hauptmechanismus steht im Zusammenhang mit der Regulierung des Zellzyklus und der Apoptose-bezogenen Proteinexpression durch Lotusblattalkaloide, der direkten Ausrichtung auf spezifische Gene und der Hemmung von Signalwegen wie PI3K Akt, Wnt/β-Catenin, SOX2 Akt, STAT3 und TLR4/NF-κ B. In dieser Studie wurde vorläufig festgestellt, dass Lotosblattalkaloide die Proliferation von intrahepatischen Cholangiokarzinomzellen hemmen, möglicherweise durch Unterdrückung des zellulären Glykolyseprozesses, der durch den Akt/mTOR/4EBP1-Signalweg reguliert wird. Die intrinsische logische Beziehung zwischen den beiden wird im nächsten Forschungsschritt erforscht, um den Anti-ICC-Mechanismus der Lotusblattalkaloide aufzuklären und eine theoretische Grundlage für die tiefgreifende Entwicklung von Lotusblattressourcen und klinischen Anwendungen zu schaffen.
