Welche schützende Wirkung hat Erythrit auf das Vitamin C in Limonadengetränken?
Das in Fruchtsäften enthaltene Vitamin C ist einer der wichtigsten Nährstoffe, die der menschliche Körper im täglichen Leben benötigt. Aufgrund seiner Instabilität ist es jedoch leicht dem Einfluss von Lagerungsbedingungen wie Temperatur, Licht und dem internen PH-Wert des Fruchtsafts sowie anderen Bedingungen ausgesetzt, was zu einer Oxidationsreaktion führt und eine große Anzahl freier Radikale erzeugt, was wiederum zu einem oxidativen Abbau von Vitamin C führt.
Erythrit als neuartiger natürlicher Süßstoff, der in den letzten Jahren gefördert wurde, ist in der Getränke- und Süßwarenindustrie weit verbreitet, da er rein süß ist und keinen unangenehmen bitteren Nachgeschmack hat, kalorienarm ist, gut vertragen wird und keine durch den Stoffwechsel im Körper verursachten Blutzuckerschwankungen aufweist.
Gleichzeitig haben Forscher herausgefunden, dass Erythrit auch als Antioxidans verwendet werden kann, das freie Radikale wirksam beseitigen und ihre Entstehung hemmen kann. Gegenwärtig konzentriert sich die in- und ausländische Forschung zu Erythrit in Getränken hauptsächlich auf seine Anwendung als eine neue Art von Süßstoff. In diesem Beitrag wird am Beispiel von Zitronensaft die schützende Wirkung von Erythrit auf das Vitamin C in Zitronensaft am Morgen untersucht.
Kinetik des thermischen Abbaus von Vitamin C in Zitronensaft
Kinetische Untersuchung der thermischen Zersetzung
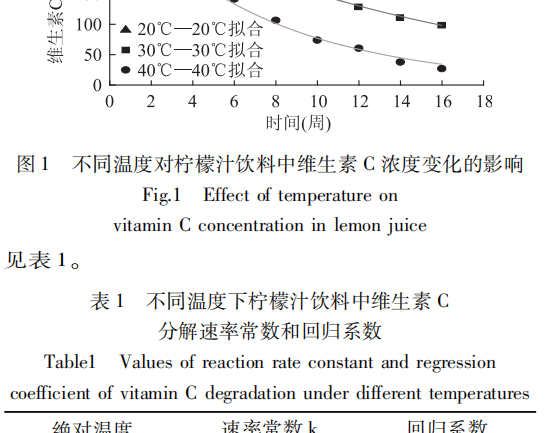
Die Tendenzen des Vitamin-C-Gehalts in Zitronensaftgetränken mit der Zeit bei verschiedenen Temperaturen wurden durch experimentelle Bestimmung ermittelt und angepasst, und die Anpassungsergebnisse sind in Abb. 1 dargestellt.
Aus Abb. 1 ist ersichtlich, dass der Vitamin-C-Gehalt mit zunehmender Lagerdauer des Zitronensaftgetränks allmählich abnahm und seine Zersetzungsgeschwindigkeit mit steigender Temperatur beschleunigt wurde. Die Konservierungsrate von Vitamin C betrug 60,82%, 31,98 und 8,48% bei 16 Wochen Lagerung unter den Umgebungsbedingungen von 20, 30 bzw. 40°C.
Die Anpassungsergebnisse zeigten, dass die Zersetzung von Vitamin C in Zitronensaftgetränken bei verschiedenen Temperaturen durch ein zusammengesetztes reaktionskinetisches Modell erster Ordnung modelliert wurde, d. h:
Die Zersetzungsgeschwindigkeitskonstante k von Vitamin C bei verschiedenen Temperaturen wurde anhand der Gleichung (1) aus den experimentellen Daten berechnet und durch lineare Regression analysiert, die durch gleichzeitiges Bilden des Logarithmus der linken und rechten Seite der Arrhenius-Gleichung erhalten wurde:
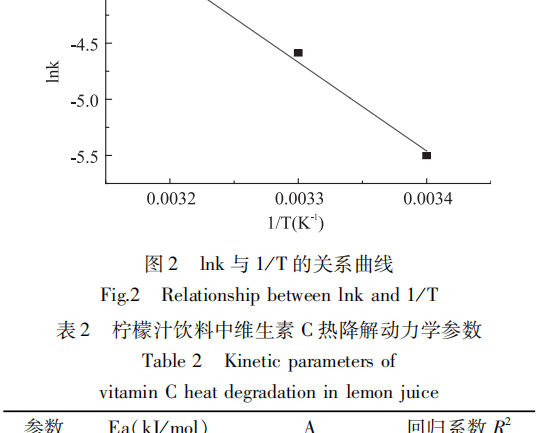
Gemäß der obigen Gleichung (2) wurde die logarithmische Ink der Geschwindigkeitskonstante der Vitamin-C-Primärreaktion gegen das inverse 1/T der Lagertemperatur aufgetragen, wie in Abb. 2 gezeigt, und die Aktivierungsenergie Ea und der Finger-Forward-Faktor A wurden aus der Steigung bzw. dem Achsenabschnitt der Geraden ermittelt; die Ergebnisse sind in Tabelle 2 dargestellt.
Üblicherweise wird davon ausgegangen, dass die Aktivierungsenergie Ea einer chemischen Reaktion 40-400kJ/mol beträgt, und je kleiner die Aktivierungsenergie Ea ist, desto leichter läuft die Reaktion ab. Wenn Ea 400kJ/mol ist, ist die Reaktionsgeschwindigkeit sehr klein. Aus Tabelle 2 geht hervor, dass das Vitamin C des Zitronensaftgetränks während der Lagerung leicht abgebaut werden kann.
Die Wirkung von Erythrit auf Vitamin C
Wirkung von Erythrit auf die Abbaugeschwindigkeit von Vitamin C
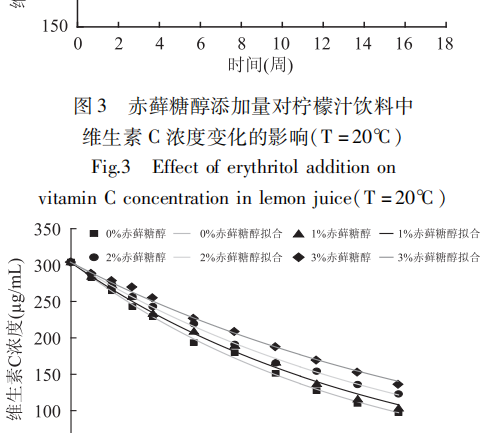
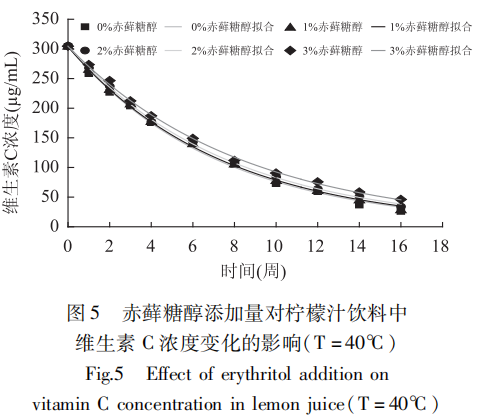
Die Auswirkungen verschiedener Erythrit-Zusätze auf den Vitamin-C-Gehalt von Zitronensaftgetränken wurden bei konstanter Temperatur experimentell bestimmt und an den Trend angepasst; die Ergebnisse sind in den Abbildungen 3-5 dargestellt.
Die Anpassungsergebnisse zeigten, dass die Abbaugeschwindigkeit von Vitamin C in Zitronensaftgetränken mit der Zeit unter den oben genannten Bedingungen dem reaktionskinetischen Modell erster Ordnung entsprach. Aus Abbildung 3 bis Abbildung 5 ist ersichtlich, dass sich die Abbaugeschwindigkeit von Vitamin C mit zunehmender Zugabe von Erythrit bei konstanter Temperatur verlangsamte und die Retentionsraten von Vitamin C nach 16 Wochen Lagerung im Vergleich zur Kontrolle (keine Zugabe) in unterschiedlichem Maße zunahmen.
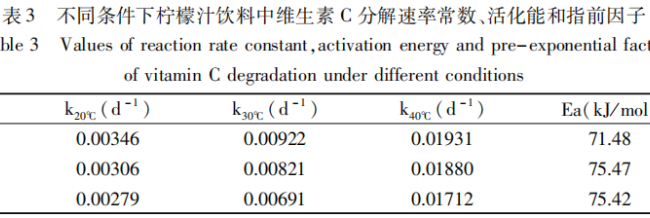
Anhand der oben genannten experimentellen Daten wurden die Zersetzungsgeschwindigkeitskonstanten k und die entsprechende Aktivierungsenergie Ea und der Finger-Forward-Faktor A von Vitamin C unter verschiedenen Bedingungen mit Hilfe von Gleichung (1) und Gleichung (2) berechnet, und die Ergebnisse sind in Tabelle 2 dargestellt.
Wie aus Tabelle 2 hervorgeht, waren die Aktivierungsenergien der Vitamin-C-Abbaureaktion im Zitronensaftgetränk nach dem Zusatz von Erythrit höher als die der Proben ohne Erythrit-Zusatz (65,68% kJ/mol), so dass die Abbaureaktion von Vitamin C im Vergleich zu der der Kontrollgruppe nur schwer durchzuführen war und die Aktivierungsenergien grundsätzlich einen steigenden Trend mit der Erhöhung der Konzentration des zugesetzten Erythrits zeigten.
Unter ihnen, wenn die Konzentration von Erythrit war 2%, die Aktivierungsenergie von Vitamin C Abbau erreichte ein Maximum von 75,47 kJ / mol, das war 9,79 kJ / mol höher als die der Kontrolle, jedoch mit der Erhöhung der Konzentration von Erythrit, die Aktivierungsenergie der Reaktion war im Grunde unverändert.
Zusammenfassend lässt sich sagen, dass der Zusatz von Erythrit zu Zitronensaftgetränken tatsächlich eine gewisse Rolle beim Schutz von Vitamin C spielen kann.