Studie über die verbessernde Wirkung von Chuanxuduan-Saponin VI auf die Neurogenese und die kognitive Funktion bei Mäusen mit Schlafentzug
Schlafentzug (SD) bezieht sich auf einen Zustand des teilweisen oder vollständigen Verlusts des normalen Schlafs, der durch verschiedene Gründe verursacht wird und in der heutigen Gesellschaft weit verbreitet ist. Langfristiger Schlafentzug kann zu Funktionsstörungen im Körper führen und neurokognitive Dysfunktionen verursachen. Die Forschung hat bestätigt, dass Schlafentzug die Mikroglia im zentralen Nervensystem aktiviert und sie zur Freisetzung neurotoxischer Moleküle veranlasst. Aktivierte Mikroglia beeinflussen die kognitive Funktion durch Mechanismen wie die Neurogenese im Hippocampus und die synaptische Plastizität. Schlafentzug hat schwerwiegende Auswirkungen auf die körperliche und geistige Gesundheit der Menschen und ist ein soziales Problem der öffentlichen Gesundheit, das nicht ignoriert werden kann. Die Entwicklung wirksamer Medikamente zur Intervention birgt großes Potenzial.
Asprosaponin VI (ASA VI) ist ein Triterpensaponin, das aus der traditionellen chinesischen Medizin Dipsaci Radix isoliert wurde und gute osteoporosehemmende, entzündungshemmende und neuroprotektive Wirkungen hat. Frühere Studien haben ergeben, dass ASAVI die Blut-Hirn-Schranke wirksam durchdringen, die Funktion der Mikroglia regulieren, die Proliferation und Differenzierung neuraler Stammzellen fördern und eine gute pharmakologische Aktivität bei Studien zur Bekämpfung von Depressionen und Demenz zeigen kann. In dieser Studie wurde die verbessernde Wirkung von ASA VI auf die kognitiven Funktionen von Mäusen mit Schlafentzug untersucht und der Wirkmechanismus weiter erforscht, was eine Grundlage für die Entwicklung entsprechender Interventionsmedikamente darstellt.
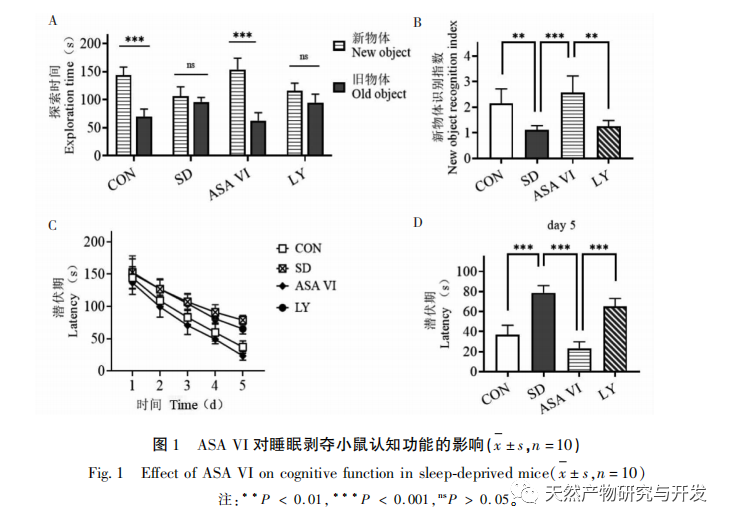
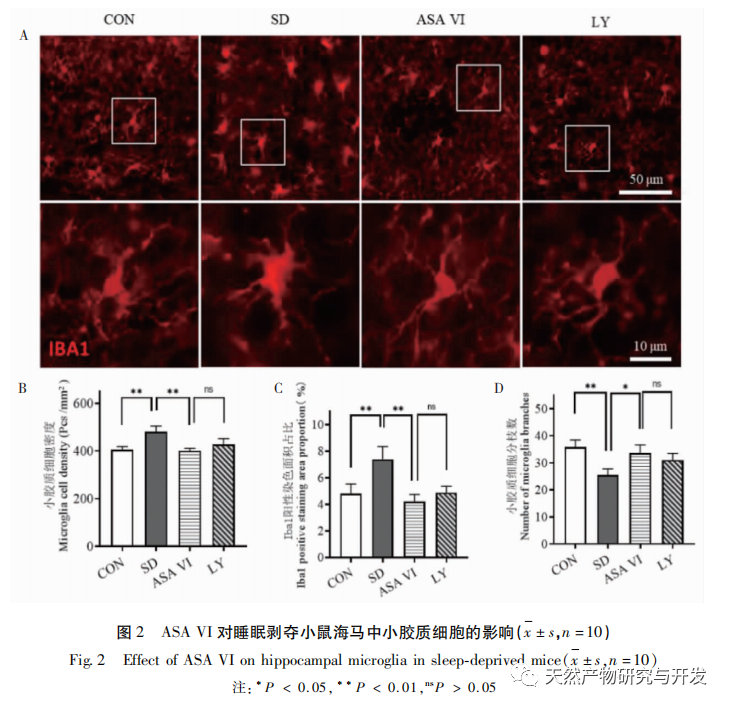
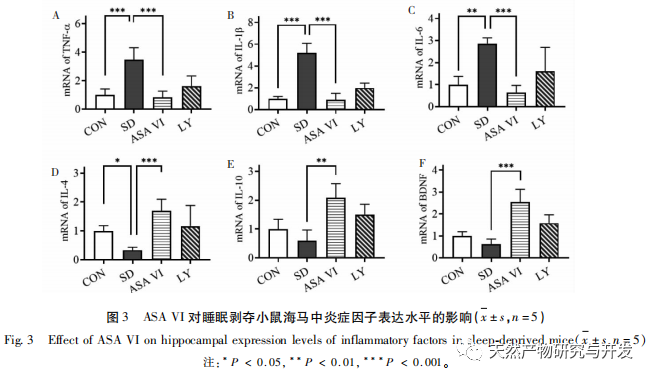
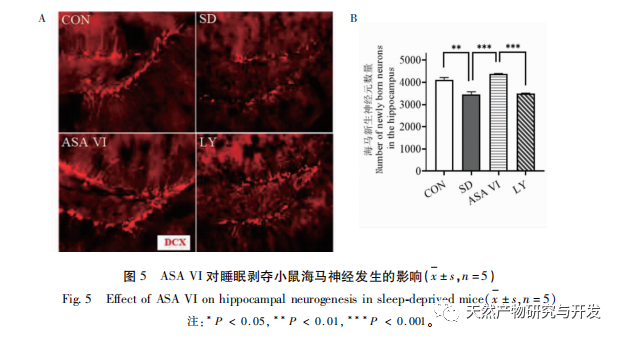
Schlafentzug kann weitreichende und tiefgreifende Auswirkungen auf das kognitive Verhalten haben und ist eng mit dem Auftreten verschiedener Krankheiten verbunden. In dieser Studie wurde festgestellt, dass Schlafentzug das Kurzzeitgedächtnis sowie die räumlichen Lern- und Gedächtnisfähigkeiten von Mäusen erheblich beeinträchtigt, die Zahl der Mikroglia erhöht, die Expressionsstärke von Entzündungsfaktoren steigert und die Neurogenese im Hippocampus von Erwachsenen hemmt. Die Intervention des natürlichen Wirkstoffs ASA VI verbesserte signifikant die kognitive Funktion von Mäusen mit Schlafentzug, während die Expression der pro-inflammatorischen Zytokine IL-1 β, TNF - α und IL-6 im Hippocampus gehemmt, die Expressionsniveaus der anti-inflammatorischen Zytokine IL-4, IL-10 und des neurotrophen Faktors BDNF erhöht und die Neurogenese im Hippocampus gefördert wurde. Dies deutet darauf hin, dass ASA VI als entzündungshemmendes und neuroprotektives Medikament das Lernen und Gedächtnis von Mäusen mit Schlafentzug verbessert.
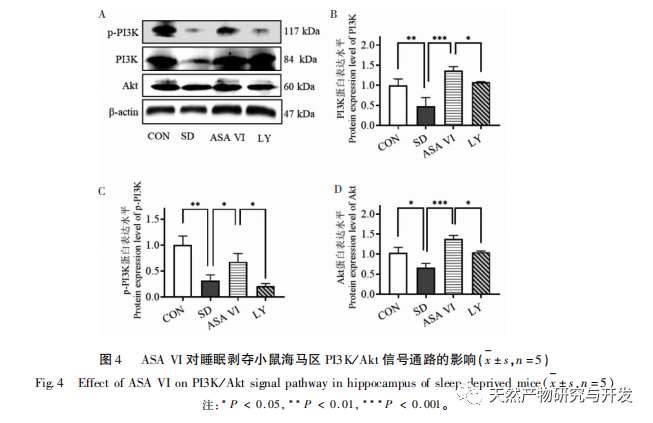
Mikroglia sind eine Art von sehr heterogenen Immunzellen, die nicht aus dem zentralen Nervensystem stammen. Sie spielen eine wichtige Rolle bei der Immunüberwachung und der Aufrechterhaltung der Homöostase in der inneren Umgebung. Wenn sie stimuliert werden, verkürzen Mikroglia ihre Verzweigungen, erweitern ihre Zellkörper und versetzen sich in einen Zustand der Immunabwehr, wobei sie eine große Menge entzündungsfördernder Zytokine freisetzen. In dieser Studie wurde festgestellt, dass Schlafentzug eine übermäßige Aktivierung der Mikroglia im Hippocampus auslösen kann, wodurch die Überexpression der pro-inflammatorischen Zytokine IL-1 β, TNF - α und IL-6 erhöht wird. Bei fortgesetztem Schlafentzug können diese Entzündungsfaktoren zu einer chronischen Neuroinflammation führen und chronische Schäden an Neuronen, Astrozyten, Oligodendrozyten und anderen Gehirnzellen verursachen, was letztlich zu kognitiven Funktionsstörungen bei Mäusen führt. Die Intervention mit ASA VI kann die durch Schlafentzug verursachte Zunahme der Anzahl und Oberfläche der Mikroglia im Hippocampus von Mäusen verbessern und die Anzahl der Verzweigungen erhöhen. Während die Sekretion entzündungsfördernder Moleküle reduziert wird, wird gleichzeitig die Expression entzündungshemmender Moleküle und neurotropher Faktoren erhöht. Diese Ergebnisse deuten darauf hin, dass der mögliche Mechanismus, durch den ASA VI die kognitive Funktion von Mäusen mit Schlafentzug verbessert, in der Umwandlung des pro-inflammatorischen Phänotyps der Mikroglia in einen neuroprotektiven Phänotyp besteht. Diese Mikroglia des neuroprotektiven Phänotyps schütten nicht nur entzündungshemmende Zytokine aus, um die Neuroinflammation zu unterdrücken, sondern auch neurotrophe Faktoren, um geschädigtes Gewebe zu reparieren und neuroprotektive Funktionen auszuüben. Die Ergebnisse dieser Studie zeigen, dass die Behandlung mit dem Inhibitor LY294002 im Vergleich zur ASA-VI-Interventionsgruppe keinen signifikanten Einfluss auf die Morphologie und Quantität der Mikroglia sowie auf die Expression von Entzündungsfaktoren und neurotrophen Faktoren hatte, was darauf hindeutet, dass ASA VI im Hippocampus von Mäusen mit Schlafentzug den Phänotyp der Mikroglia unabhängig vom PI3K/Akt-Signalweg reguliert. Obwohl es keinen signifikanten Unterschied in der Expression von Entzündungsfaktoren im Hippocampus zwischen der LY294002-Gruppe und der ASA-VI-Gruppe gab, verringerte die Behandlung mit LY294002 die Expressionsniveaus der entzündungshemmenden Zytokine IL-4, IL-10 und des neurotrophen Faktors BDNF bis zu einem gewissen Grad, während die Expressionsniveaus der pro-inflammatorischen Zytokine IL-1 β, TNF - α und IL-6 bis zu einem gewissen Grad erhöht waren. Lin Jianan et al. berichteten, dass Ginsenosid CK die durch Mikroglia vermittelte Entzündung über den PI3K/AKT-Signalweg hemmt. Diese Ergebnisse legen nahe, dass der PI3K/Akt-Signalweg an der Regulierung der durch Mikroglia vermittelten Neuroinflammation beteiligt sein könnte, und seine Rolle bei der durch ASA VI vermittelten Entzündung des Hippocampus bei Mäusen mit Schlafentzug muss weiter untersucht werden.
Die Neurogenese des erwachsenen Hippocampus spielt eine wichtige Rolle bei der Plastizität des Gehirns und der Aufrechterhaltung des neuronalen Netzes, und Funktionsstörungen des Hippocampus können zu verschiedenen menschlichen Krankheiten führen, darunter Depressionen, Angstzustände, kognitive Beeinträchtigungen und neurodegenerative Erkrankungen. Wenn im Gehirn eine Entzündung auftritt, werden die wichtigsten Neuroimmunzellen des Gehirns - die Mikroglia - überaktiviert und setzen Entzündungsmediatoren und neurotoxische Moleküle frei, die die Neurogenese im erwachsenen Hippocampus erheblich hemmen, was zu einem erhöhten Risiko für emotionale Störungen und kognitive Dysfunktion führt. Die neu gebildeten Neuronen im Hippocampus von Nagetieren stammen hauptsächlich aus dem subgranulären Bereich (SGZ) des Gyrus dentatus, der eine wichtige Rolle bei der Bildung und Konsolidierung des Gedächtnisses spielt. Die Forschung hat gezeigt, dass neuroinflammatorische Moleküle, die von Mikroglia freigesetzt werden, die Neurogenese im erwachsenen Hippocampus durch Hemmung des PI3K/Akt-Signalwegs beeinflussen können. In dieser Studie wurde festgestellt, dass der PI3K/Akt-Signalweg und die Zahl der neuen Neuronen im Hippocampus von Mäusen mit Schlafentzug signifikant gehemmt waren. Die ASA VI-Intervention aktivierte den PI3K/Akt-Signalweg im Hippocampus von Mäusen mit Schlafentzug und förderte die Neurogenese im erwachsenen Hippocampus. Nach der Blockierung des PI3K/Akt-Signalwegs mit LY294002 nahm die Zahl der neu gebildeten Neuronen im Hippocampus deutlich ab, und die verbessernde Wirkung von ASA VI auf die kognitive Funktion bei Mäusen mit Schlafentzug wurde durch LY294002 aufgehoben. Liu et al. berichteten, dass ASA VI die Proliferation und das Überleben neuraler Stammzellen durch Aktivierung des PI3K/AKT-Signalwegs fördern kann und ihre Differenzierung in Neuronen begünstigt, was die neuralen Stammzellen vor den Auswirkungen der Neuroinflammation schützt und dadurch die Neurogenese im Hippocampus, das depressionsähnliche Verhalten, das angstähnliche Verhalten und die kognitive Dysfunktion in Mäusen mit chronischer Neuroinflammation verbessert. Diese Ergebnisse deuten darauf hin, dass die verbessernde Wirkung von ASA VI auf die kognitive Funktion bei Mäusen mit Schlafentzug vom PI3K/Akt-Signalweg abhängt, der die Neurogenese vermittelt.
Zusammenfassend wurde in dieser Studie festgestellt, dass ASA VI die Neurogenese im erwachsenen Hippocampus fördert, indem es den Phänotyp der Mikroglia im Hippocampus reguliert, die BDNF-Expression erhöht und den PI3K/Akt-Signalweg aktiviert, wodurch sich die kognitive Funktion bei Mäusen mit Schlafentzug verbessert. ASA VI hat potenzielle Entwicklungsperspektiven als entzündungshemmendes und neuroprotektives Medikament.
