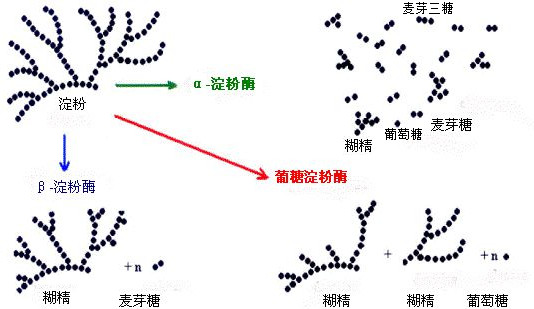
Nach der Rolle der α-Amylase, β-Amylase und Verzuckerung Amylase Diagramm ist leicht zu lassen Menschen fälschlicherweise denken, dass die Rolle der drei Substrate müssen Stärke, Dextrin und Maltose, bzw., gibt es Kinder einmal fragte mich Verzuckerung Amylase ist nicht Maltose Enzym. Daher denke ich, dass es notwendig ist, eine kleine Analyse der Rolle der drei zu machen.
Um das Verständnis der Rolle der verschiedenen Amylasenarten zu erleichtern, müssen zunächst zwei Begriffspaare festgelegt werden: geradkettige und verzweigte Stärke sowie α-1,4-glykosidische und α-1,6-glykosidische Bindungen.
Es gibt zwei Arten von Stärke: geradkettige Stärke und verzweigtkettige Stärke. Geradkettiges Amylopektin ist eine unverzweigte, schraubenförmige Struktur, die aus Glukoseresten besteht, die nur durch α-1,4-glykosidische Bindungen von Kopf bis Fuß miteinander verbunden sind; verzweigtkettiges Amylopektin besteht aus Glukoseresten, die durch α-1,4-glykosidische Bindungen von Kopf bis Fuß in jeder Kette verbunden sind, aber α-1,6-glykosidische Bindungen an den Verzweigungen.
α-Amylase und ihre Rolle
α-Amylase, auch Endo-Amylase genannt, ist eine Metallohydrolase, die Kalziumionen benötigt, die sich an das Enzymprotein binden, um ihre Aktivität zu entfalten, die durch Behandlung mit dem Chelatbildner EDTA verloren gehen kann.
α-Amylase kann die α-1,4-glykosidische Bindung in Stärke zufällig hydrolysieren, nicht aber die α-1,6-glykosidische Bindung.
Handelt es sich bei dem Substrat um geradkettige Stärke, entstehen bei der Hydrolyse Glucose, Maltose und Maltotriose; handelt es sich bei dem wirkenden Substrat um verzweigtkettige Stärke, sind die Hydrolyseprodukte Glucose, Maltose, Maltotriose und α-Dextrin mit α-1,6-glykosidischen Bindungen, die mehr als drei Glucosereste enthalten.
Es sollte auch beachtet werden, dass das α und β in α-Amylase und β-Amylase keine Konformationsbeziehung anzeigen, sondern einfach nummeriert sind.
Es gibt verschiedene Möglichkeiten, α-Amylase in der Natur zu produzieren, und die mikrobielle Fermentation ist zum Beispiel eine der gängigsten Methoden. Darüber hinaus kann dieses Enzym auch aus Pflanzen oder Tieren gewonnen werden, und die Eigenschaften der auf verschiedenen Wegen gewonnenen Amylase sind unterschiedlich. In der industriellen Produktion wird α-Amylase aufgrund des großen Bedarfs in der Regel durch Fermentation aus Pilzen und Bakterien gewonnen. Bacillus subtilis, Bacillus sphaericus und Streptomyces sphaericus können α-Amylase herstellen.
β-Amylase und ihre Funktion
Die β-Amylase, auch Exoamylase genannt, ist eine Hydrolase mit Sulfhydrylgruppen. Das Enzym geht vom nicht reduzierenden Ende der Stärke aus und hydrolysiert die α-1,4-glykosidische Bindung nacheinander mit zwei Glukoseresten, um Maltose zu erzeugen, die die α-1,6-glykosidische Bindung nicht hydrolysieren kann und auch nicht den Verzweigungspunkt überqueren kann, so dass ein sehr langes Dextrin, d. h. β-Dextrin, übrig bleibt.
Wenn β-Amylase also auf geradkettige Stärken einwirkt, produziert sie fast ausschließlich Maltose; wenn sie auf verzweigtkettige Stärken einwirkt, sind die Produkte Maltose und β-Dextrin.
R-Enzym und seine Wirkung
R-Enzyme, auch Debranching-Enzyme genannt, wirken auf die α-1,6-glykosidische Bindung ein. In Gegenwart von Debranching-Enzymen wird die α-1,6-glykosidische Bindung der α-Dextrin- und β-Dextrinarten hydrolysiert, und die verzweigten Ketten werden entfernt.
Die verbleibenden geraden Ketten werden dann durch α-Amylase und β-Amylase hydrolysiert, um Maltose und Glucose zu erzeugen. R-Amylasen können jedoch die α-1,6-glykosidischen Bindungen in verzweigten Stärken nicht direkt hydrolysieren.
Glykosylierende Amylase und ihre Wirkung
Glykosylierende Amylase oder Glukoamylase ist ein Enzym, das Stärke zu Glukose hydrolysiert, wobei der Prozentsatz der Hydrolyse bis zu 100% betragen kann, und wird häufig als Verzuckerungsmittel für Stärke verwendet. Glucoamylase ist nicht sehr spezifisch und kann für viele Stoffe eingesetzt werden. Sie kann nicht nur die α-1,4-Glykosidbindung am nicht reduzierenden Ende des Stärkemoleküls spalten, sondern auch die α-1,6-Glykosidbindung, nur dass die Hydrolyse der α-1,4-Glykosidbindung etwas schneller erfolgt. Sie kann auch Hydrolyse von Dextrin, Maltose und Glykogen. Die Hydrolyse wird vom Ende des Substratmoleküls aus eingeleitet und ist eine Exonuklease.
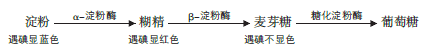
Die Ergebnisse der Wirkung von α-Amylase, β-Amylase und glykosylierter Amylase auf verzweigtkettige Stärke können in dem folgenden Diagramm dargestellt werden: