Der Mechanismus, mit dem Kaempferol die Apoptose dreifach negativer Brustkrebszellen über den mitochondrialen Apoptoseweg auslöst
Das dreifach negative Mammakarzinom (TNBC), ein spezieller Subtyp von Brustkrebs, macht 15%~20% der Gesamtzahl der Brustkrebsfälle aus. Seine klinischen Merkmale sind kurze Gesamtüberlebenszeit, hohe Bösartigkeit, starke Invasion, hohe frühe Rezidivrate usw. Nach dem Auftreten von Metastasen beträgt die mediane Überlebenszeit der Patientinnen nur 10 bis 13 Monate. Da TNBC auf endokrine und zielgerichtete Therapien nicht anspricht, ist die Chemotherapie die wichtigste Behandlungsmethode. Arzneimittelresistenz und behandlungsbedingte Nebenwirkungen geben jedoch nach wie vor Anlass zur Sorge. In den letzten Jahren wurde die Rolle der traditionellen chinesischen Medizin bei der Vorbeugung und Behandlung von TNBC aufgrund ihres einzigartigen theoretischen Systems und ihrer Erfahrung mit individuellen Behandlungsplänen zunehmend geschätzt. Unsere Forschungsgruppe hat herausgefunden, dass der Zusatz und die Reduktion von Chaihu Guizhi Decoction in Kombination mit Capecitabin das Wachstum von subkutan transplantierten Tumoren von dreifach negativem Brustkrebs in Nacktmäusen hemmen kann. Eine weitere Analyse mit Hilfe der Methode der Netzwerkpharmakologie zeigte, dass Kaempferol (KA) ein wichtiger wirksamer Bestandteil des Zusatzes und der Reduktion von Chaihu Guizhi Decoction ist, was uns eine experimentelle Grundlage für die Verwendung von Kaempferol zur Behandlung von dreifach negativem Brustkrebs bietet.
Kaempferol ist eine Flavonoidverbindung, die in Gemüse, Obst und der traditionellen chinesischen Medizin weit verbreitet ist. Es hat verschiedene Wirkungen wie krebshemmend, entzündungshemmend, antioxidativ und antiviral. Es kann die Vermehrung und Invasion von Tumorzellen hemmen, indem es die Apoptose der Zellen auslöst, den Zellzyklus reguliert, die Angiogenese und die Metastasierung von Tumoren hemmt. Die Forschung hat herausgefunden, dass KA durch die Aktivierung von MEK-MAPK eine Wachstumshemmung und Apoptose bei Lungenkrebszellen bewirkt. In vitro und in vivo hemmt KA die AKT/PI3K- und ERK-Signalwege, aktiviert den mitochondrialen Apoptoseweg und steigert die Strahlentötung von Lungenkrebszellen. Bei Dickdarmkrebs rekonstruiert KA die interzelluläre Kommunikation von Gap Junctions, indem es die Expression und Phosphorylierung von Junction Protein 43 in Dickdarmkrebszellen erhöht und dadurch die Zellapoptose auslöst. KA kann auch Apoptose und Alterung in menschlichen Gebärmutterhalskrebszellen induzieren, indem es die PI3K/AKT- und hTERT-Signalwege herunterreguliert. Bei Brustkrebs wurde berichtet, dass KA über verschiedene Mechanismen eine antitumorale Rolle spielt. KA kann die Invasion von Brustkrebszellen hemmen, indem es die Expression und Aktivität der PKC δ/MAPK/AP-1-Kaskade und anschließend die Matrixmetalloproteinase-9 (MMP-9) blockiert. Li et al. fanden heraus, dass KA die Proliferation von SK-BR-3 Brustkrebszellen durch die Regulierung des Notch1-Proteins hemmen kann. Darüber hinaus kann KA auch die epithelial-mesenchymale Transformation (EMT) und die Metastasierung von MCF-7-Brustkrebszellen hemmen, die durch Triclosan ausgelöst wird. Obwohl die krebshemmende Wirkung von KA bei einer Vielzahl von Tumoren bestätigt wurde, gibt es keinen Bericht darüber, ob KA die Apoptose von dreifach negativen Brustkrebszellen induzieren kann und wie der molekulare Mechanismus aussieht. In dieser Studie wird die menschliche TNBC-Zelle MDA-MB-231 als Forschungsobjekt verwendet, um die Wirkung von Kaempferol auf die Apoptose der MDA-MB-231-Zelle zu beobachten und festzustellen, ob der mögliche Mechanismus mit dem mitochondrialen Apoptoseweg zusammenhängt, um eine theoretische Grundlage und eine experimentelle Basis für den klinischen Einsatz von Kaempferol bei der Behandlung von dreifach negativem Brustkrebs zu schaffen.
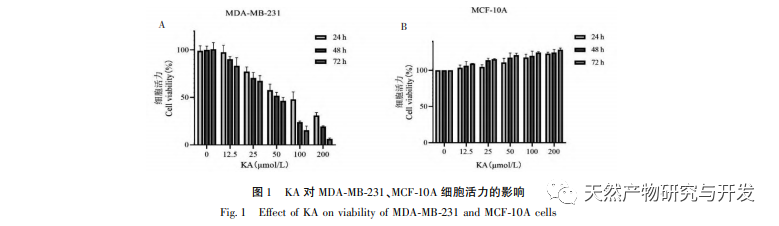
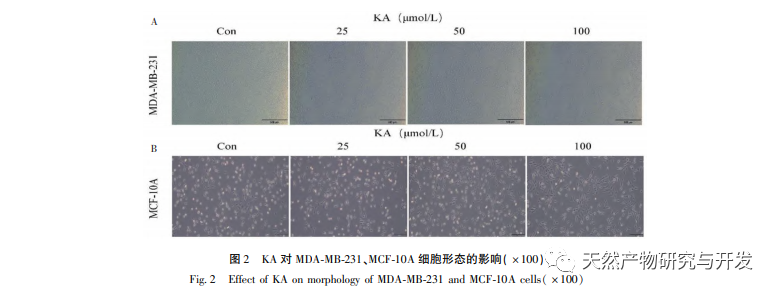
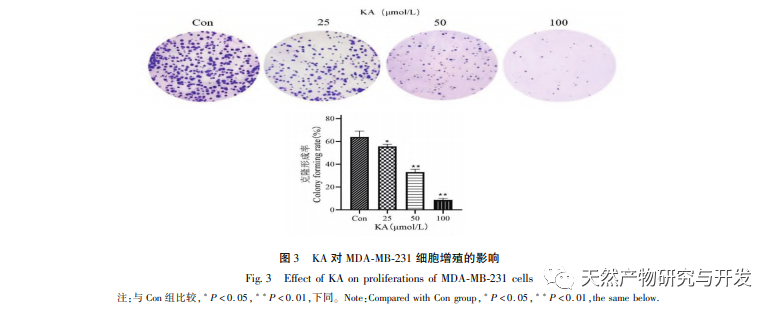
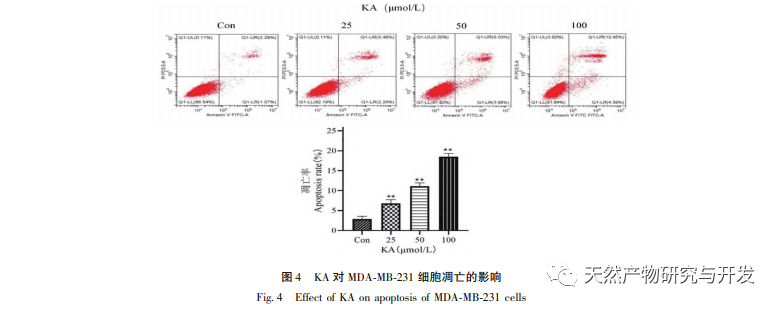
Kaempferol, eine in verschiedenen Pflanzen weit verbreitete Polyol-Hydroxyflavonoid-Verbindung, kann nicht nur das Wachstum von Tumorzellen wirksam hemmen und Apoptose auslösen, sondern auch die Wachstumsvitalität normaler Zellen erhalten. Chen et al. fanden heraus, dass KA den Zellzyklus von Prostatakrebs zum Stillstand bringt, die Zellproliferation hemmt und keine Auswirkungen auf die Lebensfähigkeit normaler menschlicher Vorhautfibroblasten (HFF) hat, was darauf hindeutet, dass KA eine gute Anti-Tumor-Wirksamkeit und geringe Toxizität aufweist. Tu et al. fanden heraus, dass KA die Proliferation und Metastasierung menschlicher Gebärmutterhalskrebszellen wirksam hemmen kann, während seine zytotoxische Wirkung auf karzinoembryonale Nierenzellen und normale Leberzellen relativ gering ist, was darauf hindeutet, dass KA eine hohe Fähigkeit zur gezielten Bekämpfung von Krebszellen besitzt. Es gibt nur wenige Studien über KA bei dreifach negativen Brustkrebszellen. Daher bestätigte diese Studie, dass KA die Proliferation von TNBC-Zellen signifikant hemmen und die Zellapoptose durch In-vitro-Studien an MDA-MB-231- und MCF-10A-Zellen fördern kann, aber keine Auswirkungen auf die Proliferation normaler epithelialer MCF-10A-Brustzellen hat.
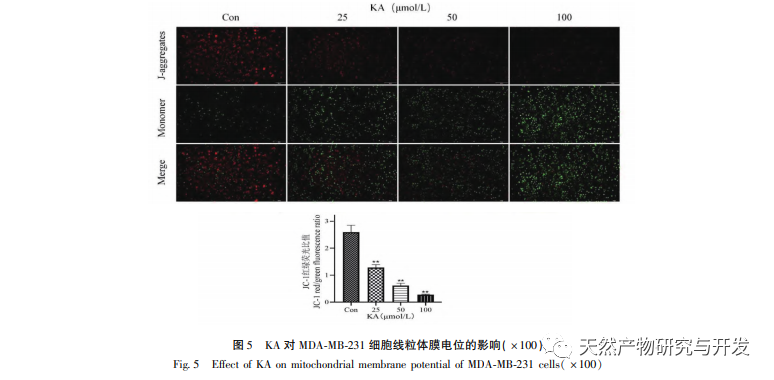
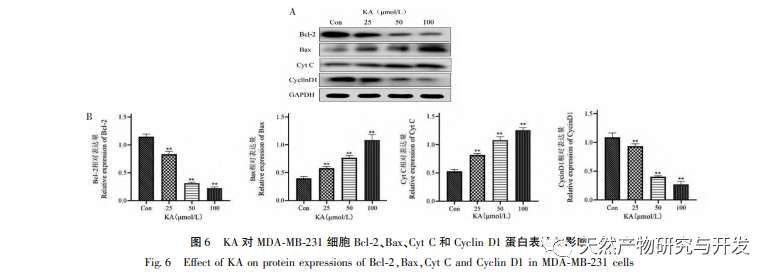
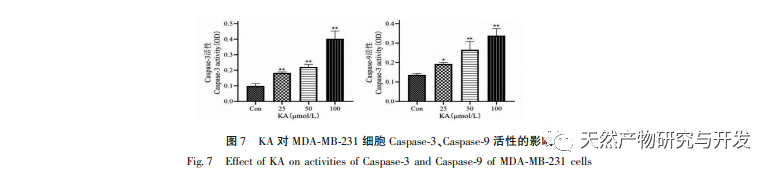
Auf dieser Grundlage wird in diesem Experiment der Mechanismus der Apoptoseinduktion durch KA bei MDA-MB-231-Zellen weiter untersucht. Derzeit hat die Forschung herausgefunden, dass die Zellapoptose hauptsächlich drei Wege umfasst, die auf dem Initiierungsprozess basieren: den mitochondrialen Weg, den Todesrezeptor-Weg und den endoplasmatischen Retikulum-Weg, und der mitochondriale Weg spielt eine wichtige Rolle bei der Vermittlung der Zellapoptose. Das mitochondriale Membranpotenzial ist einer der besten Indikatoren für die Durchlässigkeit der inneren Mitochondrienmembran. Die Abnahme des mitochondrialen Membranpotenzials gilt als das früheste Ereignis in der Kaskadenreaktion der Zellapoptose. Sobald das mitochondriale Membranpotenzial zusammenbricht, wird die Zellapoptose irreversibel. Feng et al. isolierten ein Arabinogalaktan aus Artemisia scoparia, das menschliche Nasopharynxkarzinom-Zellen (CNE-2) abtöten kann, indem es einen Verlust des mitochondrialen Membranpotenzials verursacht. In dieser Studie wurde festgestellt, dass KA eine Verringerung des mitochondrialen Membranpotenzials in MDA-MB-231-Zellen bewirkt, was darauf hindeutet, dass einer der Mechanismen, durch den Kaempferol die Zellproliferation hemmt und die Apoptose fördert, möglicherweise über den mitochondrial vermittelten apoptotischen Weg erreicht wird. Um die Beziehung zwischen der durch KA induzierten Apoptose von MDA-MB-231-Zellen und dem mitochondrialen Apoptose-Signalweg weiter zu untersuchen, wurden in dieser Studie die Expression von Bcl-2, Bax, CytC, Cyclin D1 sowie die Aktivität von Caspase-3 und Caspase-9 ermittelt.
Zur Bcl-2-Proteinfamilie gehören das anti-apoptotische Protein Bcl-2 und das pro-apoptotische Protein Bax. Als Regulatoren der Integrität der mitochondrialen Außenmembran spielen sie eine wichtige Rolle bei der Regulierung des mitochondrialen Apoptosewegs. Nach Erhalt des apoptotischen Signals verlagert sich Bax aus dem Zytoplasma in die Mitochondrien, und das anti-apoptotische Protein Bcl-2 steuert die Freisetzung von Cytochrom C aus den Mitochondrien und fördert die Selbstaktivierung des Caspase-9-Vorläufers. Die aktivierte Caspase-9 aktiviert Caspase-3, was letztlich zur Apoptose der Zellen führt. Liu et al. fanden heraus, dass KA die Proliferation menschlicher Gallenblasenkrebszellen hemmt und ihre Apoptose über den mitochondrialen Apoptoseweg induziert. In dieser Studie beobachteten wir, dass KA die Expression von Bax erhöhte und die Expression von Bcl-2 in MDA-MB-231-Zellen verringerte, was die Freisetzung von CytC in das Zytoplasma über den mitochondrialen Apoptoseweg förderte, was zu einer erhöhten Expression führte. Gleichzeitig erhöht sich die Permeabilität der Mitochondrienmembran, das Membranpotenzial sinkt, prä-apoptotische Faktoren werden freigesetzt und lösen die nachgeschaltete Aktivierung von Caspase-3 und Caspase-9 aus, was letztlich zur Apoptose der Zellen führt. Darüber hinaus steht die Apoptose in engem Zusammenhang mit einer anormalen Zellproliferation, und die Hauptursache für die Zellproliferation ist ein anormaler Zellzyklus. Cyclin D1, ein wichtiges regulatorisches Protein des Zellzyklus, kann den Übergang der Zellen von der G1-Phase in die S-Phase fördern, den Zellzyklusprozess beschleunigen und seine Hochregulierung kann eine anormale Zellproliferation verursachen, Veränderungen des mitochondrialen Membranpotenzials induzieren und zur Tumorentwicklung führen. Die Ergebnisse dieses Experiments zeigen, dass KA die Expression der mit der Apoptose zusammenhängenden Proteine Cyclin D1 und Bcl-2 in MDA-MB-231-Zellen herunterregulieren, das mitochondriale Membranpotenzial verringern, die Zellproliferation hemmen und die Zellapoptose fördern kann.
Zusammenfassend lässt sich sagen, dass diese Studie die krebshemmende Wirkung von Kaempferol auf dreifach negative Brustkrebszellen in vitro geklärt hat und eine gewisse Sicherheit aufweist. Außerdem wurde der Mechanismus von KA geklärt, der die Apoptose von MDA-MB-231-Zellen durch den mitochondrialen Apoptose-Signalweg induziert. Später kann die hemmende Wirkung von KA auf TNBC durch In-vivo-Experimente weiter untersucht werden, um eine experimentelle Grundlage für die Entwicklung und klinische Anwendung von KA zu schaffen.
