Studie über die therapeutische Wirkung und den Mechanismus des Phenylethanoidglykosids von Cistanche deserticola bei Ratten mit chronischer Höhenkrankheit
Die Höhenkrankheit ist ein allgemeiner Begriff für verschiedene klinische Erscheinungen, die auf die Unfähigkeit des Körpers zurückzuführen sind, sich an die Niederdruckhypoxie in großen Höhen anzupassen, was zu einer Reihe von pathologischen und physiologischen Veränderungen im Körper führt. Diese Krankheit wird im Allgemeinen in zwei Kategorien unterteilt: die akute und die chronische. Die chronische Bergkrankheit (CMS) bezeichnet einen Zustand, bei dem die ursprünglichen Symptome der akuten Bergkrankheit länger als sechs Monate nach der Ankunft in der Höhe fortbestehen oder auftreten. Forscher haben herausgefunden, dass sich die Gene Egl9 homolog 1 (EGLN1) und Peroxisom-Proliferator-aktivierter Rezeptor alpha (PPAR-α) in der tibetischen Bevölkerung von denen in niedrig gelegenen Gebieten unterscheiden und das Hämoglobin im tibetischen Blut hemmen können, so dass es in einer niedrigen Konzentration bleibt. Dies ist auch einer der Gründe, warum die Tibeter in großen Höhen überleben können. Diese Studie deutet darauf hin, dass die beiden oben genannten Gene Kandidaten für den Hypoxie-Reaktionsweg sind und ihre Wirkung letztlich über den Hypoxie-induzierbaren Faktor 1 alpha (HIF-1 alpha) ausüben. EGLN1 ist das vorgelagerte Gen von HIF-1 α, während PPAR - α das nachgelagerte Ziel von HIF-1 α ist.
Niedriger Sauerstoff kann die Hydroxylierung und Acetylierung von HIF-1 α blockieren, seine Stabilität erhöhen und die Übertragung von Gentranskriptionsinformationen induzieren, indem er die Transkription und Expression von nachgeschalteten Genen wie dem vaskulären endothelialen Wachstumsfaktor (VEGF), Endothelin-1 (ET-1) usw. reguliert, wodurch ein pulmonaler Gefäßumbau verursacht wird, der wiederum zu einem Lungenödem und einer Herzerkrankung in großer Höhe führt. Im Gegensatz zur Wirkung von ET-1 ist Stickstoffmonoxid (NO) ein Gassignalmolekül, das die Produktion von L-Arginin durch die Stickstoffmonoxid-Synthase (NOS) katalysiert und ein breites Spektrum an Wirkungen hat.
In dieser Studie wurde eine künstliche Versuchskabine im Nordwesten verwendet, um die sauerstoffarme Umgebung des Hochplateaus zu simulieren. Unter Berücksichtigung der Hauptunterschiede zwischen dem Hochplateau und dem Flachland wurde ein Tiermodell für die Höhenkrankheit erstellt, um die Rolle und den inneren Zusammenhang des HIF-1-α-Signalwegs bei der Entstehung der Höhenkrankheit zu untersuchen. Auf dieser Grundlage wurden die präventiven und therapeutischen Wirkungen von Phenylethanoidglykosiden aus Cistanche (PhGCs) auf die Höhenkrankheit und ihre Mechanismen beobachtet, was eine theoretische Grundlage für die Untersuchung der Pathogenese der Höhenkrankheit und die Entwicklung neuer Medikamente gegen die Höhenkrankheit darstellt.

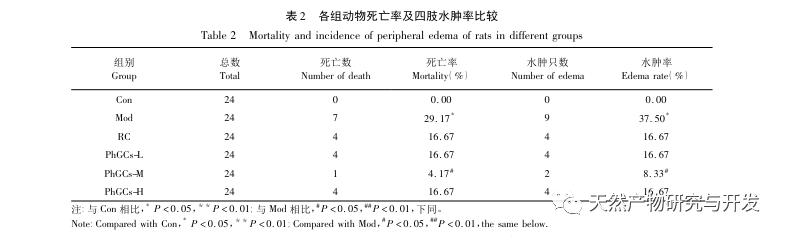
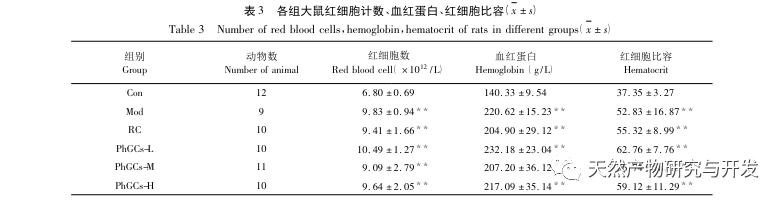


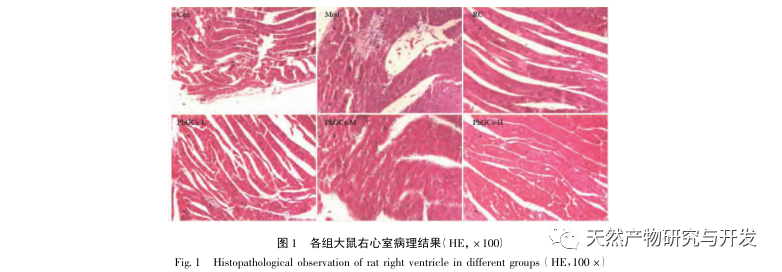


 PhGCs wurden aus Cistanche deserticola im südlichen Xinjiang extrahiert, und verschiedene Phenylethanolglykoside wurden durch entsprechende Forschung erfolgreich isoliert, darunter Echinacosid, Verbascosid, Isoverbascosid, 2'-Acetylverbascosid, Cistanche deserticola Glykosid A und Salidrosid. Seit vielen Jahren werden die pharmakologischen Wirkungen von PhGCs, wie Antioxidantien, Fänger freier Radikale und Anti-Aging, eingehend untersucht. In diesem Experiment war die PhGCs-M-Gruppe in der Lage, den Index der rechtsventrikulären Hypertrophie bei Ratten signifikant zu reduzieren, was darauf hindeutet, dass Cistanche deserticola Phenylethanolinsäure die Hämodynamik und den Grad der rechtsventrikulären Hypertrophie bei CMS-Ratten verbessern kann und eine gewisse therapeutische Wirkung auf CMS hat. In dieser Studie wird anhand der Indikatoren für die Blutsauerstoffsättigung spekuliert, dass die PhGCs die Blutsauerstoffsättigung erhöhen, die Schädigung des Körpers durch Hypoxie verringern und die Toleranz des Körpers gegenüber Hypoxieschäden bei gleicher Anzahl roter Blutkörperchen und gleichem Hämoglobingehalt erhöhen, wodurch das Ziel der Behandlung der Höhenkrankheit erreicht wird. Nach der Behandlung mit PhGCs gingen die Sterblichkeitsrate und das Auftreten von Gliederödemen bei CMS-Ratten deutlich zurück, was die Wirksamkeit bei der Behandlung der CMS weiter unterstreicht.
PhGCs wurden aus Cistanche deserticola im südlichen Xinjiang extrahiert, und verschiedene Phenylethanolglykoside wurden durch entsprechende Forschung erfolgreich isoliert, darunter Echinacosid, Verbascosid, Isoverbascosid, 2'-Acetylverbascosid, Cistanche deserticola Glykosid A und Salidrosid. Seit vielen Jahren werden die pharmakologischen Wirkungen von PhGCs, wie Antioxidantien, Fänger freier Radikale und Anti-Aging, eingehend untersucht. In diesem Experiment war die PhGCs-M-Gruppe in der Lage, den Index der rechtsventrikulären Hypertrophie bei Ratten signifikant zu reduzieren, was darauf hindeutet, dass Cistanche deserticola Phenylethanolinsäure die Hämodynamik und den Grad der rechtsventrikulären Hypertrophie bei CMS-Ratten verbessern kann und eine gewisse therapeutische Wirkung auf CMS hat. In dieser Studie wird anhand der Indikatoren für die Blutsauerstoffsättigung spekuliert, dass die PhGCs die Blutsauerstoffsättigung erhöhen, die Schädigung des Körpers durch Hypoxie verringern und die Toleranz des Körpers gegenüber Hypoxieschäden bei gleicher Anzahl roter Blutkörperchen und gleichem Hämoglobingehalt erhöhen, wodurch das Ziel der Behandlung der Höhenkrankheit erreicht wird. Nach der Behandlung mit PhGCs gingen die Sterblichkeitsrate und das Auftreten von Gliederödemen bei CMS-Ratten deutlich zurück, was die Wirksamkeit bei der Behandlung der CMS weiter unterstreicht.
NO spielt als endothelabhängiger Vasodilatator eine wichtige Rolle bei der endothelialen Vasodilatation, da es die glatte Muskulatur der Lungengefäße direkt entspannt, was zu einer erheblichen pulmonalen Vasodilatation führt. Es hat auch die Fähigkeit, die Proliferation und Migration von glatten Lungengefäßmuskelzellen zu hemmen, die Thrombozytenaggregation zu unterdrücken und spielt eine wichtige Rolle bei der Aufrechterhaltung der Stabilität des Lungenkreislaufs. In dieser Studie wurde festgestellt, dass der NO-Gehalt im Homogenat des Mod-Lungengewebes abnahm und die Aktivitäten von T-NOS, iNOS und eNOS sanken. PhGCs können den NO-Gehalt im Lungengewebe erhöhen, indem sie die Aktivitäten von TNOS, iNOS und eNOS steigern und so eine Rolle bei der Bekämpfung der Proliferation und Myometrisierung der glatten Muskulatur der Lungenarterie und der Behandlung von CMS spielen.
ET-1 ist der stärkste bisher entdeckte Vasokonstriktor, und Hypoxie kann die ET-1-Konzentration im Blut deutlich erhöhen. Rajput et al. verglichen die Unterschiede in ET-1-Allelen zwischen Bewohnern von Höhenlagen und Bewohnern des Flachlands und stellten fest, dass bestimmte ET-1-Allele bei Bewohnern von Höhenlagen überexprimiert waren und die Expression des ET-l-Allels signifikant mit dem ET-1-Plasmaspiegel korreliert war. In diesem Artikel war der ET-1-Gehalt im Lungengewebe von Mod-Ratten signifikant erhöht, was darauf hindeutet, dass Hypoxie eine erhöhte Sekretion von ET-1 im Lungengewebe bewirkt, was mit anderen Studien übereinstimmt. Die Verabreichung von PhGCs kann den ET-1-Gehalt im Lungengewebe von CMS-Ratten senken, was darauf hindeutet, dass PhGCs die durch ET-1 induzierte Gefäßverengung hemmen, den Druck in der Lungenarterie senken und therapeutische Wirkungen auf CMS ausüben können.
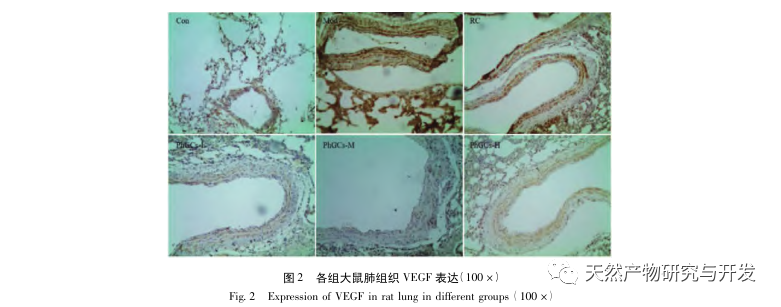
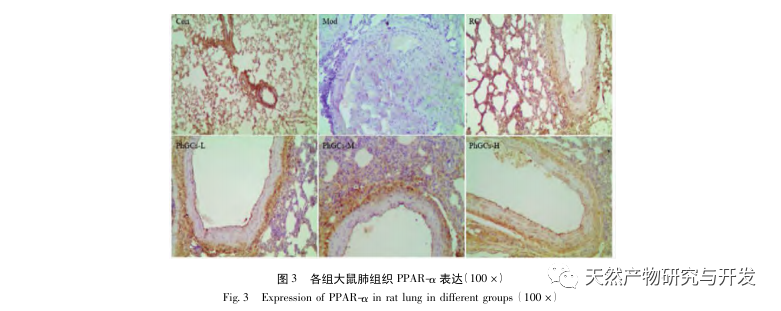
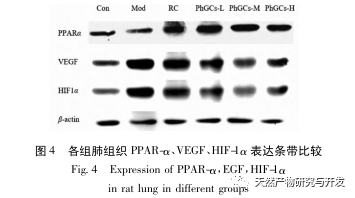
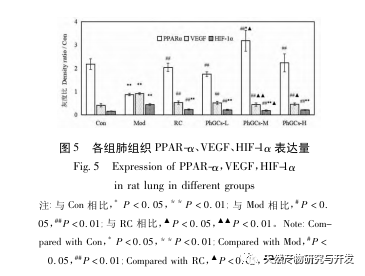
Anschließend konzentrierten wir uns auf die Beobachtung der Auswirkungen von PhGCs auf HIF-1 α, VEGF und PPAR - α im Hypoxie-induzierten Signalweg. Die mRNA- und Proteinexpression im Lungengewebe der Ratten jeder Gruppe wurde mittels Immunhistochemie, quantitativer Fluoreszenz-PCR und Western-Blot-Methoden nachgewiesen. Die immunhistochemischen Ergebnisse zeigten, dass die Expression von VEGF in den Lungenarterien von Mod-Ratten höher war als die von Con, während die Expression von PPAR-α niedriger war als die von Con. Die VEGF-Expressionsniveaus in den Lungenarterien der Gruppen PhGCs niedrig, mittel, PhGCs-H und RC waren niedriger als die von Mod, während das Expressionsniveau von PPAR-α anstieg. Dies deutet darauf hin, dass PhGCs und Rhodiola rosea die durch Hypoxie induzierte Expression von VEGF hemmen, die PPAR-α-Expression fördern und die pulmonale Gefäßproliferation und Myogenese lindern können und damit eine therapeutische Rolle bei CMS spielen. Durch experimentelle Messung der Expression von HIF-1-α-Protein und mRNA im Lungengewebe wurde festgestellt, dass die Expression von HIF-1-α-Protein im Lungengewebe von CMS-Modellratten signifikant anstieg, während die Expression von mRNA und Con keinen Unterschied zeigte. Dies steht im Einklang mit den einschlägigen Forschungsergebnissen, die zeigen, dass Hypoxie hauptsächlich die Expression des HIF-1 α-Proteins reguliert. PhGCs können die Expressionsniveaus von HIF-1 α-Protein und mRNA signifikant reduzieren, was darauf hindeutet, dass sie einen Einfluss auf die Transkription und Translation von HIF-1 α haben können. Rhodiola rosea hatte jedoch keine signifikante Wirkung auf die Expression von HIF-1 α-mRNA, was darauf hindeutet, dass es hauptsächlich die Proteinexpression wie Hypoxie beeinflusst.
Insgesamt zeigte die PhGCs-M-Gruppe unter den drei Dosen von PhGCs die beste Wirkung auf CMS, während die PhGCs-H-Behandlung keine signifikante Verbesserung zeigte, was mit der Abnahme der intestinalen Absorptionsrate von PhGCs-H zusammenhängen könnte. Im Vergleich zu Rhodiola rosea, PhGCs-M hat eine bessere therapeutische Wirkung auf HIF-1 α mRNA und VEGF mRNA Indikatoren. In Verbindung mit den Ressourcenvorteilen haben PhGCs gewisse Entwicklungsperspektiven.
