Computersimulationsbewertung von Pankreaslipase hemmenden Peptiden in Kamelblutprotein
In den letzten Jahren hat sich die Hyperlipidämie (HLP) mit der Verbesserung des Lebensstandards und der Veränderung der Ernährungsgewohnheiten allmählich zum "Killer Nummer eins" entwickelt, der die menschliche Gesundheit gefährdet. Diese Krankheit wird durch eine Dysregulation des Fettstoffwechsels im Körper verursacht. Angesichts des engen Zusammenhangs zwischen Cholesterinabsorption und Fettstoffwechsel ist der Cholesterinabsorptionsweg zu einem wichtigen Interventionsziel für die Behandlung von Hyperlipidämie geworden, das die Hyperlipidämie wirksam verhindern kann, indem es die Cholesterinabsorption im Darm verringert. Die mit der Nahrung aufgenommenen Lipide werden zunächst von der Bauchspeicheldrüsenlipase hydrolysiert, in Fettsäuren und Monoglyceride aufgespalten, bilden Mizellen mit Cholesterin, Gallensalzen usw. und werden schließlich von den Zellen im Darm absorbiert. Daher kann eine wirksame Hemmung der Aktivität der Pankreaslipase (PL) die Aufnahme von Lipiden durch den Körper verringern, die Beschwerden an der Quelle lindern und Krankheiten vorbeugen. Einige auf dem Markt befindliche Medikamente haben bestimmte Nebenwirkungen, die bei den Patienten Beschwerden verursachen können. Daher ist es dringend erforderlich, natürlich vorkommende bioaktive Substanzen zu entwickeln, die bei der Behandlung von Hyperlipidämie helfen.
Bioaktive Peptide sind in den letzten Jahren aufgrund ihrer vielfältigen Quellen und ihres hohen Sicherheitsfaktors zu einem Hotspot der Forschung geworden. Kamelblut hat einen hohen Proteingehalt mit einem Gesamtproteingehalt von 6,80 g/dL und einem Hämoglobingehalt von 141,11 g/L, der höher ist als der anderer Nutztiere. Es enthält auch eine Vielzahl von Aminosäuren, die den empfohlenen Werten von WHO/FAO/UNU entsprechen, und ist eine potenzielle Quelle für hochwertige bioaktive Peptide. Untersuchungen haben gezeigt, dass Kamelblutprotease-Hydrolysate gegen Müdigkeit und Ermüdung wirken und den Blutdruck senken. Daher hat die Herstellung von Pankreaslipase hemmenden Peptiden aus Kamelblutprotein einen gewissen Forschungswert.
In dieser Studie wurde neutrale Protease zur Hydrolyse von Kamelblutprotein verwendet, und die Pankreaslipase-Inhibitionsrate wurde als Bewertungsindex zur Optimierung des enzymatischen Hydrolyseprozesses verwendet. Zur Bestimmung der Molekulargewichtsverteilung von Kamelblutpeptiden wurde die Matrix-unterstützte Laserdesorptions-/Ionisations-Flugzeit-Massenspektrometrie (MALDI-TOF-MS) verwendet, und zur Identifizierung und Analyse von Kamelblutpeptiden wurde die Flüssigchromatographie-Massenspektrometrie (LC-MS) eingesetzt. Mit Hilfe von PepSite2 wurden die Bindungsstellen modelliert und vorhergesagt, und mit Hilfe von Molekulardynamiksimulationen wurden die Bindungsstellen und Wirkungsweisen der untersuchten Peptide bewertet, was eine Grundlage für die künftige Identifizierung und Analyse von Kamelblutpeptiden darstellt. Die Studie über lipasehemmende Peptide liefert Hinweise und neue Ideen für die Entwicklung und Nutzung von Kamelblut.
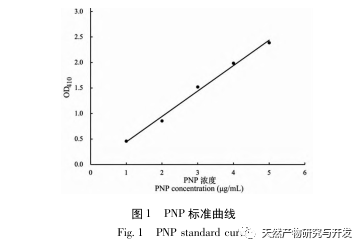
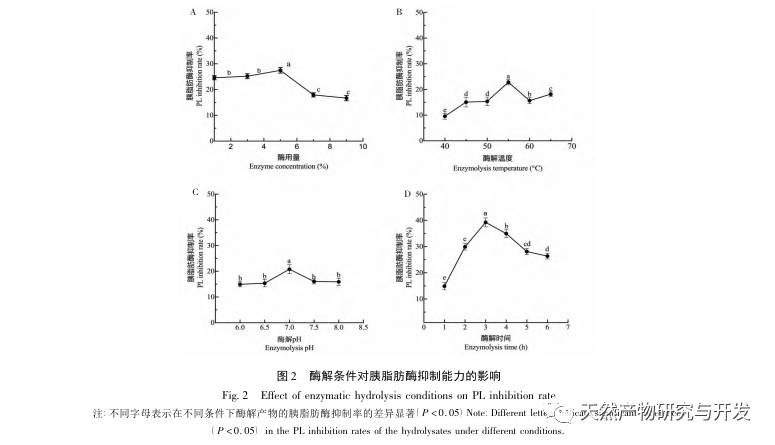
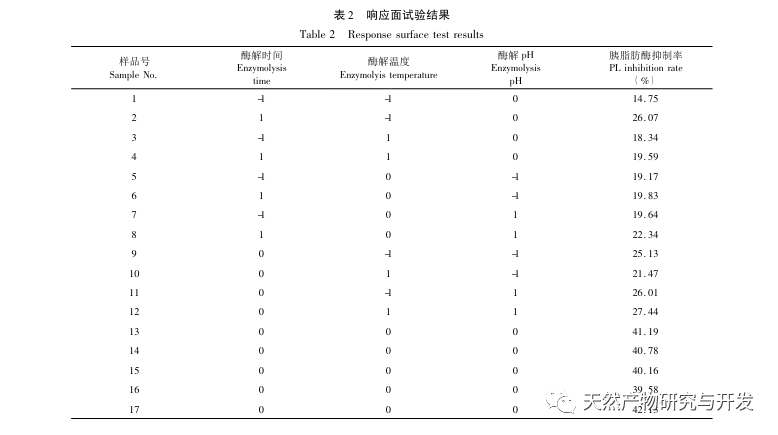
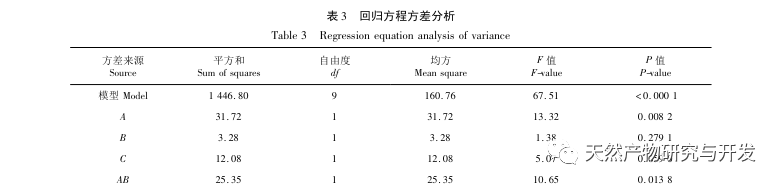
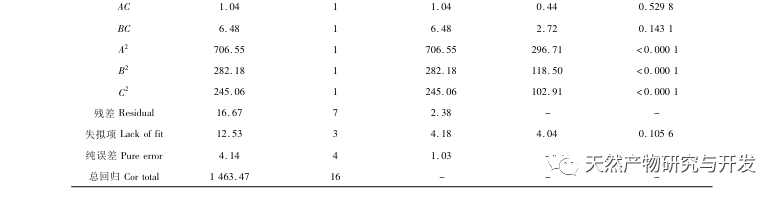
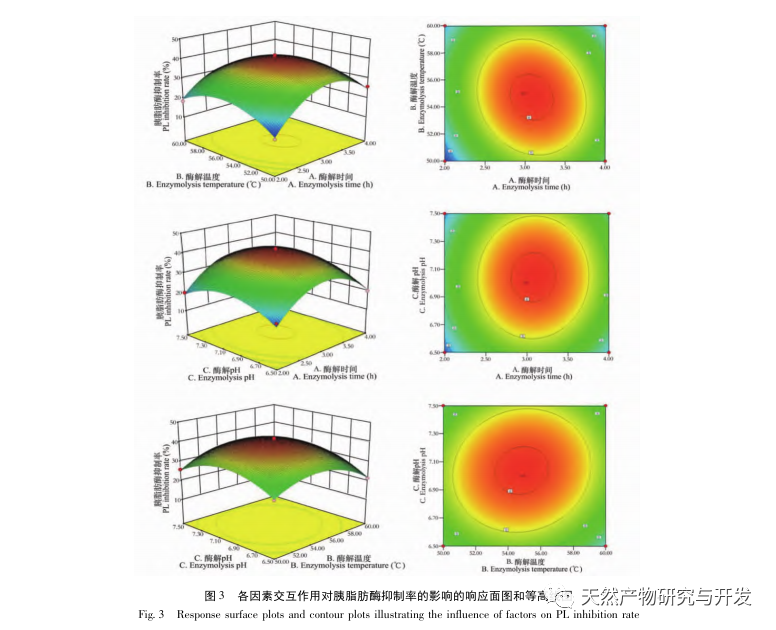
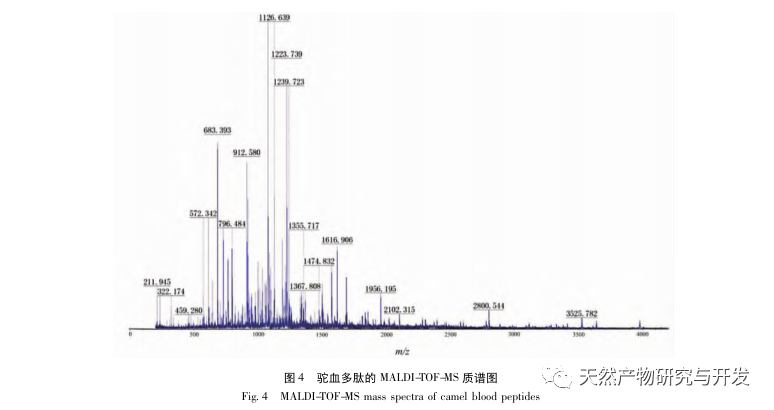


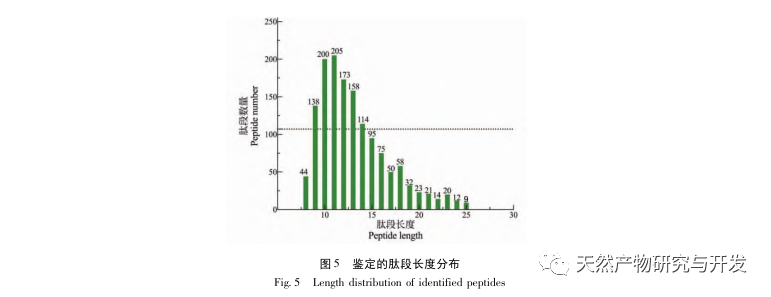
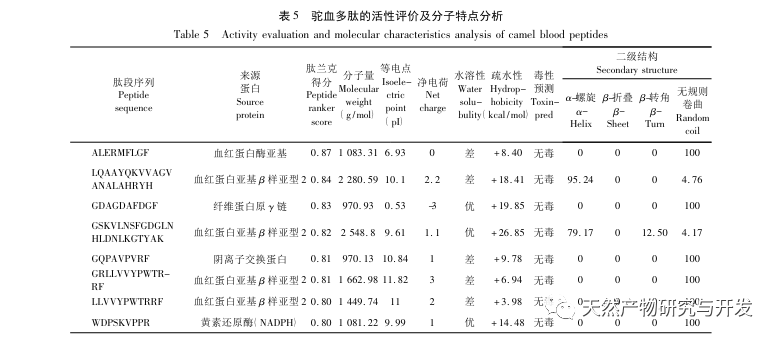

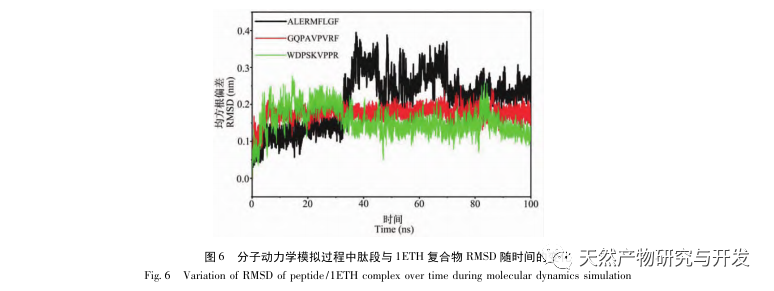
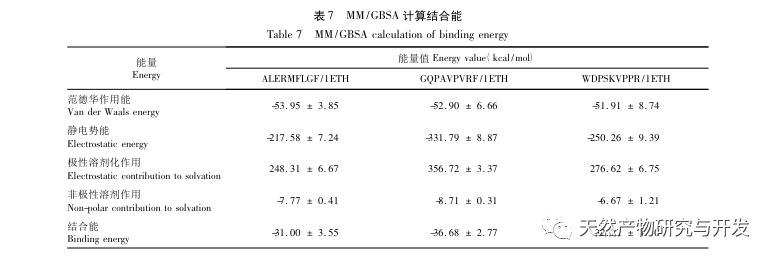
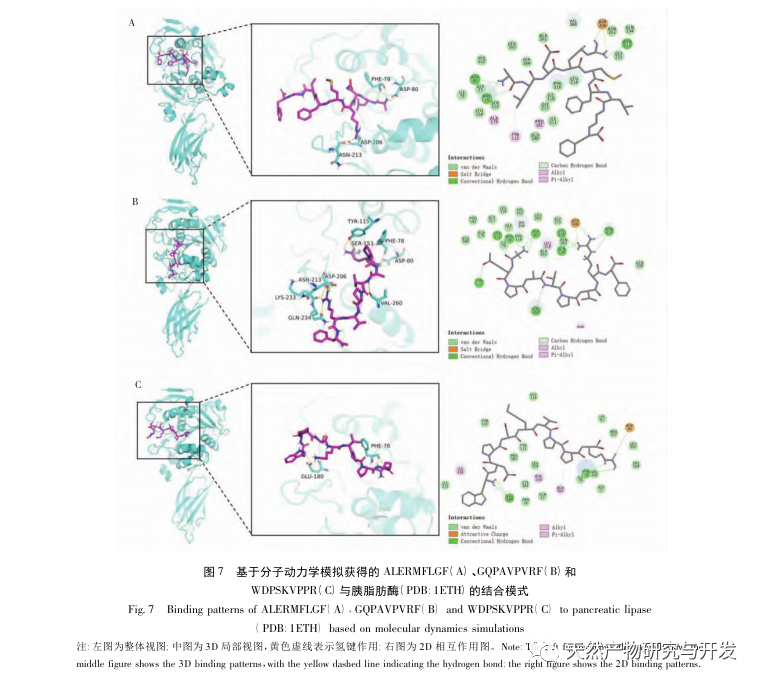
Die Hemmung der Pankreaslipase gilt als eine der wichtigsten therapeutischen Maßnahmen bei Hyperlipidämie und Fettleibigkeit. In dieser Studie wurde das Verfahren zur Herstellung von die Pankreaslipase hemmenden Peptiden aus Kamelblut durch neutrale Protease-Hydrolyse auf der Grundlage der die Pankreaslipase hemmenden Aktivität durch Einzelfaktor- und Response-Surface-Experimente optimiert. Unter optimalen Bedingungen betrug die Pankreaslipase-Hemmungsrate des Kamelblutpeptids 42,13%. Durch die Analyse der enzymatischen Hydrolyseprodukte mittels MALDI-TOF-MS, LC-MS und Bioinformatik wurden drei Peptidsegmente, ALERMFLGF, GQPAVPVRF und WDPSKVPPR, als signifikant bindend für Pankreaslipase identifiziert. Durch Molekulardynamiksimulationen wurde festgestellt, dass die drei Peptidsegmente hauptsächlich an die Aminosäurereste der aktiven PL-Stelle durch Wasserstoffbrückenbindungen und hydrophobe Wechselwirkungen binden, die Funktion des N-terminalen Domänenventils der Pankreaslipase stören und ihre Aktivität hemmen. GQPAVPVRF hat eine hohe freie Bindungsenergie und eine große Anzahl von Wasserstoffbrückenbindungen innerhalb von 100 ns, was bedeutet, dass es sich eng an 1ETH binden kann und voraussichtlich ein Bestandteil von Pankreaslipase-Inhibitoren werden wird. Die Forschungsergebnisse zeigen, dass Kamelblutprotein als Quelle für Pankreaslipase hemmende Peptide dienen kann. Die Ergebnisse des virtuellen Screenings weisen jedoch gewisse Einschränkungen auf, und in Zukunft müssen die Wasserlöslichkeit und die Verdauungsstabilität der Peptidsegmente optimiert werden. Nach der künstlichen Synthese sollte die Anti-Hyperlipidämie-Wirkung durch In-vitro- und In-vivo-Versuche überprüft werden.
