Zu den ischämischen zerebrovaskulären Erkrankungen gehören zwei Arten: der transitorische ischämische Schlaganfall und der Hirninfarkt. Der Hirninfarkt wird in der traditionellen chinesischen Medizin als ischämischer Schlaganfall (IS) bezeichnet und ist eine Erkrankung, die aus verschiedenen Gründen zu lokalen Durchblutungsstörungen in den Hirngewebsregionen führt, was wiederum ischämische und hypoxische Läsionen und Nekrosen des Hirngewebes zur Folge hat und in der Folge eine Reihe von neurologischen Funktionsstörungen verursacht. Die hohe Sterblichkeits- und Behinderungsrate sowie die komplexen pathologischen Mechanismen stellen jedes Jahr eine erhebliche wirtschaftliche Belastung für die Welt dar. Sauerstoff-Glukose-Entzug (OGD) in Gehirnzellen ist das am häufigsten verwendete In-vitro-Modell des ischämischen Schlaganfalls, das in der Grundlagen- und präklinischen Schlaganfallforschung weit verbreitet ist.
Die Autophagie ist in eukaryontischen Zellen weit verbreitet und spielt eine wichtige Rolle bei der Regulierung von Zellüberlebens- und -todprozessen. Zahlreiche Studien deuten darauf hin, dass die Autophagie in engem Zusammenhang mit dem Auftreten und der Entwicklung von ischämischen Hirnschäden steht. Einige Studien haben gezeigt, dass neuronale Autophagie ischämische Hirnverletzungen lindern kann, während andere berichtet haben, dass neuronale Autophagie ischämische Hirnverletzungen verschlimmern kann, aber der spezifische Mechanismus ist noch unklar.
β-Nicotinamidmononukleotid (NMN) ist in verschiedenen Lebensmitteln enthalten und spielt eine entscheidende Rolle bei der Regulierung der Zellalterung und der Aufrechterhaltung normaler Körperfunktionen. Es ist an der Transduktion vieler wichtiger intrazellulärer Signalwege beteiligt. Es gibt Forschungsberichte, wonach die Verabreichung von NMN in vitro zu einer schnellen Umwandlung in NAD+ führen kann, um die Zellalterung zu regulieren und normale Körperfunktionen aufrechtzuerhalten. NMN kann die durch IS verursachte Abnahme von NAD+ ausgleichen und die neuronalen Schäden bei zerebraler Ischämie verbessern. Dies deutet darauf hin, dass NMN eine gewisse Rolle bei invasiver Insuffizienz spielt. Studien haben gezeigt, dass NMN die neurovaskuläre Regeneration fördern, die mikrovaskuläre Endothelfunktion des Gehirns verbessern sowie entzündungshemmend und apoptosehemmend wirken kann. Es gibt auch einige Studien, die darauf hindeuten, dass NMN durch die Regulierung der Autophagie Wirkungen gegen ischämische Hirnverletzungen entfalten kann, aber der spezifische Mechanismus, durch den NMN die Autophagie reguliert und gegen IS wirkt, ist noch nicht klar.
Ziel dieser Studie ist es, ein PC12-Zellmodell mit Sauerstoff-Glukose-Entzug zu konstruieren. Die Überlebensrate der Zellen wurde mittels MTT-Assay in vitro gemessen, Autophagosomen und Autolysosomen wurden mittels Transmissionselektronenmikroskopie nachgewiesen, die Intensität der Autophagosomen-Fluoreszenz wurde mittels MDC beobachtet, und die mit der Autophagie verbundene Proteinexpression von LC3-II/LC3-I, Beclin1, p62 und P-mTOR/mTOR wurde mittels Western Blot nachgewiesen. Ziel ist es, die Wirkung von NMN auf OGD-induzierte autophagische Schäden in PC12-Zellen zu klären.




Die Lancet-Studie aus dem Jahr 2017 zeigte, dass Schlaganfälle die Hauptursache für den Verlust von Lebensjahren in China sind, mit schnellem Krankheitsverlauf, hoher Sterblichkeit und Behinderungsraten. Davon entfallen 60% bis 70% aller Schlaganfälle auf IS, die durch eine Gefäßverengung verursacht wird, die zu einer verminderten Blutzufuhr zu einem bestimmten Bereich des Gehirns führt. Nach einer zerebralen Ischämie und Hypoxie kann dies eine Reihe pathologischer und physiologischer Reaktionen wie Autophagie, Apoptose, oxidativen Stress und intrazelluläre Kalziumüberladung auslösen. Der lange Erholungszyklus der Überlebenden der invasiven Infektion hat die globale wirtschaftliche Belastung erhöht. Gegenwärtig gibt es viele Kontraindikationen für die auf dem Markt befindlichen Medikamente zur Vorbeugung und Behandlung von IS. Daher ist es notwendig, kontinuierlich nach neuen Medikamenten zur Vorbeugung und Behandlung von IS zu suchen. OGD ist ein klassisches Modell für die Untersuchung von IS in vitro. Die PC12-Zelllinie ist eine der am häufigsten verwendeten Zelllinien zur Untersuchung neuronaler Schädigungen, die häufig in der Forschung über Ischämie- und Hypoxie-Schäden eingesetzt wird. Daher wurde in diesem Experiment das OGD PC12-Zellmodell für die In-vitro-Forschung verwendet.
NMN ist eine im menschlichen Körper natürlich vorkommende und auch in vielen Lebensmitteln enthaltene Substanz mit einem Molekulargewicht von 334,22. Es ist ein Produkt der Nikotinamid-Phosphoribosyltransferase-Reaktion und außerdem eine der wichtigsten Vorstufen von NAD+. Studien haben ergeben, dass die Regulierung des NMN-Spiegels im Organismus gute therapeutische und reparative Wirkungen auf kardiovaskuläre und zerebrovaskuläre Erkrankungen, neurodegenerative Erkrankungen und altersbedingte degenerative Erkrankungen hat. Es gibt auch Forschungsberichte darüber, dass die Verabreichung von NMN die Infarktgröße und die neurologischen Schäden in MCAO-Modellen bei Ratten verringern kann. In diesem Experiment wurde mit Hilfe des MTT-Tests nachgewiesen, dass OGD die Überlebensrate von PC12-Zellen verringern kann. NMN kann die Überlebensrate von OGD PC12-Zellen bei Konzentrationen von 400, 800 und 1600 μ mol/L erhöhen, wobei die höchste Überlebensrate bei einer Konzentration von 800 μ mol/L beobachtet wurde. Es gab jedoch keinen signifikanten Unterschied in der Zellüberlebensrate zwischen NMN200 und 3200 μ mol/L Konzentrationen, was darauf hindeutet, dass die 200 μ mol/L Konzentration noch nicht die effektive Konzentration zur Verbesserung der OGD-induzierten PC12-Zellüberlebensrate erreicht hat, während die 3200 μ mol/L Konzentration aufgrund der übermäßigen Konzentration gewisse Schäden an den Zellen verursacht haben könnte.
Autophagie, auch bekannt als programmierter Zelltod vom Typ II, bezeichnet den Prozess, bei dem Zellen unter der Steuerung von Autophagie-bezogenen Genen Lysosomen zum Abbau von beschädigten, denaturierten oder alternden Makromolekülen und Organellen nutzen, um ihr Überleben, ihre Differenzierung, ihr Wachstum und ihre Stabilität zu erhalten. Die Forschung zeigt, dass die Autophagie nach einer invasiven Infektion ausgelöst wird und sich mit dem pathologischen Prozess der invasiven Infektion weiterentwickelt, wobei sie in den akuten, subakuten, Genesungs- und Folgestadien der invasiven Infektion unterschiedliche regulatorische Rollen spielt.
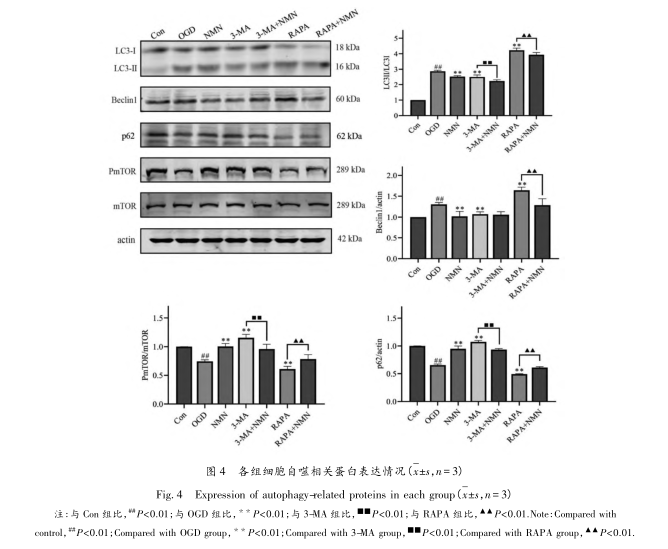
MTOR ist eine atypische Serin/Threonin-Proteinkinase mit einem relativen Molekulargewicht von 289 kDa. Die Bindung verschiedener Proteine kann zwei verschiedene Komplexe bilden, nämlich mTORCl und mTORC2. MTORCl reagiert empfindlich auf Rapamycin und ist für die Integration von Wachstumsfaktoren und Nährstoffsignalen verantwortlich, wobei es vor allem die zelluläre Autophagie, Ribosomenbiogenese, Proteintranslation und Lipidsynthese reguliert. MTORT gilt als ein Ventil für die Autophagie. Die Forschung hat gezeigt, dass phosphoryliertes mTOR oxidative Schäden durch Glukoseentzug abmildern und eine schützende Rolle in den Zellen spielen kann. 3-MA ist ein häufig verwendeter Autophagie-Inhibitor. RAPA ist ein mTOR-Inhibitor, der durch Hemmung von mTORC1, das auch als Autophagie-Aktivator bekannt ist, die Autophagie auslösen kann. In diesem Experiment wurden 3-MA- und RAPA-Gruppen gebildet, um in die durch OGD induzierte Autophagie in PC12-Zellen einzugreifen und sie zu regulieren. Gleichzeitig wurden 3-MA-, RAPA- und Medikamentenkombinationsgruppen gebildet, um zu beobachten, ob NMN den Wirkungen von 3-MA oder RAPA auf die durch OGD induzierte Autophagie in PC12-Zellen entgegenwirken kann.
Die Konzentrationen der Proteine Beclin-1, LC3 und p62 können als wichtige Indikatoren für die Autophagie dienen. Beclin1 ist ein reifer Autophagie-Regulator, der positiv mit der Autophagie korreliert ist. Beclin1 interagiert mit Proteinen wie VPS15, VPS34 und ATG14, um Autophagie- und Membrantransportfunktionen zu erfüllen. LC3 ist ein Homolog des Ubiquitin-ähnlichen Modifikators ATG8 in Hefe, von dem angenommen wird, dass er eine Rolle bei der Autophagie spielt. Nach Behandlung mit ATG4 verliert LC3 seinen C-terminalen Rest und wandelt sich in LC3-I um. LC3-I durchläuft eine Kaskade von Ubiquitinierungs-ähnlichen enzymatischen Reaktionen, wobei es kovalent an das Lipidmolekül Phosphatidylethanolamin auf der Autophagosomenmembran gebunden wird und sich in LC3-II umwandelt. Ein Anstieg des LC3-II/LC3-I-Verhältnisses deutet auf einen Anstieg des Autophagie-Niveaus hin. P62 ist ein Markerprotein, das die Autophagieaktivität widerspiegelt, und sein Proteingehalt ist negativ mit der Autophagie korreliert. Das heißt, wenn Autophagie stattfindet, wird das p62-Protein kontinuierlich im Zytoplasma abgebaut. Wenn die Autophagie-Aktivität geschwächt und die Autophagie-Funktion beeinträchtigt ist, wird sich das p62-Protein kontinuierlich im Zytoplasma anreichern. Dieses Experiment bestätigte durch Western-Blot-Technologie, dass NMN die relativen Expressionsniveaus von Beclin1 und LC3-II/LC3-I-Proteinen herunterregulieren und die Expressionsniveaus von P-mTOR/mTOR und p62-Proteinen hochregulieren kann. Darüber hinaus wurde mit Hilfe der Transmissionselektronenmikroskopie und der MDC-Methode bestätigt, dass NMN die Anzahl und Intensität von Autophagosomen und Autolysosomen in OGD PC12-Zellen reduzieren kann. Dies zeigt, dass NMN die durch OGD induzierte Autophagie in PC12-Zellen hemmen kann.
Zusammenfassend lässt sich sagen, dass eine bestimmte Dosis von NMN der durch OGD induzierten autophagischen Schädigung von PC12-Zellen entgegenwirken kann und somit einen zellulären Schutzeffekt ausübt, der möglicherweise mit mTOR-verwandten Signalwegen zusammenhängt. Diese Studie kann eine bestimmte Zielreferenz für die Prävention und Behandlung von OGD-induzierten autophagischen Schäden durch NMN liefern und Labordaten für die Entwicklung von natürlichem NMN anhäufen.
