Effekten af resveratrol på proliferation, migration og invasion af endometriecancer HEC-1A-celler
Endometriecarcinom (EC) er den mest almindelige tumor i det kvindelige reproduktionssystem, kun overgået af brystkræft, lungekræft og kolorektal cancer. I verden er der ca. 380000 nye tilfælde af endometriecancer hvert år, og ca. 89000 mennesker dør af endometriecancer hvert år, og forekomsten stiger år for år. På nuværende tidspunkt er den specifikke patogenese af endometriecancer stadig uklar, og dens risikofaktorer er relateret til fedme, metabolisk syndrom, hyperlipidæmi, diabetes, polycystisk ovariesyndrom og andre sygdomme, der fører til endometriehyperplasi forårsaget af høj østrogenstatus. Tidlig endometriecancer kan behandles med kirurgi alene eller kirurgi kombineret med adjuverende kemoradioterapi med en samlet 5-års overlevelsesrate på 74% til 91%. Patienter, der diagnosticeres med fremskreden eller tilbagevendende endometriecancer, har en dårlig prognose og lav overlevelsesrate med en samlet femårig overlevelsesrate på ca. 15%. Konventionelle behandlingsformer som kirurgi, strålebehandling, kemoterapi og målrettet terapi er dyre og forbundet med alvorlige bivirkninger. Med fremkomsten af problemer som tumorrecidiv og metastaser samt kemoterapiresistens er der et presserende behov for at finde lettilgængelige, bivirkningsfattige og billige alternative lægemidler til behandling af EC. Derfor er det af stor værdi at forstå de iboende mekanismer for tumorcellers spredning, migration og invasion for at udforske nye metoder til behandling af EC-patienter.
Piceatannol (PIC), med den kemiske formel C14H12O4, er en naturlig polyfenolisk forbindelse, der er vidt udbredt i planter som passionsfrugt, passionsblomst, hvid te og japanske tigerblomster. Forskning har vist, at PIC har antitumor-, antiinflammatoriske, antioxidante og immunregulerende virkninger, der ligner resveratrol, og spiller en vigtig rolle i kræftforebyggelse og -behandling på grund af dets multi-target-natur. Nogle undersøgelser har vist, at PIC har kemoforebyggende aktivitet og kan blokere migration og invasion af prostatacancer, kolorektal cancer, brystcancer, lungecancer, melanom, lymfom osv. Unormal aktivering af Wnt/β - catenin-signalvejen kan fremme forekomsten og udviklingen af forskellige ondartede tumorer og regulere celleproliferation og -differentiering. Forskning har vist, at PIC også kan fungere som en hæmmer af Wnt/β - catenin-signalvejen og en inducer af apoptose i myelomceller. På nuværende tidspunkt er der ingen forskningsrapporter om PIC's antitumoreffekt på endometriecancer, og dens mekanisme til at formidle virkningen af endometriecancerceller er stadig uklar. Dette eksperiment har til formål at udforske den foreløbige antitumormekanisme af PIC ved at observere dens virkninger på spredning, migration og invasion af endometriecancerceller, hvilket giver et teoretisk og eksperimentelt grundlag for at finde nye strategier til behandling af endometriecancer.
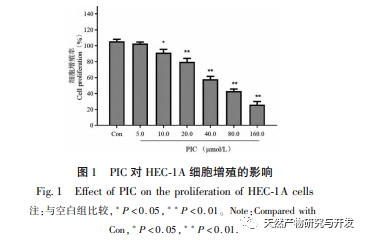
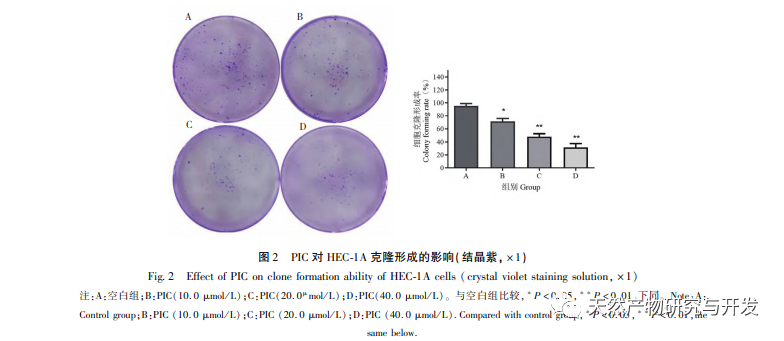
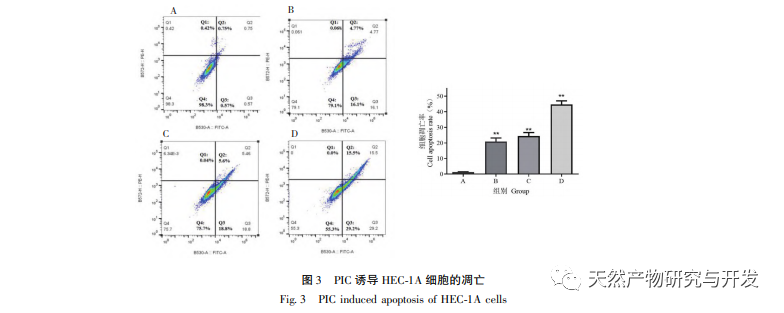
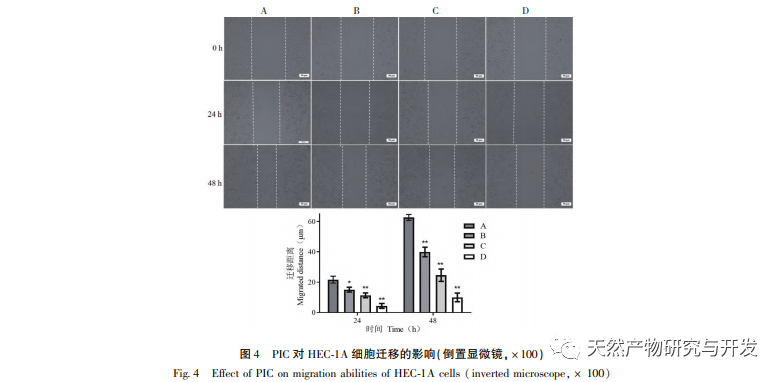
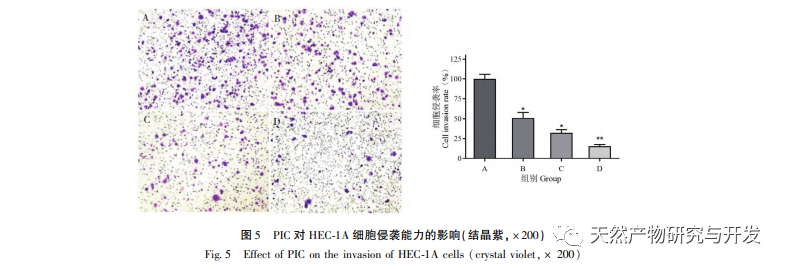
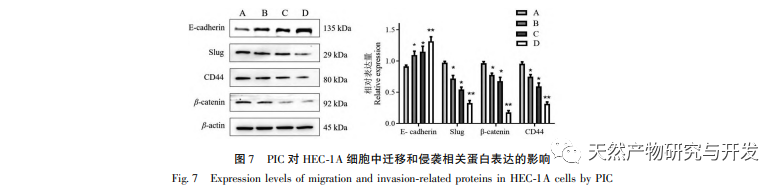
Epithelial mesenchymal transition (EMT) er en afgørende proces i tumormetastasering og giver celler stærke migrerende og invasive embryonale programmer. Under normale omstændigheder spiller EMT en afgørende rolle i sårheling, mens den i unormale tilfælde fremmer tumormetastase. Forskning har bekræftet, at EMT er involveret i forekomst, metastase, anti-apoptose og invasionsprocesser af endometriecancertumorceller. Forskning har vist, at ERK/MAPK-signalvejen og PI3K/AKT/mTOR-signalvejen er unormalt aktiveret i EC. Under processen med celletransformation fra normal til ondartet reguleres EMT af PI3K/AKT/mTOR-signalvejen, mens Wnt-signalvejen inducerer EMT i tumorceller og derved påvirker tumorinvasion og metastase. I denne undersøgelse fandt vi, at PIC kan opregulere ekspressionsniveauet for den epitellignende markør E-cdaherin i endometriecancer HEC-1A-celler og nedregulere ekspressionsniveauerne for den transkriptionshæmmende faktor Slug og vigtige effektormolekyler β-catenin og CD44-proteiner i Wnt-signalvejen. Resultaterne indikerer, at PIC kan hæmme Wnt-signalvejen for at fremkalde EMT-transformation i endometriecancerceller og derved undertrykke migration og invasion af HEC-1A-celler.
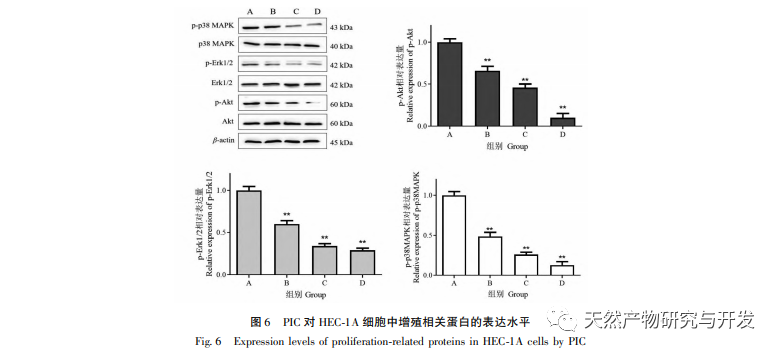
Forskningsrapporter viser, at PIC har potentiale til at få tumorer til at regrediere, fremkalde apoptose og hæmme angiogenese, invasion, migration og metastase. Vores tidligere forskning viste, at PIC kan hæmme spredningen, blokere cellecyklus og inducere apoptose af tredobbelt negativ brystkræftcellelinje MDA-MB-468 ved at hæmme Wnt/β - catenin-signalvej og har en god anti-tredobbelt negativ brystkræfteffekt. En anden undersøgelse viste, at PIC hæmmede metastase og invasion af brystkræftceller MCF-10A ved at hæmme den Hras-inducerede AKR-phosphorylering, MMP-2 og phosphatidylinositol 3-kinase (PI3K) aktiviteter og nedregulere ekspressionen af phosphatidylinositol (3,4,5) - triphosphat (PI3K) og spillede sin antibrystkræftrolle. In vitro-resultaterne af denne undersøgelse viste, at PIC har en signifikant lægemiddelkoncentrationsafhængig hæmmende effekt på spredning, migration og invasion af endometriecancerceller HEC-1A. Aktiveringen af MAPK-signalvejen er relateret til forekomsten og udviklingen af tumorer og er involveret i reguleringen af cellevækst, differentiering, overlevelse og død. Erk- og p38MAPK-proteiner er vigtige effektormolekyler i MAPK-signalvejen. Yan et al. fandt, at PIC hæmmer fosforyleringen af Erk1/2- og Akt-proteiner ved at påvirke MAPK- og AKT-signalvejene og derved undertrykke RANKL-induceret osteoklastgenerering og knogleresorption. På molekylært niveau viste denne undersøgelse yderligere, at PIC kan hæmme fosforyleringen af proliferationsrelaterede proteiner Akt, Erk1/2 og p38MAPK i HEC-1A-celler og effektivt undertrykke proliferation, migration og invasion af endometriecancerceller.
Sammenfattende viser resultaterne af denne undersøgelse, at PIC effektivt kan hæmme spredningen af endometriecancerceller HEC-1A, fremkalde celleapoptose og reducere HEC-1A-cellers migrations- og invasionsevne betydeligt. Mekanismen kan være relateret til hæmning af Akt-, Erk1/2- og p38MAPK-fosforylering i Akt/ERK/MAPK-signalvejen, nedregulering af ekspressionsniveauerne for invasions- og migrationsproteiner β-catenin, CD44 og Slug og opregulering af E-cdaherin-proteinekspressionsniveauer. Det er foreløbigt blevet bekræftet, at PIC har en hæmmende effekt på spredning, migration og invasion af endometriecancerceller. Dette eksperiment udførte dog kun foreløbige in vitro-undersøgelser på celleniveau, og den specifikke molekylære mekanisme for dens virkning mod endometriecancer skal stadig afklares yderligere gennem in vivo-undersøgelser.
