Planteekstrakter anvendes i vid udstrækning i lægemidler, fødevarer, kosmetik, tilsætningsstoffer, sundhedsprodukter og andre områder, og derfor skal forarbejdningsvirksomheder håndtere den tilsvarende licenskvalifikation i henhold til dens anvendelse eller industriledelse eller nationale regler osv:
1, som råvarer til lægemidler skal arkiveres;
2, forarbejdet som fødevarer skal ansøge om fødevareproduktionslicens (SC), fødevarekategorier: faste drikkevarer, helsekost, fødevaretilsætningsstoffer;
3, der anvendes som fodertilsætningsstoffer, skal ansøge om licens til produktion af fodertilsætningsstoffer;
4, salg af produkteksport, eksportproduktionsvirksomheder skal arkiveres.
For det andet er der mere end 30 frivillige certificeringer i planteekstraktindustrien, herunder systemcertificering (ISO), produktcertificering (Kosher, HALAL osv.), certificering af produktionsspecifikationer (GMP), økologisk certificering (China Organic Certification) og laboratoriecertificering (CNAS, CMA).
Her følger en beskrivelse af de tilladelser, der kræves til planteekstrakter, der bruges i lægemidler, fødevarer, kosmetik, sundhedsprodukter og andre områder.
Som kinesisk medicin udtrækker
Hovedorganet i arkiveringen af kinesiske medicinekstrakter er ekstraktproducenten, som skal opnå lægemiddelfremstillingslicensen, der indeholder omfanget af produktionen af kinesiske medicinekstrakter, overholde kravene i GMP og levere ekstraktprodukterne til pCm-producenten.
Registreringsoplysningerne for producenten af kinesisk medicinekstrakt skal omfatte:
1. Grundlæggende oplysninger om virksomheden og tekniske oplysninger om udtrækket;
2, "Drug Production License", "Business License" og andre støttedokumenter;
3, produktion af ekstrakter med kinesiske plantelægemidler, oplysninger om kinesiske medicintabletter, herunder oprindelse, base, kilde, implementering af
Standarder, blandingsspecifikationer og auditrapporter om leverandørernes kvalifikationer og kvalitetssikringssystem for produktionen;
4 、 Detaljeret produktionsproces for ekstrakterne, herunder proceskøreplan, nøgleparametre, større udstyr osv;
5, kvalitetsstandarder for intern kontrol af ekstrakter eller nationale farmaceutiske standarder for ekstrakter.
Den 29. juli 2014 udstedte State Bureau Food and Drug Administration Pharmaceutical and Chemical Supervision [2014] No. 135 "Notice of the Food and Drug Administration on Strengthening the Supervision and Management of Extracts and Extracts in the Production of Traditional Chinese Medicines", som kræver, at "de kinesiske medicinekstrakter, der er opført under recepten på den nationale lægemiddelstandard for pCms og med en separat national lægemiddelstandard, skal implementeres til rekordstyring. " Registrere succesen for planteekstraktvirksomhederne bør være i overensstemmelse med kravene i GMP for at organisere produktionen, for at sikre kvaliteten af sine produkter og dets daglige tilsyn med placeringen af den provinsielle (autonome regioner og kommuner) Food and Drug Administration er ansvarlig for.
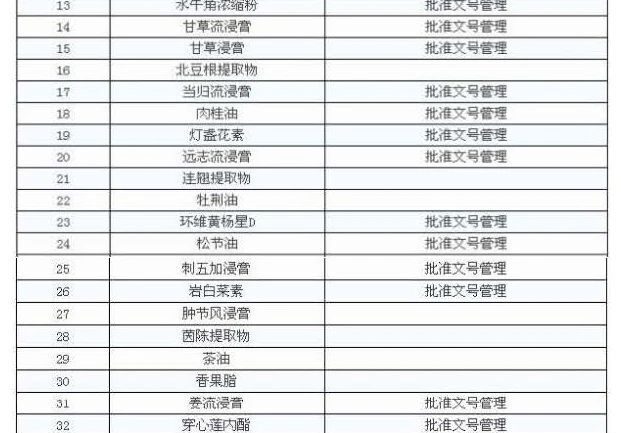
I overensstemmelse med kravene i meddelelsen er der 47 kinesiske medicinekstrakter, der kan indgives til forvaltning, det vil sige, at virksomheden kan producere deres egne, kan også købes, den anden skal udvindes af virksomheden selv.
Som råmaterialer til fremstilling af medicinske institutioner
Medicinske institutioner til at forberede præparater skal være en "medicinsk institutionspraksislicens" og i overensstemmelse med "medicinsk institution forberedelse forberedelse forberedelse kvalitetsstyringsstandard" for at opnå "medicinsk institution forberedelse licens", kan konfigurere deres egne præparater.
De administrative foranstaltninger til registrering af præparater til medicinske institutioner (til gennemførelse af forsøg) fastsætter, at medicinske institutioner, der ansøger om præparater, skal udføre tilsvarende prækliniske undersøgelser, herunder receptscreening, tilberedningsproces, kvalitetsindikatorer, farmakologi, toksikologiske undersøgelser osv. De kinesiske plantelægemidler, der anvendes i ansøgningen om præparater, skal have licens til at praktisere i medicinske institutioner. De kinesiske plantelægemidler og traditionelle kinesiske medicintabletter, der anvendes i ansøgningen om tilberedning, skal have lægemiddelgodkendelsesnumre og overholde de juridiske lægemiddelstandarder. Metoden specificerer også, at en af følgende omstændigheder ikke skal erklæres som et præparat til medicinske institutioner:
1, har markedet fået leveret varianter;
2 、 Sorter, der indeholder aktive ingredienser, der ikke er godkendt af den statslige fødevare- og lægemiddeladministration;
3, ud over allergenerne ud over biologiske produkter;
4, injektion af kinesisk medicin;
5, kinesisk medicin, kemisk sammensætning af forbindelsespræparatet;
6, narkotiske stoffer, psykotrope stoffer, giftige stoffer til medicinsk brug, radioaktive stoffer.
Bekendtgørelsen om gennemførelse af registrering af medicinske institutioners anvendelse af traditionelle teknikker til fremstilling af kinesiske medicinske præparater fastsætter, at traditionelle kinesiske medicinske præparater omfatter:
1, faste (piller, dispersioner, dans, barrer osv.), halvfaste (salve, pasta osv.) og flydende (tonika osv.) traditionelle doseringsformer fremstillet af kinesiske lægeurter ved pulverisering eller kun ved vand- eller olieekstraktion;
2, granulat fremstillet af kinesiske lægeurter ekstraheret med vand og kapsler fremstillet af kinesiske lægeurter knust;
3, spiritus og tinkturer fremstillet af kinesiske lægeurter udvundet ved hjælp af traditionelle metoder.
De traditionelle kinesiske medicinpræparater, der indgives af den medicinske institution, skal være i overensstemmelse med omfanget af diagnose og behandling, der er angivet i dens "licens til at praktisere i en medicinsk institution". En af følgende omstændigheder må ikke indgives:
1, "Preparations for Medical Institutions Registration Management Measures (for trial implementation)" i bestemmelserne om omstændighederne skal ikke erklæres som en medicinsk institutions forberedelser;
2, og markedet er blevet forsynet med varianter af forskellige doseringsformer af den samme recept;
3, kinesisk medicin formel partikler;
Kort sagt skal råmaterialerne til medicinske institutioners præparater være kinesiske urtemedicin eller kinesiske medicintabletter, ikke kinesiske medicinekstrakter, og medicinske institutioner kan kun købe hjemmelavede præparater, der er godkendt til registrering af råmaterialer.
Som råvarer til helsekost
Foranstaltningerne til administration af registrering og arkivering af sundhedsfødevarer, der blev bekendtgjort i 2015, fastslår klart, at CFDA forbyder bestilt behandling af kinesiske medicinekstrakter, og arkivering af planteekstrakter er blevet en ny tendens i udviklingen af industrien.
I slutningen af 2016 udstedte CFDA Review Rules for Health Food Production License, som yderligere standardiserede de specifikke regler for inddragelse af planteekstrakter i produktionen af helsekost. Ansøgere, der leverer plante- og dyreekstrakter til andre virksomheder som råvarer til produktion af helsekost, skal ansøge om produktionslicenser for råvareekstrakter i overensstemmelse med kravene i disse regler; de, der kun beskæftiger sig med udvinding af råvarer til helsekost produceret af virksomheden, ansøger om produktionslicenser for helsekostprodukter og behøver ikke at ansøge om produktionslicenser for råvareekstrakter separat. Det indikerer, at hvis virksomheden producerer sin egen helsekost, kan den selv udvinde planter og dyr. Produktionslicens for råvareekstrakt til sundhedsfødevarer skal markeres i artsoplysningerne i projektnavnet på råvareekstraktet, og i kolonnen Bemærkninger indeholder navnet på sundhedsfødevaren, registreringsnummeret eller registreringsnummeret og andre oplysninger.
Ansøgere, der ansøger om produktionslicens for sundhedsfødevareekstrakt, skal indsendes til sundhedsfødevareregistreringsdokumenter eller arkiveringscertifikat samt registreringsdokumenter eller arkiveringscertifikater, der er beskrevet i råvareekstraktet af produktionsprocessen, kvalitetsstandarder.
Kataloget over helsekostingredienser henviser til sikkerheds- og funktionsevalueringen og kan bruges til helsekoststoffer og deres tilsvarende liste over relevante oplysninger. Enhver enhed eller person kan på grundlag af relevant forskning foreslå Health Food Evaluation Center of the State Food and Drug Administration de råvarer, der skal medtages i kataloget over ingredienser til sundhedsfødevarer.
De råvarer, der ansøges om at blive optaget i kataloget over helsekostingredienser, skal opfylde følgende krav:
1, med en bred vifte af indenlandske og udenlandske fødevarehistorier og tilstrækkelig videnskabelig dokumentation;
2, med et klart doseringsområde og tilsvarende sundhedsfaglige funktioner i overensstemmelse med kravene i det sundhedsfaglige funktionskatalog;
3, med stabil og kontrollerbar kvalitet og tekniske krav;
4 、 Det har et videnskabeligt grundlag, der opfylder kravene til sikkerhed og effektivitet;
5, med videnskabeligt anvendelig, stabil og pålidelig effekt af ingredienser eller signaturingredienser, indholdsområde og testmetoder;
6, i overensstemmelse med den foreskrevne dosering og indtagelsesmetode, sikkert og uskadeligt for den relevante befolkning.

Som ingrediens i fødevarer
Ifølge loven om fødevaresikkerhed betyder "fødevarer alle former for færdige produkter og råvarer til menneskeføde eller drikke samt artikler, der både er fødevarer og medicin ifølge traditionen, men omfatter ikke artikler til terapeutiske formål." Der er ingen tvivl om, at planteekstrakter til fødevarer er fødevarer og skal godkendes i overensstemmelse med kravene i fødevaresikkerhedsloven. Planteekstrakter, der bruges til fødevareforarbejdning, skal udvindes af råvarer, der er udvalgt fra kataloget over lægemidler og fødevarer eller nye ressourcefødevarer.
Stoffer, der både er mad og medicin, henviser til de anvendelige dele af dyr og planter, der har traditionelle spisevaner, og som er opført i den nationale standard for kinesiske plantelægemidler. Stoffer, der er optaget i kataloget over råvarer til både fødevarer og medicin, skal opfylde følgende krav på samme tid:
1. I overensstemmelse med loven om fødevaresikkerhed og relevante bestemmelser;
2, i den kinesiske medicin kanon er der spiselige optegnelser, ingen toksicitetsoptegnelser fundet;
3, med traditionelle forbrugsvaner har normalt forbrug ikke vist sig at forårsage nogen akut eller subakut påvirkning af menneskers sundhed,
Kronisk eller anden potentiel skade på menneskers sundhed, i overensstemmelse med de ernæringsmæssige krav bør have;
4, i overensstemmelse med de relevante love og regler for beskyttelse af kinesiske urtemedicinske ressourcer;
5, er blevet inkluderet i de nationale standarder for kinesiske plantelægemidler.
Nye ressourcefødevarer omfatter:
Dyr, planter og mikroorganismer, der ikke normalt indtages i Kina;
2, fra dyr, planter og mikroorganismer, der er adskilt fra fødevareråvarer, som ikke normalt indtages i Kina;
3, nye sorter af mikroorganismer, der anvendes i fødevareforarbejdning;
4, på grund af brugen af nye produktionsprocesser, der fører til, at den oprindelige sammensætning eller struktur af fødevareingredienserne er ændret.
Produktion og håndtering eller brug af nye ressourcer for fødevareenheder eller enkeltpersoner i produktet for første gang på markedet skal rapporteres til sundhedsministeriet til gennemgang og godkendelse. Indsend følgende materialer:
1, nye ressourcer til fødevarehygiejne og ansøgningsskema til administrativ godkendelse;
2, udviklingsrapporter og sikkerhedsforskningsrapporter;
3, en kort beskrivelse af produktionsprocessen og et flowdiagram;
4, standarder for produktkvalitet;
5, indenlandsk og udenlandsk forskning og anvendelse og relaterede sikkerhedsoplysninger;
6, produktetiketter og instruktioner;
7, andre oplysninger til hjælp for evalueringen.
Hvis virksomheden vælger andre planter eller deres ekstrakter uden for kataloget over medicinske fødevarer og nye ressourcefødevarer som råvarer til fødevareforarbejdning, er der tre konventionelle løsninger:
1, store virksomheder for at undgå risikoen for at erklære nye ressourcefødevarer;
2, kan også nu forarbejdes til fødevarer som råvarer, udarbejdelse af virksomhedsstandarder, gennem registrering og opnåelse af SC-certificering, i det mindste den lokale regering anerkendt, men andre områder af salgsrisiko, (f.eks. Hainan Ganoderma Lucidum-begivenhed).
3, kan også skrives til provinsens sundhedskommission for at se, om du kan bruge regeringens adfærd over for den nationale sundhedskommission (kræver et stærkt netværk).
(A) nye fødevareingredienser, almindelig fødevaredefinition og -håndtering
Nye fødevareråvarer henviser til følgende elementer, der ikke har nogen traditionelle spisevaner i Kina: dyr, planter og mikroorganismer; komponenter isoleret fra dyr, planter og mikroorganismer; fødevarekomponenter, hvis oprindelige struktur er blevet ændret; og andre nyudviklede fødevareråvarer. Artikler, der hører under en af ovenstående omstændigheder, skal, hvis de skal udvikles til produktion og drift af almindelige fødevarer, anmeldes til godkendelse i overensstemmelse med bestemmelserne i "Administrative foranstaltninger til undersøgelse af sikkerheden ved nye fødevareingredienser".
For fødevarer med traditionelle spisevaner i overensstemmelse med de administrative foranstaltninger til undersøgelse af sikkerheden ved nye fødevareingredienser kan virksomhedernes produktion og drift kombineres med foranstaltningerne og gennemføres i overensstemmelse med bestemmelserne i fødevaresikkerhedsloven.
Det tidligere sundhedsministerium udsendte i 2002 en meddelelse om yderligere standardisering af forvaltningen af råvarer til sundhedsfødevarer og meddelte, at varerne på listen over varer, der både er fødevarer og lægemidler, kan bruges til produktion af almindelige fødevarer, og stammerne på listen over stammer, der kan bruges til fødevarer, blev offentliggjort i 2010 og kan bruges til produktion af almindelige fødevarer.
I 1998 udstedte det tidligere sundhedsministerium cirkulæret om tilrettelæggelsen af det nationale marked for sundhedsfødevarer i 1998, som anførte de nye ressourcefødevarer af rapspollen, majspollen, fyrrepollen, solsikkepollen, Zizyphus-pollen, boghvedepollen, sesampollen, sorghum-pollen, konjac, Spirulina obtususifoliae, Spirulina viridulae, Prickly Pear, Rose Eggplant, Silkworm Pupa, som almindelige fødevareprodukter.
(ii) Definition og håndtering af almindelige fødevare- og helsekostråvarer
Det tidligere sundhedsministerium udsendte i 2002 meddelelsen om yderligere standardisering af forvaltningen af råvarer til helsekost, som offentliggjorde listen over varer, der kan bruges til helsekost, og listen over varer, der er forbudt til helsekost. Der henvises til cirkulæret for de specifikke regler om håndtering af ingredienser til helsekost.
De artikler, der er opført på listen over artikler, der kan bruges i helsekost, og som blev offentliggjort af det tidligere sundhedsministerium i 2002, kan kun bruges i helsekost. Bortset fra de artikler, der kan anvendes i almindelige fødevarer, må artiklerne på listen over artikler, der kan anvendes i helsekost, ikke produceres og anvendes som råvarer til almindelige fødevarer. Hvis der er behov for at udvikle artiklerne på listen over artikler, der kan anvendes i helsekost, til produktion af almindelige fødevarer, skal de anmeldes til godkendelse i overensstemmelse med de procedurer, der er fastsat i Measures for the Administration of the Examination of the Safety of New Food Raw Materials (foranstaltninger til administration af undersøgelsen af sikkerheden ved nye fødevareråvarer).
Som kosmetiske råmaterialer
Plantebaseret kosmetik kategoriseres i kosmetik til særlige formål og kosmetik til ikke-særlige formål, som begge kræver kosmetikproduktionstilladelser.
Råvarer, der anvendes i kosmetik, skal være i kataloget over kosmetiske råvarer, råvarerne er ikke i kataloget, skal være i overensstemmelse med de plantebaserede kosmetiske nye råvarer til de relevante procedurer, plantebaserede kosmetiske nye råvarer henviser til første gang i Kinas område til kosmetisk produktion af naturlige råvarer af plante (inklusive alger) oprindelse. En enkelt ingrediens ekstraheret fra planter eller stærkt rensede ingredienser falder ikke inden for denne definition.
Ansøgning om administrativ licensering af nye plantebaserede kosmetiske råvarer skal være i overensstemmelse med "bestemmelserne om administrativ licensering af kosmetikdeklaration og accept" og "ny kosmetisk råmaterialedeklaration og gennemgang af vejledningen" og andre relevante krav, indsende administrativ licenseringserklæring. Derudover som kosmetiske råmaterialer til specielle formål (f.eks.: er blevet brugt i vid udstrækning i anti-aging-produkter i en række kinesiske medicinekstrakter, såsom ginseng, astragalus, gibberellinsyre, gevirfløjl, Ganoderma lucidum, havtorn, Poria cocos, Angelica sinensis, perle, ginkgo biloba og aften primrose osv.) Tilsvarende oplysninger om toksikologisk sikkerhedsevaluering skal også indsendes.
Politikker for urteekstrakter i Europa, USA og andre lande
Håndteringen af naturlægemidler i USA er relativt tilbagestående. I Dietary Supplement Health and Education Act, som USA har vedtaget, omfatter definitionen af "kosttilskud" "urter eller andre planter" samt "ethvert koncentrat" heraf, hvilket uden tvivl omfatter "urter eller andre planter". "Dette efterlader ingen tvivl om planteekstrakters juridiske status som kosttilskud.
I Tyskland er det tilladt at registrere planteekstrakter som receptpligtige lægemidler i lovgivningsproceduren. Der er omkring 60.000 slags registrerede lægemidler i Tyskland, som indeholder urteingredienser, hvoraf de fleste er urteinfusioner, og der er en streng godkendelsesprocedure for traditionelle kinesiske lægemidler, hvis de ønsker at blive brugt som botaniske lægemidler i Tyskland. Generelt set kommer kinesiske lægemidler i Kina ind i Tyskland i form af sundhedsprodukter og ansøger om fødevarestyring.
I EU kategoriseres lægemidler i 8 typer, dvs. patenterede lægemidler, generiske lægemidler, håndkøbsmedicin, naturlægemidler, vaccineprodukter, blodprodukter, biologiske produkter og antidepressiva. Ud over Storbritannien og Holland regulerer Tyskland, Frankrig og Italien alle naturlige botaniske stoffer som receptpligtig medicin eller håndkøbsmedicin, og ændringen af det europæiske direktiv om registreringsproceduren for botaniske lægemidler, der blev vedtaget i 2003, fastsætter, at traditionelle botaniske lægemidler, der oprindeligt var underlagt de relevante fødevareregler, stadig vil være underlagt de relevante fødevareregler, hvis de indeholder naturlige botaniske stoffer eller ekstrakter af naturlige botaniske stoffer i en mængde, der er lavere end den medicinske dosis. Forordninger.
Brugen af traditionel kinesisk medicin i Japan er ekstremt begrænset. Bortset fra de 210 godkendte recepter er Ministeriet for Sundhed og Velfærd (MHLW) på nuværende tidspunkt usædvanligt strenge med hensyn til at godkende tilføjelsen af nye kinesiske plantelægemidler, idet de behandler kinesiske plantelægemidler på samme måde som nye lægemidler, hvilket næsten er ensbetydende med at lukke døren, og der er også en hel del restriktive foranstaltninger i forbindelse med godkendelse af importerede proprietære kinesiske lægemidler. Men i de senere år har den japanske regering tilsyneladende lempet sin kontrol med helsekost, f.eks. ved at fjerne restriktioner på doseringsformer og lempe restriktionerne på de typer af naturlige planteprodukter, der kan bruges i helsekost.
