Hvad er forskellen mellem alfa-amylase, beta-amylase og glykosyleret amylase?
I henhold til rollen som α-amylase, β-amylase og saccharification amylase-diagram er det let at lade en person fejlagtigt tro, at rollen som de tre substrater skal være henholdsvis stivelse, dextrin og maltose, og der er børnesko, der engang spurgte mig, at saccharification amylase ikke er maltoseenzym. Derfor føler jeg behov for at lave en lille analyse af de tre substraters rolle.
For at forstå den rolle, som flere typer amylaser spiller, skal man først identificere to grupper af begreber: stivelse med lige kæde og stivelse med forgrenet kæde, α-1,4-glykosidisk binding og α-1,6-glykosidisk binding.
Der findes to typer stivelse: stivelse med lige kæde og stivelse med forgrenet kæde. Ligekædet amylopektin er en uforgrenet spiralformet struktur, der består af glukoserester, som kun er forbundet med α-1,4-glykosidiske bindinger; forgrenet amylopektin er dannet af glukoserester, der er forbundet med α-1,4-glykosidiske bindinger i hver kæde, men α-1,6-glykosidiske bindinger er til stede ved forgreningspunkterne. α-Amylase og dets virkning
α- Amylase, også kendt som endo amylase, er en metallohydrolase, der kræver calciumioner, som binder sig til enzymproteinet for at udvise aktivitet, hvilket kan gå tabt ved behandling med chelateringsmidlet EDTA.α- Amylase er en støkiometrisk amylase, der er i stand til at randomisere sin aktivitet.
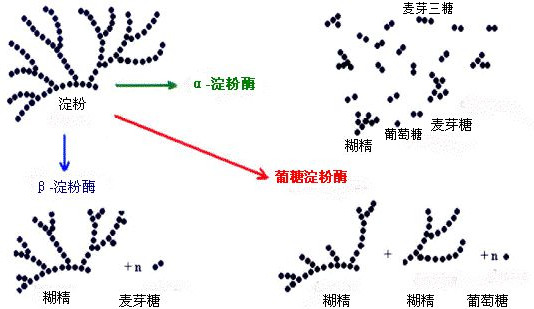
α- Amylase kan tilfældigt hydrolysere den α-1,4-glykosidiske binding i stivelse, men kan ikke hydrolysere den α-1,6-glykosidiske binding.
Hvis substratet er stivelse med lige kæde, producerer hydrolysen glukose, maltose og maltotriose; hvis det fungerende substrat er forgrenet stivelse, er hydrolyseprodukterne glukose, maltose, maltotriose og α-dextrin, der indeholder α-1,6-glykosidiske bindinger, der indeholder mere end tre glukoserester. Det skal også bemærkes, at α og β i α-amylase og β-amylase ikke angiver noget konformationsforhold, men blot er nummereret.
Der er mange måder at producere α-amylase på i naturen, f.eks. er mikrobiel fermentering en af de mest almindelige måder. Derudover kan dette enzym også udvindes fra planter eller dyr, og egenskaberne ved amylase opnået på forskellige måder er forskellige. I den industrielle produktionsproces fremstilles det normalt ved fermentering af svampe og bakterier på grund af den store efterspørgsel efter α-amylase. Bacillus subtilis, Bacillus sphaericus, Streptomyces suis osv. kan producere α-amylase. β-Amylase og dens rolle
β-amylase, også kendt som exo amylase, er en hydrolase, der indeholder sulfhydrylgrupper. Enzymet starter fra den ikke-reducerende ende af stivelsen og hydrolyserer den α-1,4-glykosidiske binding sekventielt med to glukoserester for at producere maltose. Det kan ikke hydrolysere α-1,6-glykosidbindingen, og det kan ikke krydse forgreningspunktet og stå tilbage med et meget langt dextrin, dvs. β-dextrin.
Når β-amylase virker på stivelse med lige kæder, producerer den derfor næsten udelukkende maltose; når den bruges på stivelse med forgreninger, er produkterne maltose og β-dextrin.
R-enzym og dets virkning
R-enzymer, også kaldet afgreningsenzymer, virker på den α-1,6-glykosidiske binding. I nærvær af afgreningsenzymer hydrolyseres α-1,6-glykosidbindingen i α-dextrin- og β-dextrin-arterne, og de forgrenede kæder fjernes.
De resterende lige kæder hydrolyseres derefter af α-amylase og β-amylase for at producere maltose og glukose. R-amylaser kan dog ikke direkte hydrolysere de α-1,6-glykosidiske bindinger i forgrenet stivelse.
Glykosylerende amylase og dens virkning
Glykosylerende amylase eller glucoamylase er et enzym, der hydrolyserer stivelse til glukose, hvor hydrolyseprocenten kan nå op på 100%, og bruges ofte som et forsukringsmiddel til stivelse.
Glucoamylase er ikke særlig specifik og kan anvendes på mange stoffer, den kan ikke kun klippe α-1,4-glykosidbindingen fra den ikke-reducerende ende af stivelsesmolekylet, men også klippe α-1,6-glykosidbindingen, bare at hydrolysen af α-1,4-glykosidbindingen er lidt hurtigere. Den kan også hydrolysere dextrin, maltose og glykogen. Hydrolysen indledes fra enden af substratmolekylet og er en exonuklease.
Resultaterne af virkningen af α-amylase, β-amylase og glykolytisk amylase på forgrenet stivelse kan illustreres i følgende diagram: